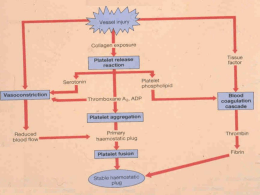
Bula do Profissional de Saúde EVICEL® (fibrinogênio + trombina + cloreto de cálcio) selante de fibrina humana I) IDENTIFICAÇÃO DO MEDICAMENTO Nome do produto: EVICEL® Ingrediente ativo do Componente Biológico Ativo 2 (CBA2): fibrinogênio Ingredientes ativos da Solução de Trombina: trombina + cloreto de cálcio USO ADULTO E PEDIÁTRICO Forma farmacêutica Solução selante para aplicação local via spray ou gotejamento simultâneo no tecido Apresentação EVICEL® é fornecido para uso único e consiste em uma embalagem contendo um frasco de CBA2 e um frasco de Solução de Trombina. Apesar de CBA2 e Solução de Trombina serem fornecidos na mesma embalagem secundária, os mesmos estão disponíveis em frascos individuais (embalagens primárias), separados, contendo cada um 1 ou 2 ou 5 ml de solução congelada. Após serem descongelados, eles são combinados por meio de aplicação simultânea. Para a aplicação simultânea utiliza-se um dispositivo de aplicação modular. O dispositivo de aplicação modular pode ser adquirido separadamente e deve ser armazenado e conservado à temperatura ambiente, pois se encontra em embalagem separada do produto biológico. A embalagem do dispositivo de aplicação contém um aplicador modular, de uso exclusivo para o EVICEL®. Os dispositivos são acompanhados de um tubo de ar com um filtro de 0,2 μm. Os dispositivos de aplicação são estéreis e para uso único. Via de administração OS DOIS COMPONENTES DO EVICEL® (CBA2 E SOLUÇÃO DE TROMBINA) DEVEM SER DESCONGELADOS E ADMINISTRADOS POR SPRAY OU GOTEJAMENTO DIRETAMENTE SOBRE A SUPERFÍCIE DO TECIDO A SER TRATADO. Um dispositivo de aplicação modular é necessário para esse propósito. O dispositivo de aplicação modular pode ser adquirido separadamente e deve ser armazenado e conservado à temperatura ambiente pois se encontra em embalagem separada do produto biológico. Esse dispositivo permite que quantidades iguais dos dois componentes sejam aplicadas simultaneamente, assegurando a mistura dos mesmos, o que é essencial para o produto alcançar sua eficácia. Para a aplicação do selante de fibrina em locais de difícil acesso, uma ponta estéril de 35 cm ou 45 cm pode ser utilizada. Composição Componente Biológico Ativo 2 (CBA2) Ingrediente ativo fibrinogênio: 55 – 85 mg/ml Excipientes cloridrato de arginina, glicina, cloreto de sódio, citrato de sódio, cloreto de cálcio e água para injeção Solução de Trombina Ingredientes ativos trombina: 800 - 1200 UI/ml cloreto de cálcio: 5,6 – 6,2 mg/ml Excipientes albumina humana, manitol, acetato de sódio e água para injeção Cada lote do Componente Biológico Ativo 2 (CBA2) e da Solução de Trombina são fabricados a partir de plasma humano. II) INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE 1. INDICAÇÕES Hemostasia geral: EVICEL® é usado como tratamento de suporte em cirurgias, quando técnicas cirúrgicaspadrão não são suficientes para a melhora da hemostasia. 2. RESULTADOS DE EFICÁCIA Foram realizados estudos clínicos demonstrando a hemostasia de EVICEL® Selante de Fibrina Humana em cirurgias vasculares e cirurgias retroperitoniais e intra-abdominais. Além disso, outros estudos foram realizados com selantes de fibrina formados a partir de plasma humano para cirurgias ortopédicas e de fígado. Estudos Clínicos: a) Cirurgia Retroperitoneal e Intra-Abdominal Em uma avaliação prospectiva, randomizada e controlada da eficácia hemostática do EVICEL®, como adjunto da hemostasia em hemorragias no tecido mole durante a cirurgia retroperitoneal ou intraabdominal, o EVICEL® mostrou-se superior ao produto de controle (Surgicel, celulose regenerada oxidada) na obtenção da hemostasia em menos de 10 minutos (veja tabela abaixo). A superioridade também foi estabelecida nos desfechos secundários de eficácia de 7 e 4 minutos. Variável EVICEL® n=66 Controle n=69 Risco Relativo (RR) IC a 95% para RR Hemostasia aos 10 min 63 (95,5%) 56 (81,2%) 1,18 1,04; 1,36 Hemostasia ≤ 7 min 60 (90,9%) 53 (76,8%) 1,18 1,02; 1,40 Hemostasia ≤ 4 min 50 (75,8%) 37 (53,6%) 1,41 1,10; 1,86 b) Cirurgia Vascular Um estudo prospectivo e randomizado foi realizado, para comparar a eficácia hemostática do selante de fibrina, em comparação à compressão manual, durante procedimentos cirúrgicos vasculares, utilizando material de enxerto de politetrafluoretileno em uma anastomose arterial de acesso femoral da extremidade para a lateral ou do membro superior. Uma diferença estatisticamente significativa (p<0,001) no tempo da hemostasia foi observada a favor do grupo de tratamento, sendo que 83,3% dos pacientes de teste versus 39,7% dos pacientes de controle obtiveram a hemostasia aos 4 minutos. Número (%) de pacientes que obtiveram a hemostasia EVICEL® Compressão Manual n=72 n=68 Aos 4 minutos 60 (83,3%) 27 (39,7%) ≤ 7 minutos 63 (87,5%) 42 (61,8%) ≤ 10 minutos 66 (91,7%) 48 (70,6%) 3. CARACTERÍSTICAS FARMACOLÓGICAS O produto biológico EVICEL® é um selante de fibrina derivado do plasma humano que consiste em dois componentes separados, os quais são combinados durante a aplicação. O primeiro componente é uma solução concentrada de fibrinogênio humano, enquanto que o segundo componente é uma solução de trombina humana contendo cloreto de cálcio. Quando combinadas, as duas preparações rapidamente formam um coágulo de fibrina, reproduzindo os estágios finais da cascata de coagulação. O sistema de aderência da fibrina inicia a última fase da coagulação sangüínea fisiológica. A conversão do fibrinogênio em fibrina ocorre por meio da divisão do fibrinogênio em monômeros de fibrina e fibrinopeptídios. Os monômeros de fibrina se aglutinam e formam um coágulo de fibrina. O fator XIIIa, que é ativado do Fator XIII pela trombina, faz uma polimerização cruzada com a fibrina. Os íons de cálcio são necessários para a conversão do fibrinogênio e polimerização cruzada da fibrina. À medida que a cicatrização da lesão avança, a atividade fibrinolítica elevada é induzida pela plasmina, e a decomposição da fibrina em produtos de degradação de fibrina é iniciada. Farmacocinética Absorção O produto biológico EVICEL® é indicado somente para uso sobre a lesão, portanto, é metabolizado e absorvido pelo sistema fisiológico fibrinolítico, da mesma maneira que um coágulo endógeno. A administração intravascular é contra-indicada. Como conseqüência, estudos farmacocinéticos intravasculares não foram realizados em seres humanos, visto que isso poderia ser considerado do ponto de vista ético inaceitável para esse tipo de produto. Com isso, estudos farmacocinéticos foram realizados utilizando modelos de fígado de coelhos, para avaliar a absorção e eliminação da trombina, quando aplicada na superfície cortada do fígado, resultante de hepatectomia parcial. Com o uso de 125I-trombina, demonstrou-se uma lenta absorção dos peptídios inativos biologicamente, resultantes da decomposição da trombina, alcançando uma Cmax no plasma após 6-8 horas. Na Cmax, a concentração de plasma representou apenas 1-2% da dose aplicada. Distribuição O produto biológico EVICEL® não é distribuído sistemicamente. Biotransformação e Eliminação Os selantes de fibrina/hemostáticos são metabolizados da mesma forma que a fibrina endógena, por meio da fibrinólise e fagocitose, as quais são iniciadas pela ativação da proenzima plasminogênio para enzima plasmina. A ativação ocorre após o plasminogênio ser adsorvido pelo coágulo de fibrina, e pode ocorrer tanto por uma rota endógena envolvendo ativação de plasminogênio pelo fator XIIa quanto pela rota exógena envolvendo o ativador tissular de plasminogênio e uroquinase presente no endotélio vascular. A plasmina resultante é capaz de dividir fibrina em produtos de degradação solúveis. 4. CONTRA-INDICAÇÕES • O EVICEL® não deve ser aplicado intravascularmente; • O EVICEL® é contra-indicado para uso por pacientes que já apresentaram reação sistêmica severa ou anafilática a produtos derivados de sangue humano ou a qualquer um dos constituintes do produto; • O EVICEL® não deve ser utilizado em casos de sangramentos graves arteriais e venosos. Uso em idosos, crianças e outros grupos de risco Gravidez e lactação A segurança dos selantes de fibrina/hemostáticos para o uso em mulheres grávidas ou durante a fase de amamentação não foi estabelecida em ensaios clínicos controlados. Os estudos experimentais com animais são insuficientes para avaliar a segurança com relação à reprodução, desenvolvimento de embrião ou feto, curso gestacional e desenvolvimento peri e pós-natal. Por essa razão, o produto deve ser administrado em mulheres grávidas e amamentando apenas se for claramente necessário. ESTE MEDICAMENTO NÃO DEVE SER UTILIZADO POR MULHERES GRÁVIDAS SEM ORIENTAÇÃO MÉDICA. Uso pediátrico Não há dados disponíveis até o momento para o uso do produto em idades entre 0 a 6 meses (recémnascidos). Dados limitados estão disponíveis para a segurança e eficácia do produto em crianças. Dos 135 pacientes submetidos a cirurgias intra-abdominais e retroperitoneais, incluídos e tratados em estudos adequados e bem controlados de EVICEL®, 4 foram pacientes pediátricos (16 anos ou menores). Destes, 2 tinham entre 2 e 11 anos e 2 eram adolescentes de 12 a 16 anos. É rara a presença de pacientes pediátricos em cirurgias vasculares e, portanto, não foram incluídas crianças nos estudos clínicos do uso do produto em cirurgias vasculares. Dos 155 pacientes tratados em estudos adequados e bem controlados de EVICEL® em cirurgia de fígado, oito foram pacientes pediátricos. Destes, cinco tinham menos de 2 anos e três entre 2 e 12 anos. O uso de EVICEL® em pacientes pediátricos com idade acima de 6 meses é apoiado por esses dados e por extrapolação dos dados para segurança e eficácia em adultos. Os dados não podem ser extrapolados para recém-nascidos com idades entre 0 a 6 meses. Uso geriátrico Estudos clínicos incluíram 101 pacientes com idade igual ou superior a 65 anos (30 submetidos à cirurgia intra-abdominal ou retroperitoneal, 24 submetidos à cirurgia de fígado e 47 submetidos à cirurgia vascular). Não foram observadas diferenças na segurança e eficácia do produto entre o uso geriátrico e o uso em pacientes mais jovens. NÃO HÁ CONTRA-INDICAÇÃO RELATIVA A FAIXAS ETÁRIAS 5. ADVERTÊNCIAS E PRECAUÇÕES • Somente para uso sobre a lesão. Não aplicar intravascularmente; • Não há dados adequados disponíveis para dar suporte ao uso deste produto em procedimentos para colar tecido, aplicação através de um endoscópio para o tratamento de sangramento ou na anastomose gastrintestinal; • Podem ocorrer complicações tromboembólicas com risco de vida, se o produto for aplicado involuntariamente de forma intravascular; • Antes da administração de EVICEL®, deve-se tomar cuidado para que as partes do corpo fora da área de aplicação desejada estejam suficientemente protegidas (cobertas), para prevenir a aderência do tecido em locais indesejados; • Como acontece com qualquer produto contendo proteína, há o risco de reações alérgicas de hipersensibilidade. Os sinais de reações de hipersensibilidade incluem urticárias, urticárias generalizadas, enrijecimento de tórax, respiração ofegante, hipotensão e anafilaxia. Se esses sintomas ocorrerem, a administração deve ser imediatamente descontinuada; • Em caso de choque, tratamento médico-padrão para choque deve ser implementado; • Medidas-padrão para prevenir infecções, resultantes do uso de produtos medicinais preparados a partir de sangue ou plasma humano incluem a triagem de doadores, triagem de cada doação de cada pool de plasma, quanto a marcadores específicos de infecção e a inclusão de etapas de fabricação eficazes para a inativação/remoção viral. Independentemente disso, quando produtos medicinais preparados a partir de sangue ou plasma humano são administrados, a possibilidade de transmissão de agente infectantes não pode ser totalmente eliminada. Isso também se aplica a vírus desconhecidos ou que surgiram recentemente e outros patogênicos. As medidas tomadas são consideradas eficazes para vírus envelopados, tais como HIV, HCV e HBV. • As medidas tomadas talvez não sejam muito úteis contra vírus não-envelopados, como o HAV e o parvovírus B19. • A infecção por parvovírus B19 pode ser crítica para mulheres grávidas (infecção fetal) e para indivíduos com imunodeficiência ou eritropoiese elevada (como por exemplo, anemia hemolítica). • Não recongele CBA2 ou Solução de Trombina uma vez que tenham sido descongelados. • Aplique uma fina camada de EVICEL®. Um excesso na espessura do coágulo pode interferir negativamente na eficácia do produto e no processo de cicatrização de feridas. • Na aplicação de EVICEL® por pulverização, a pressão utilizada deve estar dentro da faixa de pressão recomendada. Na ausência de uma recomendação específica, evitar o uso de pressão acima de 1,4 – 1,7 bar. Não pulverizar a uma distância menor do que a recomendada. Na ausência de uma recomendação específica, evitar a pulverização a uma distância menor que 10-15 cm da superfície do tecido. Na pulverização de EVICEL®, alterações na pressão arterial, pulso, saturação de oxigênio e quando estiver no final do CO2, devem ser monitorados devido à possibilidade de ocorrência de ar ou embolia gasosa. Cada unidade de plasma, obtida para produção do EVICEL®, é testada pelo fornecedor de acordo com os testes sorológicos aprovados pelo FDA para HBsAg, HIV-1 & 2 Ab e HCV ab, bem como de acordo com os métodos de Nucleic Acid Testing (NAT) para HCV e HIV-1, devendo apresentar resultados negativos (não-reativos) em todos os testes. Além disso, o plasma é testado usando NAT para HAV e HBV. Contudo, como a eficácia desses métodos de teste para detectar os níveis baixos de material viral está ainda sob investigação, a significância de um resultado negativo para esses vírus é desconhecida. É também realizado o NAT para parvovírus B19, e o nível de contaminação não deve exceder às 10.000 cópias/ml. Esse limite é aplicado a fim de restringir a carga viral do parvovírus B19 no pool de plasma de partida. Além da triagem do plasma de fonte, cada pool de fabricação é testado quanto ao HBsAg, HIV-1 & 2 Ab e HCV por meio do NAT. Entretanto, o teste do pool de fabricação apresenta uma sensibilidade menor que o teste da unidade individual. O procedimento de fabricação do EVICEL® inclui etapas de processamento, desenvolvidas para reduzir o risco de transmissão viral. Em particular, o CBA2 e a Solução de Trombina são submetidos a duas etapas distintas de inativação/remoção viral, que estão sumariadas na tabela a seguir: Componente Etapa CBA2 Solução de Trombina 1 Tratamento com Solvente/Detergente (SD) Tratamento Solvente/Detergente (SD) 2 Pasteurização Nanofiltração viral Entretanto, visto que para os componentes do produto biológico EVICEL®, tais procedimentos não são totalmente efetivos contra o vírus da hepatite A e o parvovírus humano B19, o risco de transmissão desse agente infeccioso permanece possível. Os sintomas de uma infecção por parvovírus humano B19 incluem febre, sonolência, calafrios e coriza, seguido por dores nas articulações e lesões na pele após um período de 2 semanas. A evidência de hepatite A pode apresentar sintomas como falta de apetite durante dias ou semanas, fadiga e febre leve seguida de náusea, vômito e dor abdominal. Sintomas comuns são também urina escura e aparência amarelada. Nestes casos, os pacientes devem procurar assistência médica assim que evidenciar algum sintoma. É extremamente recomendado que toda vez que EVICEL® for administrado em um paciente, o nome e o número de lote do produto sejam registrados, para manter uma ligação entre o paciente e o lote do produto. Este produto medicinal não pode ser misturado com outros produtos medicinais e precisa ser aplicado com o dispositivo de aplicação modular. O dispositivo de aplicação modular pode ser adquirido separadamente e deve ser armazenado e conservado à temperatura ambiente pois se encontra em embalagem separada do produto biológico. Se a embalagem de qualquer um dos componentes de EVICEL® estiver danificada, o produto deve ser descartado. 6. INTERAÇÕES MEDICAMENTOSAS Nenhum estudo de interação formal foi realizado. Como ocorre para produtos ou soluções de trombina comparáveis, o produto pode ser desnaturado após a exposição a soluções que contenham álcool, iodo ou metais pesados (por exemplo, soluções anti-sépticas). Tais substâncias devem ser removidas o máximo possível, antes da aplicação do produto. 7. CUIDADOS DE ARMAZENAMENTO DO MEDICAMENTO Armazenamento em longo prazo (frascos congelados) Armazene os frascos embalados no cartucho externo e congelados a – 18 ºC ou a temperaturas mais baixas, protegidos da luz, por até 2 anos a partir da data de fabricação. Uma vez descongelado, o produto não pode ser congelado novamente. Armazenamento em curto prazo (após o descongelamento) Frascos ainda não abertos podem ser armazenados de 2 a 8ºC protegidos da luz por até 30 dias. Não utilize o produto biológico EVICEL® após expirar a data de validade presente na caixa do produto ou após 30 dias se armazenado de 2 a 8ºC em refrigerador. A embalagem do dispositivo de aplicação modular, que pode ser adquirido separadamente, deve ser armazenada à temperatura ambiente. Após aberto o frasco, quando as soluções de CBA2 e Trombina forem transferidas para o dispositivo de aplicação, o produto deve ser usado imediatamente. Não recongele CBA2 ou Solução de Trombina uma vez que tenham sido descongelados. Número de lote e datas de fabricação e validade: vide embalagem. Não use o medicamento com prazo de validade vencido. Guarde-o em sua embalagem original. Antes de usar, observe o aspecto do medicamento. Todo medicamento deve ser mantido fora do alcance das crianças. 8. POSOLOGIA E MODO DE USAR Posologia CBA2 e Solução de Trombina se apresentam como massas opacas de coloração entre branca e levemente amarelada quando congeladas e soluções entre transparente e ligeiramente opaca, incolor e ligeiramente amarelada quando descongeladas. Os componentes não apresentam conservantes. O volume de EVICEL® a ser aplicado e a freqüência de aplicação devem ser sempre determinados, considerando as necessidades clínicas básicas do paciente. A dose a ser aplicada é determinada por variáveis incluindo, mas não se limitando, ao tipo de intervenção cirúrgica, tamanho da área e modo de aplicação indicado, bem como ao número de aplicações. A aplicação do produto deve ser individualizada pelo médico que trata o paciente. Em estudos clínicos, as dosagens normalmente têm variado de 5 a 10 ml do produto combinado. Para alguns procedimentos (como por exemplo, traumatismo de fígado ou a hemostasia de grandes superfícies queimadas), um volume maior poderá ser necessário. O volume inicial do produto a ser aplicado em um local anatômico escolhido ou área de superfície desejada deve ser suficiente para cobrir toda a área de aplicação indicada. A aplicação pode ser repetida, se necessário. O produto biológico EVICEL® deve ser aplicado na forma de gotejamento ou spray sobre o tecido em pequenas descargas (0,1 – 0,2 ml), para produzir uma camada fina e uniforme. A quantidade de EVICEL® necessária depende da área do tecido a ser tratada e do método de aplicação. Apenas para orientação, se uma camada de 1 mm de espessura for produzida via spray, a superfície que pode ser coberta por cada uma das apresentações estão dadas na tabela abaixo: Volume de apresentação de EVICEL® Área coberta com uma camada de 1 mm de espessura 1,0 ml 20 cm2 2,0 ml 40 cm2 5,0 ml 100 cm2 Técnicas cirúrgicas padrão para controle hemorrágico, incluindo sutura, ligadura e cautério, devem ser usadas antes da aplicação de EVICEL®. Excesso de sangue deve ser removido do local de aplicação se possível, embora não seja essencial que a área esteja seca, e EVICEL® deve então ser aplicado com o dispositivo de aplicação. Esse dispositivo permite a aplicação simultânea de igual quantidade dos dois componentes e assegura sua mistura, que é essencial para que o selante atinja eficácia ótima. EVICEL® forma uma camada transparente no local aplicado através do qual pontos específicos de sangramento podem ser observados, e nesses casos pode ser suturado ou eletrocauterizado através da camada de EVICEL®. Modo de Usar A. Descongelando CBA2 e Solução de Trombina Descongele os frascos em um dos seguintes modos: • 2 a 8ºC (refrigerador): frascos descongelados dentro de 1 dia; ou • 20 a 25ºC (temperatura ambiente): frascos descongelados dentro de 1 hora; ou • a 37ºC (por exemplo, em banho-maria, usando a técnica asséptica ou aquecendo os frascos nas mãos): o descongelamento do conteúdo dos frascos deve ocorrer em 10 minutos, não devendo ser deixados sob uma temperatura de 37 ºC por mais de 10 minutos. A temperatura não deve exceder 37ºC. Após aberto o frasco, quando as soluções de CBA2 e Trombina forem transferidas para o dispositivo de aplicação, o produto deve ser usado imediatamente. Não recongele CBA2 ou Solução de Trombina uma vez que tenham sido descongelados. B. Preparação 1. Segurando os tubos da seringa com uma mão, solte os êmbolos da seringa, deslizando-os para frente e para trás. 2. Insira os dois frascos (CBA2 e Solução de Trombina) nos dois recipientes estéreis. Os recipientes devem ser manuseados, usando técnicas estéreis. 3. Segurando o recipiente estéril, pressione a parte superior do frasco no conector, que está preso ao aplicador (conforme demonstrado). Repita essa operação com o segundo frasco. 4. Segurando os tubos das seringas com uma mão, aspire ambas as seringas lentamente (frascos virados para cima). Se necessário, injete a solução novamente no frasco e aspire mais uma vez, para expelir o ar. Ambas as seringas devem ser preenchidas com volumes iguais e não devem conter ar ou bolhas. 5. Enquanto segura os tubos das seringas com uma mão, vire o conector do frasco suavemente no sentido anti-horário com a outra mão. O conjunto conector do frasco/frasco/recipiente se desconecta automaticamente. C. Método de aplicação C.1 Aplicação por gotejamento Mantenha a ponta do aplicador o mais próximo possível da superfície do tecido, mas sem tocar no mesmo durante a aplicação, administrando gotas individuais na área a ser tratada. Se o aplicador entupir-se, o cateter poderá ser cortado a cada 0,5 cm. C.2 Aplicação via spray EVICEL® pode ser aplicado via spray utilizando CO2 pressurizado ou ar comprimido. Conecte o tubo de ar curto no dispositivo de aplicação na ponta luer lock “macho” do tubo de ar longo. Conecte o tubo de ar luer lock “fêmea” (com o filtro de 0,2 μm) a um regulador de pressão capaz de fornecer pressão entre 1,0 e 1,7 bar. O regulador de pressão deve ser usado de acordo com as instruções do fabricante. Um pressurizador de pressão de 1,0 a 1,7 bar (medido pelo fluxo de ar) deve ser usado para aplicar via spray. A distância ideal entre o aplicador e a superfície do tecido deve ser entre 10 e 15 cm durante a aplicação do spray na superfície do tecido, em pequenas descargas (0,1-0,2 ml), para formar uma camada fina e uniforme. O EVICEL® forma uma película transparente sobre a área de aplicação. Na aplicação de EVICEL® por pulverização, a pressão utilizada deve estar dentro da faixa de pressão recomendada. EVICEL® não deve ser pulverizado a uma distância menor do que a recomendada. Na pulverização de EVICEL®, alterações na pressão arterial, pulso, saturação de oxigênio e quando estiver no final do CO2, devem ser monitorados devido à possibilidade de ocorrência de ar ou embolia gasosa. Os produtos não utilizados ou materiais residuais devem ser descartados em conformidade com os requisitos locais. A solução deve ser transparente ou levemente opalescente. Não use soluções que estejam turvas ou tenham depósitos. Não utilize o produto biológico EVICEL® após expirar a data de validade presente na caixa do produto ou após 30 dias se armazenado de 2 a 8ºC em refrigerador. A embalagem do dispositivo, que pode ser adquirido separadamente, deve ser armazenada à temperatura ambiente. 9. REAÇÕES ADVERSAS Reações de hipersensibilidade ou alérgicas (que podem incluir angioedema, ardor e pruridos no local de aplicação, broncoespasmo, sensação de frio, vermelhidão, urticária generalizada, cefaléia, urticária, hipotensão, letargia, náusea, insônia, taquicardia, enrijecimento de tórax, formigamento, vômito, respiração ofegante) podem ocorrer em casos raros, em pacientes tratados com selantes de fibrina/hemostáticos. Em casos isolados, essas reações progrediram para anafilaxia severa. Tais reações podem especialmente ser observadas, se a preparação for aplicada de modo repetitivo ou administrada em pacientes com hipersensibilidade desconhecida aos componentes do produto. Raramente pode ocorrer a formação de anticorpos contra os componentes do selante de fibrina/produtos hemostáticos. A injeção intravascular inadvertida pode causar um evento tromboembólico e coagulação intravascular disseminada e também há o risco de reação anafilática. Medidas-padrão para prevenir infecções, resultantes do uso de produtos medicinais preparados a partir de sangue ou plasma humano incluem a triagem de doadores, triagem de cada doação de cada pool de plasma, quanto a marcadores específicos de infecção e a inclusão de etapas de fabricação eficazes para a inativação/remoção viral. Independentemente disso, quando produtos medicinais preparados a partir de sangue ou plasma humano são administrados, a possibilidade de transmissão de agente infectantes não pode ser totalmente eliminada. Isso também se aplica a vírus desconhecidos ou que surgiram recentemente e outros patogênicos. As medidas tomadas são consideradas eficazes para vírus envelopados, tais como HIV, HCV e HBV. As medidas tomadas talvez não sejam muito úteis contra vírus não-envelopados, como o HAV e o parvovírus B19. Entretanto, visto que para os componentes do produto biológico EVICEL®, tais procedimentos não são totalmente efetivos contra o vírus da hepatite A e o parvovírus humano B19, o risco de transmissão desse agente infeccioso permanece possível. Os sintomas de uma infecção por parvovírus humano B19 incluem febre, sonolência, calafrios e coriza, seguido por dores nas articulações e lesões na pele após um período de 2 semanas. A evidência de hepatite A pode apresentar sintomas como falta de apetite durante dias ou semanas, fadiga e febre leve seguida de náusea, vômito e dor abdominal. Sintomas comuns são também urina escura e aparência amarelada. Nestes casos, os pacientes devem procurar assistência médica assim que evidenciar algum sintoma. A infecção por parvovírus B19 pode ser crítica para mulheres grávidas (infecção fetal) e para indivíduos com imunodeficiência ou eritropoiese elevada (como por exemplo, anemia hemolítica). Como para qualquer derivado de plasma, raramente podem ocorrer reações anafiláticas. Não foram reportados eventos adversos desse tipo durante a realização dos ensaios clínicos. Reações leves podem ser tratadas com anti-histamínicos. Reações hipotensivas graves exigem intervenção imediata, utilizando os princípios atuais da terapia de choque. Embolia de ar ou gasosa ocorreu com o uso do dispositivo de aplicação utilizando o regulador de pressão para administrar EVICEL®. Este evento parece estar relacionado ao uso do dispositivo na aplicação por spray com pressão superior a recomendada e em estreita proximidade com a superfície do tecido. O EVICEL® foi classificado como não-irritante no Teste de Irritação Cutânea Primária e levemente irritante no Teste de Irritação Ocular. A solução de CBA2 ou Solução de Trombina não induz efeitos mutagênicos no teste de Ames. Estudos da neurotoxicidade realizados com o EVICEL® confirmaram que a administração subdural em coelhos não foi associada a nenhuma evidência de neurotoxicidade. Efeitos toxicológicos devido aos reagentes de detergente solvente (TnBP e Triton X-100), usados no procedimento de inativação do vírus, não são esperados, pois os níveis residuais são inferiores a 5µg/ml. Estudos reprodutivos com uma combinação de TnBP e Triton X-100, em ratas grávidas, em doses de até aproximadamente 600 vezes (TnBP, 900 µg/kg/dia) e 3000 vezes (Triton X-100, 4500 µg/kg/dia) a dose humana, aumentou a perda pós-implante e o número de reabsorções tardias. Nenhum efeito adverso embrionário-fetal foi observado, em doses de até 200 vezes (TnBP, 300 µg/kg/dia) e 1000 vezes (Triton X100, 1500 µg/kg/dia) a dose humana. Outros estudos realizados com uma combinação de TnBP, em doses de aproximadamente 300 vezes (TnBP, 450 µg/kg/dia) e 1500 vezes (Triton X-100, 2250 µg/kg/dia) a dose humana, apresentaram um aumento nos índices de reabsorção, redução no peso corporal do feto e aumento no número de animais raquíticos. Nenhum efeito adverso embrionário-fetal foi observado, em doses de até 100 vezes (TnBP, 150 µg/kg/dia) e 500 vezes (Triton X-100, 750 µg/kg/dia) a dose humana. Experiência de Estudos Clínicos Os seguintes eventos adversos, que ocorreram durante os estudos clínicos foram avaliados como tendo uma possível relação ao tratamento com EVICEL®. Reação comum (>1/100 e < 1/10): Abcesso abdominal, infecção no enxerto, infecção por Staphylococcus, hematoma, edema periférico, diminuição da hemoglobina, lesão, intoxicação e complicações no procedimento (Hemorragia no local da incisão, Hematoma pós-procedimento, Complicação pós-operatória no ferimento). a) Cirurgia Retroperitoneal e Intra-Abdominal Em um estudo controlado sobre a cirurgia retroperitoneal e intra-abdominal, envolvendo 135 pacientes (67 pacientes tratados com EVICEL® e 68 com o controle), nenhum evento adverso foi considerado estar relacionado com o tratamento, de acordo com as avaliações do pesquisador. Entretanto, 3 eventos adversos graves (1 abcesso abdominal no grupo tratado com EVICEL® e 1 abcesso abdominal e 1 pélvico no grupo tratado com o controle) foram considerados pelo responsável como estar possivelmente relacionado com o tratamento em estudo. b) Cirurgia Vascular Em estudos controlados da cirurgia vascular, envolvendo 147 pacientes em procedimentos de cirurgia vascular (75 tratados com EVICEL® e 72 com o controle), um total de 16 voluntários reportaram evento adverso de oclusão trombótica do enxerto durante o período do estudo. Os eventos ocorreram uniformemente em 8 voluntários do grupo tratado com EVICEL® e 8 do grupo de controle. Em casos de eventos adversos, notifique ao Sistema de Notificações em Vigilância Sanitária – NOTIVISA, disponível em http://www.anvisa.gov.br/hotsite/notivisa/index.htm, ou para a Vigilância Sanitária Estadual ou Municipal. 10. SUPERDOSE Nenhum sintoma de superdosagem com EVICEL® foi encontrado até o momento. Em caso de intoxicação, ligue para 0800 722 6001, se você precisar de mais orientações. Reg. MS Nº 1.1325.0093 Responsável técnico: Nancy M. R. B. Lopes – CRF–SP n° 10965 Fabricado por: Omrix Biopharmaceuticals Ltd. MDA Blood Bank Sheba Hospital Tel Hashomer - Ramat Gan - Israel. Importado por: Johnson & Johnson do Brasil Indústria e Comércio de Produtos para Saúde Ltda. Divisão: Johnson & Johnson Medical Brasil Rua Gerivatiba, 207 - São Paulo/SP CNPJ: 54.516.661/0001-01 SAC: 0800 7075420 Nº do lote, prazo de validade, data de fabricação: vide embalagem USO RESTRITO A HOSPITAIS VENDA SOB PRESCRIÇÃO MÉDICA Esta bula foi aprovada pela ANVISA em (XX/XX/XX). © Johnson & Johnson do Brasil Indústria e Comércio de Produtos para Saúde Ltda., 2011
Baixar