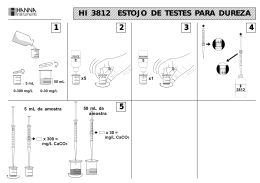
LABORATÓRIO DE SANEAMENTO AMBIENTAL METODOLOGIAS DE ANÁLISES DE ÁGUAS E EFLUENTES LÍQUIDOS DUREZA TOTAL – Método Compleximétrico do EDTA PRINCÍPIO DO MÉTODO É o método mais comumente empregado na determinação de dureza, sendo baseado na reação do ácido etilenodiaminatetracético (EDTA) ou seus sais de sódio, que formam complexos solúveis quelados com certos cátions metálicos (SILVA e OLIVEIRA, 2001). M 2+ + EDTA → [M .EDTA] A reação que ocorre num pH 10,0 ± 0,1, necessita de um indicador (preto de eriocromo T) para assinalar o ponto final da reação. M 2+ + Preto de Eriocromo T → (M. Preto de Eriocromo T) Íons metálicos bivalentes (principalmente Ca++ e Mg++) Complexo vermelho vinho A determinação de Ca++ e Mg++ em conjunto é comumente interpretada como DUREZA TOTAL, dada em termos de CaCO3. Para determinação da concentração de Mg++ diminui-se do valor da dureza total, o resultado encontrado para Ca++, ou dureza cálcica. EQUIPAMENTOS, VIDRARIAS E MATERIAIS • • • • Bureta de 25 mL com divisões de 0,1 mL Erlenmeyer de 250mL Pipetas volumétricas de 50 mL ou proveta graduada de 50 mL Agitador magnético REAGENTES • • • Solução condicionante para cálcio e magnésio Solução do indicador Preto de Eriocromo T Solução de EDTA à 0,01 M ; PROCEDIMENTO EXPERIMENTAL – Dureza Total a) Pipetar 50 mL da amostra para um erlenmeyer de 250mL; b) Adicionar 2 mL da solução condicionante para cálcio e magnésio e misturar; c) Adicionar 4 gotas do indicador Eriocromo Black T e titular imediatamente com solução de EDTA 0,01 M padronizada, até a mudança da cor rosa-vinho para azul nítido. Anotar o volume gasto na titulação. CÁLCULO DurezaTotal = V.M.100.000 (mgCaCO 3 /L) A V = volume da solução padrão de EDTA gasto na titulação da amostra (mL) M = Molaridade da solução de EDTA (M) A = volume da amostra tomada para análise (mL) DUREZA CÁLCICA EQUIPAMENTOS, VIDRARIAS E MATERIAIS • • • • • Bureta de 25 mL com divisões de 0,1 mL Erlenmeyer de 250mL Pipetas volumétricas de 50 mL ou proveta graduada de 50 mL Agitador magnético Solução de EDTA à 0,01 M ; REAGENTES • • Solução condicionante para cálcio Solução do indicador calcon ou murexida PROCEDIMENTO EXPERIMENTAL – Dureza Cálcica 1) Pipetar 50 mL da amostra para um erlenmeyer de 250mL, 2) Adicionar 2 mL da solução condicionante para cálcio e misturar, 3) Adicionar 1 a 2 gotas do indicador calcon ou murexida e titular imediatamente com a solução de EDTA 0,01 M padronizado até a mudança da cor rosa-vinho para azul nítido. Anotar o volume gasto. CÁLCULO DurezaCálcica = V .M .100.000 (mgCaCO3 / L) A V = volume da solução padrão de EDTA gasto na titulação da amostra (mL) M = Molaridade da solução de EDTA (M) A = volume da amostra tomada para análise (mL) DUREZA DEVIDO AO MAGNÉSIO Para determinação da dureza devido ao magnésio diminui-se do valor da dureza total, o resultado encontrado para dureza cálcica. O resultado é expresso em mg CaCO3/L.
Baixar