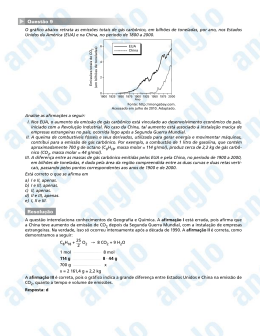
Questão 18 CURSO E COLÉGIO Armadilhas para o CO2 Estudo de pesquisadores da Universidade Estadual Paulista, Unesp, em Presidente Prudente, abre a perspectiva de desenvolvimento de tecnologias que possibilitam capturar quimicamente o CO2 atmosférico, o principal gás de efeito estufa. Os pesquisadores brasileiros demonstraram que uma molécula denominada DBN, em determinadas condições de temperatura e pressão, associa-se ao dióxido de carbono, formando carbamato (1) e bicarbonato de DBN (2). O processo está esquematizado a seguir. (Unesp Ciência, dezembro de 2011. Adaptado.) Determine a fórmula molecular da DBN. Com base nas informações fornecida pelo esquema da reação, e dado R = 0,082 L · atm · K–1 · mol–1, calcule o volume de CO2, em litros, que pode ser capturado na reação de 1 mol de DBN à temperatura de – 23°C e pressão de 1 atm. Resposta: Na fórmula de bastões, cada vértice sem sigla é um átomo de carbono. Assim, a partir da fórmula de bastões do DBN, completamos com os átomos de carbono e a seguir CURSO com os E COLÉGIO átomos de hidrogênio destes carbonos, que são todos tetravalentes: Contando os átomos, chegamos que a fórmula molecular da DBN é: C7H12N2. Na reação, temos que cada mol de DBN pode reagir com um mol de CO2. Assim, podemos calcular o volume de um de CO2 a partir da seguinte equação: p.V=n.R.T Onde: p = 1 atm V=? n = 1 mol de CO2 R = 0,082 L · atm · K–1 · mol–1 T = 250 K (– 23 + 273) Resolvendo: 1 . V = 1 . 0,082 . 250 V = 20,5 L de CO2
Download