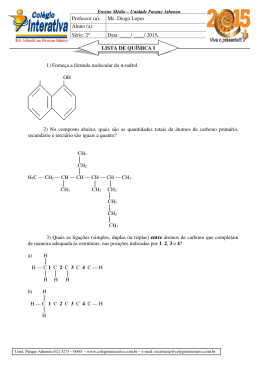
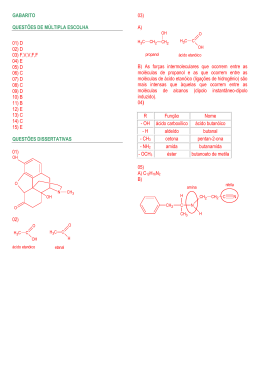
PRÉ VESTIBULAR UFU 2015 Prof.Lourival/COLÉGIO INTEGRAÇÃO/ ANGLO 1. QUÍMICA DOS COMPOSTOS DE CARBONO DEFINIÇÃO: 2 HIDROCARBONETOS - OBTENÇÃO (DESTILAÇÃO FRACIONADA DO PETRÓLEO) ESTRUTURA NOMENCLATURA EQUAÇÕES DE COMBUSTÃO PROPRIEDADES 1.1 – ALCANOS 1.2 – ALCENOS 1.3 – ALCINOS 1.4 – ALCADIENOS 1.5 – CICLANOS 1.6 – CICLENOS 1.7 - AROMÁTICOS OBTENÇÃO DESTILAÇÃO FRACIONADA DO PETRÓLEO (MISTURA COMPLEXA) NOMENCLATURA TODO COMPOSTO ORGÂNICO POSSUI: Prefixo + infixo + sufixo Prefixo = nº de Carbonos Infixos = tipo de ligações entre carbonos Sufixo = Função orgânica Nomenclatura Tabela de Prefixos Nº de Carb Prefixo Nº de C Prefixo 1 Met 6 Hex 2 Et 7 Hept 3 Prop 8 Oct 4 But 9 Non 5 Pent 10 Dec Nomenclatura Tabela de Partes intermediárias Ligação Carbono carbono Infixo C – C (simples) An C = C (dupla) En C ≡ C (tripla) In C = C = C (duas duplas) Dien C ≡ C – C ≡ C (duas triplas) Diin C = C = C = C (três duplas) Trien Nomenclatura Sufixo O sufixo varia de acordo com a Função a qual o composto pertence! Veremos cada uma delas a seguir! ESTRUTURA 1.1 – ALCANOS OU PARAFINAS FÓRMULA GERAL 1º ALCANO DA SÉRIE 1 carbono Metano CH 4 2º ALCANO DA SÉRIE 2 carbonos Etano C H 2 6 Alcanos (CnH2n+2) Exemplos Nome - Fórmula Molecular Fórmula Estrutural Condensada Metano CH4 CH4 Etano C2H6 CH3 – CH3 Propano C3H8 CH3 – CH2 – CH3 Butano C4H10 CH3 – CH2 – CH2 – CH3 Pentano C5H12 CH3 – CH2 – CH2 – CH2 – CH3 Exercício 1 - Dê a fórmula estrutural dos compostos anteriores. Alcanos ramificados CH3 – CH2 – CH2 – CH3 | CH3 Isopentano CH3 – CH2 – CH2 – CH2 - CH3 Pentano CH3 | CH3 – CH2 – CH3 | CH3 Neopentano Nomenclaturas de Alcanos Ramificados Grupos substituintes Alquila ou Alquil. Metil Butil Etil Isobutil Isopropil ou sec-propil Propil Terc-Butil Pentil Nomenclaturas de Alcanos Ramificados Grupos Substituintes Alquila Neopentil 1.2. ESTRUTURA DAS MOLÉCULAS ORGÂNICAS CARACTERÍSTICAS DO ÁTOMO DE CARBONO CLASSIFICAÇÃO DE CADEIAS CLASSIFICAR O CARBONO NA CADEIA REPRESENTAR AS MOLÉCULAS ATRAVÉS DE FÓRMULAS ESTRUTURAIS SIMPLIFICADAS 16 1.3 FUNÇÕES ORGÂNICAS CONCEITUAR FUNÇÃO E GRUPO FUNCIONAL CONCEITUAR E CARACTERIZAR HCs RECONHECER ESTRUTURA E NOMENCLATURA DOS ALQUILA E ARILA RECONHECER NOMENCLATURA DE HCs CARACTERIZAR E RECONHECER GRUPOS FUNCIONAIS CONCEITUAR E RECONHECER FUNÇÕES MISTAS RECONHECER NOMENCLATURA DAS FUNÇÕES ORGÂNICAS MONOFUNCIONAIS E MISTAS Outras funções orgânicas características e nomenclatura: álcool, fenol, éter, amina,haleto de alquila, haleto de arila, aldeído,cetona, enol, ácido carboxílico, anidrido deácido de carboxílico, éster, amida, haleto de acila, sais orgânicos, ácidos sulfônicos enitrocompostos 17 1.4 PROPRIEDADES DOS C.O Polaridade das moléculas orgânicas e as forças intermoleculares · Interação dipolo-dipolo · Interação dipolo instantâneo-dipolo induzido · Interação tipo pontes de hidrogênio Solubilidade Ponto de fusão (PF) e ponto de ebulição (PE) Diferenças entre compostos orgânicos e inorgânicos Acidez e basicidade de compostos orgânicos 18 1.4.1 Polaridade das moléculas orgânicas HCs → São Apolares Grupos Funcionais → Parte polar da Molécula 19 1.4.1 FORÇAS INTERMOLECULARES SÃO, BASICAMENTE, DE 3 TIPOS: FORÇAS DE LONDON (D.I-D.I) MOLÉCULAS APOLARES DIPOLO PERMANENTE DIPOLO PERMANENTE MOLÉCULAS POLARES LIGAÇÃO DE HIDROGÊNIO (L.H) 20 1.4.1FORÇAS INTERMOLECULARES DIPOLO INSTANTANEO DIPOLO INDUZIDO CONTATO MOLECULAR → INTERAÇÃO INTERMOLECULAR FRACA FATORES QUE ALTERAM: → 𝑁º 𝐷𝐸 𝐶𝐴𝑅𝐵𝑂𝑁𝑂𝑆 → ARRANJO DOS CARBONOS 21 → PRESENTE EM TODOS SISTEMAS MOLECULARES 1.4.1 FORÇAS INTERMOLECULARES DIPOLO INSTANTÂNEO DIPOLO INDUZIDO 22 Nº DE CARBONOS: AUMENTO DO Nº DE CARBONOS AUMENTA A INTENSIDADE DA INTERAÇÃO! 1.4.1 FORÇAS INTERMOLECULARES DIPOLO INSTANTÂNEO DIPOLO INDUZIDO 23 ARRANJO: AUMENTO DO Nº DE RAMIFICAÇÕES DIMINUI A INTENSIDADE DA INTERAÇÃO! 1.4.1 FORÇAS INTERMOLECULARES DIPOLO INSTANTÂNEO DIPOLO INDUZIDO 24 ARRANJO: AUMENTO DO Nº DE RAMIFICAÇÕES DIMINUI A INTENSIDADE DA INTERAÇÃO! 1.4.1 FORÇAS INTERMOLECULARES DIPOLO PERMANENTE DIPOLO PERMANENTE MOLÉCULAS POLARES 25 → MOLÉCULAS COM ÁTOMOS ≠S MAIS FORTES → QUE AS DI-DI → MAIOR P.E 1.4.1 FORÇAS INTERMOLECULARES LIGAÇÃO DE HIDROGÊNIO (L.H): Ocorre entre molécuLas polares com um átomo doador (D) que carrega um “H” ácido e um átomo aceptor (A) que possua elétrons não ligados. D e A são muito eletronegativos (F,O,N) MOLÉCULAS POLARES MAIS FORTES QUE AS DI-DI MAIOR P.E 26 1.4.1 FORÇAS INTERMOLECULARES LIGAÇÃO DE HIDROGÊNIO (L.H Figura : Arranjo geométrico das ligações de hidrogênio. (A) interação entre duas moléculas de água. (B) interação entre uma molécula modelo de ligação pepitídica (trans-N-Metilacetamida) com três moléculas de água, mostrando que o átomo de oxigênio pode estar envolvido em mais de uma ligação. 27 1.4.1 FORÇAS INTERMOLECULARES EXEMPLOS: 28 1.4.1 FORÇAS INTERMOLECULARES EXEMPLOS: Figura: Estrutura tridimensional da molécula de DNA. (A) modelo de espaço preenchido.(B) modelo bola e vareta. (C) interações intermoleculares específicas (ligações de hidrogênio) entre os pares de bases. 29 1.4.1 FORÇAS INTERMOLECULARES EM RESUMO,TEM-SE: COMPOSTOS COM FUNÇÕES DIFERENTES Quanto maior a intensidade das forças intermoleculares, maior o P.E Compostos que realizarem L.H terão os maiores P.E 30 EXERCÍCIO EXERCÍCIO: COMO VOCÊ EXPLICARIA OS VALORES DAS T.EB ABAIXO? 31 RESUMO DOS GRUPOS FUNCIONAIS 32 COMPOSTOS DE FUNÇÃO MISTA IDENTIFIQUE AS CLASSES 33 OXIDAÇÃO E REDUÇÃO OXIDAÇÃO: PERDA DE ELÉTRONS MUDANÇA DO ESTADO DE OXIDAÇÃO REDUÇÃO: GANHO DE ELÉTRONS O+ eR RO+e 34 OXIDAÇÃO E REDUÇÃO Exercício: Calcule o Nox para o Carbono. MENOS Oxidação MAIS LIGAÇÕES LIGAÇÕES C–H C–H REDUÇÃO 35 OXIDAÇÃO E REDUÇÃO Exercício: Calcule o Nox para o Carbono. MENOS OXIDAÇÃO LIGAÇÕES C–O 36 MAIS LIGAÇÕES REDUÇÃO C–H OXIDAÇÃO E REDUÇÃO 37 EXERCÍCIO Indique se as reações abaixo se tratam de oxidação ou redução e calcule os E O dos carbonos envolvidos. 38 MECANISMO 39
Download