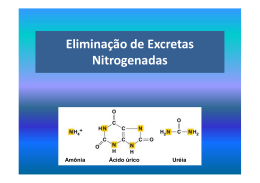
15 Volume VALTER T. MOTTA Bioquímica Clínica: Princípios e Interpretações Nitrogênio NãoProtéico N ITROGÊNIO NÃO - PROTÉICO A fração nitrogênio não-protéico sérico é fo rmada de todos os compostos nitrogenados exceto proteínas. O rim exerce papel fundamental na eliminação da maioria destes compostos do organismo. A dosagem d e s t a s s u b s t â n c i a s n a r o t ina laboratorial faz parte do estudo do “status” renal do paciente. O catabolismo de proteínas e ácidos nucléicos resultam na formação dos comp o s t o s n i t r o g e n a d o s n ã o -protéicos. Existem mais de 15 compostos nitrogenados não protéicos na plasma; os principais e suas origens bioquímicas além das situações em que são avaliados estão resumidos na tabela 10.1. V á r i o s d e s t e s p r o d u t o s m e t a b ó l i c o s s ã o seqüencialmente derivados do metabolismo de pro t e í n a s t a n t o e n d ó g e n a s ( t e c i d o s ) c o m o exógenas (dieta). Tabela 10.1. M e t a b ó l i t o s n i t r o g e n a d o s n a u r i n a * Metabólito % de nitrogênio na Origem bioquímica Utilidade clínica da medida Aminoácidos Proteínas endógenas e exógenas Enfermidade hepática; erros inatos do m e t a b o l i s m o ; d e s o r d e n s tubulares <1 Enfermidade hepática; enfermidade renal 10-20 Amônia Aminoácidos (congênita ou adquirida), erros inatos do metabolismo Uréia Amônia Enfermidade hepática, enfermidade renal Creatinina Creatina Função renal Ácido úrico Nucleotídio s p u r í n i c o s Desordens da síntese purínica, “marca- urina 55-90 2-3 1-1,5 dor” do turnover celular *Estes compostos compreendem ao redor de 90% das substâncias não-protéicas na urina. 233 234 Bioquímica Clínica: Princípios e Interpretações U RÉIA O s aminoácidos provenientes do catabolismo protéico são desaminados com a produção de amônia. Como este composto é potencialmente tóxico, é convertido em uréia (NH 2 -CO-NH 2 ) no fígado associado ao CO 2 . A uréia constitui 45% do nitrogênio não protéico no sangue. Após a síntese hepática, a uréia é transportada pelo plasma até os rins, onde é filtrada pelos glomérulos. A uréia é excretada na urina, embora 40-70% seja reabsorvida por difusão passiva pelos túbulos. Um quarto da uréia é metabolizada no intestino para formar amônia e CO 2 pela ação da flora bacteriana normal. Esta amônia é reabsorvida e levada ao fígado onde é reconvertida em uréia. O nível de uréia no plasma é afetado pela função renal, conteúdo protéico da dieta e teor do catabolismo protéico, estado de hidratação do paciente e presença de sangramento intestin al. Apesar destas limitações, entretanto, o nível de uréia ainda serve como um índice predictivo da insuficiência renal sintomá t ica e no estabelecimento de diagnóstico na distinç ã o e n t r e v á r i a s c a u s a s d e i n s u ficiência renal. H IPERUREMIA Enfermidades renais com diferentes tipos de lesões (glomerular, tubular, intersticial ou vascular) causam o aumento dos teores de uréia plasmática. O uso da uréia como indicador da função renal é limitada pela variedade nos resultados causados por fator e s n ã o -renais. Teores aumentados de uréia são de três tipos: pré-renal, renal e p ó s-renal. Os sinais e sintomas da hiperuremia in -cluem acidemia, náusea e vômito, progredindo para o torpor e coma. Uremia pré-r e n a l . É um distúrbio funcional resultante da perfusão inadequada dos rins e, portanto, filtração glomerular diminuída em presença de função renal normal: § Insuficiência cardíaca c o n g e s t i v a (grave). § Decréscimo do fluxo sangüíneo renal, e n c o n trado na hemorragia, desidratação e volume sangüíneo marcadamente diminuído. § Choque. § Terapia por corticoesteróides e tetraciclinas. § Reabsorção das proteínas sangüíneas após hemorragia gastrointestinal maciça e desidratação moderada. § Alterações no metabolismo das proteínas. Promovem modificações na uremia: dieta rica em proteínas, febre, estresse, último trimestre de gravidez e na infância (aumento da síntese protéica), elevam ou diminuem o teor de uréia sangüínea. A uremia pré -renal é detectada pelo aumento da uréia plasmática sem a concomitante elevação da creatinina sangüínea. U r e m i a r e n a l . A filtração glomerular está diminuída com retenção de uréia em conseqüência da doença renal aguda ou crônica. Insuficiência renal é resultante de lesões nos vasos sangüíneos renais, glomérulos, túbulos ou interstício; estas agressões podem ser tóxicas, imunológicas, iatrogênicas ou idiopáticas. § Glomerulonefrites, aumentos significantes da uréia, quando a filtração glomerular cai abaixo de 50% dos níveis normais. § N e c r o s e t u b u l a r a g u d a , isquemia prolongada e agentes nefrotóxicos (metais pesados, amin o glicosídios, rádio -contrastes). § Nefrite intersticial aguda induzida por medicamentos. § L e s ã o a r t e r i o l a r provocada por hipertensão, vasculite, microangiopatias (púrpura tromb o citopênica trombótica e síndrome hemolíticourêmica). Nitrogênio não-protéico § De posição intra -r e n a l o u s e d i m e n t o s (ácido úrico e mieloma). § Embolização de colesterol (especialmente procedimento pós-arterial). § Outros fatores complicantes tais como: des idratação e o edema, que causam perfusão renal diminuída, catabolismo de proteínas a umentado e o efeito antianabólico geral dos glicocort icóides. Uremias pós-r e n a l . É r e s u l t a n t e d a o b s t r u ç ã o do trato urinário com a reabsorção da uréia pela circulação: § Obstrução ureteral (cálculos, coágulos, tumores da bexiga, hipertrofia prostática, compre s sões externas e necrose papilar). § O b s t r u ç ã o n a s a í d a d a b e x i g a (bexiga neuro gênica, hipertrofia prostática, carcinoma, cálculos, coágulo e estenose uretral). H IPOUREMIA Os baixos níveis de uréia são encontrados na pres e n ç a d e h e p atopatia grave. O fígado lesado, incapaz de sintetizar uréia a partir da amônio resultante do metabolismo protéico, resulta na formação de amônia sangüínea, causando encefalopatia hepática. D ETERMINAÇÃO DA URÉIA 235 asparaginase, bacitracina, capreomicina, captopril, carbonato de lítio, carbutamina, carnistina, cefaloridina, clonidina, cloranfenicol, clorobutanol, clorotiazida sódica, clortalidona, colistemetato sódico, compostos de antimônio, compostos me rcuriais, dextrano, diuréticos mercuriais, diuréticos tiazí dicos, doxatram, espectinomicina, esteróides anabólicos, estreptodornase, estreptoquinase, flufenazina, fluoretos, fosfato de disopiramida, furosemida, guanaclor, hidrato de cloral, hidroxiuréia, indometacina, infusões de dextrose, canamicina, lipomul, maconha, meclofenamato sódico, mefenazina, meticilina, metildopa, metilsergida, metolazona, metossuxinamida, metoxiflurano, min o xidil, mitramicina, morfina, naproxeno sódico, neomicina, nitrofurantoína, parametazona, parg ilina, polimixina B, propranolol, sais de amônio, sais de cálcio, salicilatos, sulfato de gentamicina, sulfato de guanetidina, sulfonamidas, tartarato de metoprolol, tetraciclina, tolmetin sódico, triantereno e vancomicina. Resultados falsamente redu zidos: abuso do álcool, acromegalia, amiloidose, cirrose, desnutrição hepática, dieta (proteína in adequada), doença celíaca, expansão do volume plasmático, gravidez (tardia), hemodiálise, hepatite, ingestão de líquido em excesso, lactância e necrose. As drogas incluem estreptomicina e t imol. Métodos. A medida da uréia pode ser realizada pelo uso de métodos indiretos onde a uréia é h idrolizda pela enzima urease para formar amônia posteriormente quantificada – o u p o r m é t o d o s diretos onde a uréia reage com compostos para formar cromogênios. Amostra. Soro e p l a s m a h e p a r i n i z a d o (não usar heparina amoniacal) isento de hemólise. Refrig eradas (para evitar a decomposição bacteriana da uréia) as amostras são estáveis por uma semana. Urease. Os primeiros métodos empregados na determinação baseavam-se na transformação da uréia em amônia e dióxido de carbono, pela ação catalítica da enzima urease. A amônia formada nesta reação era determinada colorimetricamente pelo reagente de Nessler ou pela reação de Be rthelot. Interferências. Resultados falsamente aumentados: a c e t o -hexamida, acetona, ácido ascórbico, ácido etacrínico, ácido nalidíxico, aminofenol, análogos da guanetidina, androgênios, anfotericina B, antiácidos alcalinos, arginina, arsenicais, Urease/glutamato desidrogenase. A amônia obtida pela reação da urease também pode ser medida espectrofotometricamente pela reação acoplada urease/glutamato desidrogenase (GLDH) com o emprego de α-cetoglutarato para oxidar o P a c i e n t e . Não são exigidos cuidados especiais. 236 Bioquímica Clínica: Princípios e Interpretações NADH a NAD+ . O modo cinético de análise elimina interferências causadas por desidrogenases e amônia na amostra. Este é o método mais usado em equipamentos automáticos. Valores de referência para uréia (mg/dL) Adultos ambulatoriais 15 a 39 Corante indicador. A medida da amônia obtida pela ação da urease também é conseguida pelo emprego de corante indicador de pH para produzir cor. O princípio do corante indicador é empregado na tecnologia de química seca (DT Vitros). Bibliografia consultada Conductimetria. Outro método comum para a quantificação da uréia é baseado na alteração na conditividade de uma amo s t r a q u e o c o r r e a p ó s a ação da urease sobre a uréia. O CO 2 e a amônia produzidas pela ação enzimática reagem para fo rmar carbonato de amônio que aumenta a condutividade da mistura da reação. Outros métodos. A uréia também pode ser d eterminada por: (a) eletrodo íon seletivo para mo nitorar a reação da urease, (b) reação da o -ftaldeído com as aminas primárias, como a uréia e (c) condensação da diacetilmonoxima com a uréia para formar o cromogênio diazina amarelo que é fotossensível (reduz rapidamente a cor formada). BRUSILOW, S. W. “Inborn errors of urea synthesis”. In: GLEW, R. H., NINOMIYA, Y. Clinical studies in medical biochemistry. 2 ed. New York : Oxford University Press, 1997. p. 260-7. CALBREATH, Donald F., CIULLA, Anna P. Clinical c he m i s t r y . 2 e d . P h i l a d e l p h i a : S a u n d e r s , 1 9 9 1 . 468 p. CHANEY, A. L., MARBACH, E. P. Modified reagents for d e t e r m i n a t i o n o f u r e a a n d a m m o n i a . Clin. Chem., 8:1302, 1962. FRIEDMAN, H. S. Modification of the determination of urea b y t h e d i a c e t y l m o n o x i m e m e t h o d . Anal. Chem., 25:6624, 1953. HAMMOND, B. R., LESTER, E. Evaluation of a reflectance photometric method for determination of urea in blood, p l a s m a , o r s e r u m . Clin. Che m . , 3 0 :5 9 6 -7 , 1 9 8 4 . H A R R I S O N , S . P . I n t e r e f r e n c a i n c o u p l e d -enzyme assay of urea nitrogen by excess endogenous enzyme. Clin. C h e m . , 3 9 :9 1 1 , 1 9 9 3 . G O U R M E L I N , Y . , G O U G E T , B . , T R U C H A U D , A . Electrode measurement of glucose and urea in undiluted samples. C l i n . C h e m . , 3 6 :1 6 4 6 -9 , 1 9 9 0 . W A R N O C K , D . G . U r e m i c a c i d o s i s . K i d n e y , 3 4 :2 7 8 -8 7 , 1988. Nitrogênio não-protéico 237 C REATININA A creatinina é produzida como resultado da desidratação não enzimática da creatina mu scular. A creatina, por sua vez, é sintetizada no fígado, rim e pâncreas e é transportada para as células musculares e cérebro, onde é fosforilada a creatina-f o s f a t o ( s u b s t â n c i a q u e a t u a c o m o r e s ervatório de energia). Tanto a creatina-fosfato como a creatina, em condições fisiológicas, espontaneamente perdem o ácido fosfórico ou água, respectivamente, para formar seu anidrido, a creatin i n a . A creatinina livre não é reutilizada no metab o lis mo corporal e assim funciona somente como um produto dos resíduos de creatina. A creatinina difunde do músculo para o p lasma de onde é removida quase inteiramente e em velocidade relativamente constante por filtração glomerular. Em presença de teores marcadamente elevados de creatinina no plasma, parte da mesma é também excretada pelos túbulos renais. H N HN C C N CH 2 H IPERCREATINEMIA Qualquer condição que reduz a velocidade de filtração glomerular promove uma m e n o r excreção urinária de creatinina, com o conseqüente aumento na concentração plasmática da mesma. A concentração da creatinina sérica aumenta quando ocorre a formação ou excreção reduzida de urina e independe da causa ser pré -renal, renal ou p ó s -renal. Valores aumentados indicam a deterioração da função renal, sendo que o nível sérico gera lmente acompanha, paralelamente, a severidade da enfermidade. Por conseguinte, níveis dentro de faixa. Os níveis de creatinina muitas vezes não ultrapassam os limites de referência até que 5070% da função renal esteja comprometida. Por conseguinte, teores dentro da faixa de referência não implicam necessariamente em função renal normal. O CH 3 Creatinina A q u a n t idade de creatinina excretada diariamente é proporcional à massa muscular e não é afetada pela dieta, idade, sexo ou exercício e corresponde a 2% das reservas corpóreas da creatinafosfato. A mulher excreta menos creatinina do que o homem devido a menor massa muscular. Como a velocidade de excreção da creatinina é relativamente constante e a sua produção não é influenciada pelo metabolismo protéico ou outros fatores externos, a concentração da creatinina sérica é uma excelente medida para avaliar a fu n ç ã o renal. Os teores de creatinina sérica são mais sensíveis e específicos do que a medida da concentração da uréia plasmática no estudo da velocidade de filtração glomerular reduzida. Causas pré-renais. A u m e n t o s s i g n ificativos são comuns na necrose muscular esquelética ou atrofia, ou seja: traumas, distrofias musculares progressivamente rápidas, poliomelite, esclerose amiotrófica, amiotonia congênita, dermatomiosite, miastenia grave e fome. São ainda encontradas: i n s u ficiência cardíaca congestiva, choque, depleção de sais e água associado ao vômito, diarréia ou fístulas gastrointestinais, diabetes mellitus n ã o -controlada, uso excessivo de diuréticos, diabetes insípida, sudorese excessiva com deficiência d e i n g e s t ã o d e sais, hipertireoidismo, acidose d iabética e puerpério. Causas renais. S ã o e n c o n t r a d a s n a l e s ã o d o glomérulo, túbulos, vasos sangüíneos ou tecido intersticial renal. Causas pós-renais. São freqüentes na hipertrofia prostática, compressões extrínsecas dos uréteres, cálculos, anormalidades congênitas que comprimem ou bloqueiam os ureteres. 237 238 Bioquímica Clínica: Princípios e Interpretações A concentração da creatinina sérica é monit o rada após transplante renal, pois um aumento, mesmo pequeno, pode indicar a rejeição do órgão. Teores diminuídos de creatin i n a n ã o a p r e s en tam significação clínica. dade da reação. Sob condições ácidas, a creatinina é absorvida do filtrado desproteinizado ou urina p elo reagente de Lloyd e tratada com picrato alcalino com desenvolvimento de cor alaranjada. Este é o método de referência para a análise da creatinina. D ETERMINAÇÃO Jaffé/cinético. Métodos alternativos foram desenvolvidos com base na medida da velocidade da reação entre a creatinina e o ácido pícrico. Estes métodos cinéticos eliminam algumas interferências positivas da glicose e ascorbato e são re alizados diretamente no soro. Entretanto níveis elevados de acetoacetato, acetona e bilirrubinas podem interferir com a re ação. Apesar destas dificuldades, estes métodos são bastante utilizados pois, além de baratos, são rápidos e fáceis de executar. DA CREAT ININA P a c i e n t e . Evitar prática de exercício excessivo durante 8 h. Evitar a ingestão de carne vermelha em excesso durante 24 h antes da prova. Amostra. Soro, p lasma isento de hemólise, lip emia ou ictérico. U r i n a d e 2 4 h colhida sem con servantes . Refrigerada as amostras são estáveis por uma semana. No emprego de métodos enzimáticos não usar plasma obtido com anticoagu lantes contendo amônia. Inteferências. Resultados falsamente elevados: ácido ascórbico, anfotericina B, barbitúricos, carbutamina, cefalotina sódica, cefoxitina sódica, clonidina, cloridrato de metildopato, clortalidona, dextran, fenolsulfonaftaleína, ciclato de doxicic lina, canamicina, levodopa, metildopa, para amino-purato, sulfato de caproemizina e sulfato de colis tina. Métodos. Jaffé (1886) demonstrou que a creatinina com o picrato alcalino desenvolvia cor alaranjada (complexo de Janovski). No aparecimento d e s t e p r o d u t o c o l o r i d o e s t ã o b a s e a dos vários métodos para a determinação da creatinina no sangue ou urina. Foi demonstrado, posteriormente, que esta re ação é inespecífica e sujeita a interferências por vários compostos presentes no sangue, tais como: ácido ascórbico, glicose, piruvato, ac e t o n a , p ro teínas, ácido acetoacético, ácido úrico e antibióticos cefalosporinas. A partir destas informçaões foram desenvolvidas diversas modificações para reduzir as interferências de substâncias Jaffé -p o sitivas. Jaffé/terra de fuller. Métodos comumente usados para melhorar a especificidade da reação de Jaffé usam o reagente de Lloyd (silicato de alumí nio, terra de fuller lavada) e a medida da veloci- Enzimáticos. Foram propostos vários métodos enzimáticos para a determinação da creatinina com o emprego da c r e a t i n i n a i m i n o h i drolase o u c r e a t i n i n a a m i d o h i d r o l a s e . Estas reações são acopladas a sistemas que acompanham o desaparecimento do NADH pela modificação da absorvância e 340 nm. Estes métodos sofrem poucas interferências. A enzima amidohidrolase é utilizada na tecnologia de química seca (DT Vitros). Cromatografia de alta performance. A creatinina é separada de outros compostos por troca iônica e, posteriormente, quantificada. Valores de referência para a creatinina Homens 0,6 a 1,2 mg/dL Mulheres 0,6 a 1,1 mg/dL Urina (homens) 14 a 26 mg/kg/d Urina (mulheres) 11 a 20 mg/kg/d D EPURAÇÃO DA CREATININA ENDÓGENA (DCE) A depuração (clearence) renal é a medida da velo cidade de remoção de uma substância do sangue d u r a n t e a s u a p a s s a g e m pelos rins. É um teste que avalia a velocidade de filtração glomerular. De fin e -se a depuração como o volume mínimo de Nitrogênio não-protéico plasma sangüíneo que contém a quantidade total de determinada substância excretada na urina em um minuto. A depuração de uma substância é calculada pela fórmula geral, C = UV/P, onde U é a concentração da substância na urina; V o volume urinário por unidade de tempo, em mililitros por minuto; P, a concentração plasmática e C, a depu ração (clearence) em mL/minuto. A d e p u r a ç ã o d e u m a s u b s tância que não é a b sorvida nem secretada pelos túbulos e cuja con centração plasmática é idêntica a do filtrado glo merular é empregada como medida da velocidade de filtração glomerular. Uma das substâncias que preenche mais adequadamente esses requisitos é a creatinina. Esta substância (a) é um produto natural do metabolismo, (b) é facilmente analisada por métodos colorimétricos, (c) é produzida a taxas constantes para cada indivíduo e (d) é eliminada somente pela ação renal. O nível plasmático de creatinina e sua excreção total são proporcionais à massa muscular; assim sendo, costuma -se expressar a filtração glomerular em relação à superfície corporal do indivíduo (1,73 m2 ), C ORRELAÇÃO CLÍNICA DA DCE A determinação da depuração da creatinina endó gena é um teste conveniente e fornece uma estimativa razoável da taxa de filtração glomerular. Valores aumentados para a depuração carecem de significação clínica. Erros na coleta da urina e/ou o n ã o e s v a ziamento completo da bexiga antes de iniciar o teste promovem taxas elevadas de depu ração. A diminuição da depuração da creatinina é um indicador muito sensível da redução de taxa de filtração glomerular. Isto ocorre em enfermidades a g u d a s o u c r ô n i c a s d o glomérulo ou em algum dos seus componentes. A redução do fluxo sangüíneo do glomérulo diminui a depuracão da creatinina. Fenômeno semelhante pode ocorrer na lesão t u bular aguda. P ROCEDIMENTO PARA A DCE Hidratar o paciente com no mínimo 500 mL de água (evitar a ingestão de chá, café e drogas d u - 239 rante o dia da prova). A seguir o paciente deve es vaziar complemente a bexiga e anotar a hora. Re colher toda a urina por um período de tempo determinado (exemplo , 4, 12 ou 24 horas), guardando a mesma em refrigerador durante a coleta (não usar conservantes). Manter o paciente bem hidratado durante a coleta para conseguir um flu xo urinário igual ou maior que 2 mL/min. A amostra de sangue deve ser obtida em qualq uer momento durante o período de colheita da urina. Medir o volume de urina e anotar tanto o v o lume como o período de tempo de colheita em minutos (horas x 60). Determinar a concentração da creatinina pla s mática e urinária. Utilizar a seguinte fórmula para calcular a depuração da creatinina endógena corrigida: U × V × 1,73 = mL / minuto de plasma depurado P×A Onde U é a concentração de creatinina na urina em mg/dL; V o volume urinário em mL/minuto (para um volume de 24 h: dividir por 1440); P o teor de creatinina no plasma (ou soro) em mg/dL; A superfície corporal em metros quadrados; I,73 o valor médio da superfície corporal (a superfície corporal do indivíduo é obtida a partir do peso e altura, utilizando os nomogramas dos apêndices III e IV). Valores de referência Depuração da creatinina endógena corrigida (mL/min/1,73 m2 ) Idade (anos) Homens Mulheres 20-30 88-146 81-134 30-40 82-140 75-128 40-50 75-133 69-122 50-60 68-126 64-116 60-70 61-120 58-110 70-80 55-113 52-105 Bibliografia consultada BENEDICT, S., BEHRE, J. A. Some applications of a new c o l o r r e a c t i o n f o r c r e t i n i n e . J. Biol. Chem., 114:515-32, 1936. 240 Bioquímica Clínica: Princípios e Interpretações BOWERS, L. D., WONG, E. T. Kinetic serum creatinine assays. A c r i t i c a l e v a l u a t i o n a n d r e v i e w . Clin. Chem., 2 6 :5 5 5 -6 1 , 1 9 8 0 . COCKCROFT, D. W., GAULT, M. H. Prediction of creatinine c l e a r a n c e f r o m s e r u m c r e a t i n i n e . N e p h r o n , 1 6 :31-41, 1976. HARE, R. S. Endogenous creatinine in serum and urine. P r o c . S o c . E x p . B i o l . & M e d . , 7 4 :1 4 8 -5 1 , 1 9 5 0 . JAFFÉ, M. Ueber den niederschleg welchen pikrinsaure in n o r m a l e n h a r n e r z e u g t u n d ueber eine neue reaktion des k r e a t i n i n s . Z . P h y s i o l . C h e m . , 1 0 :3 9 1 -4 0 0 , 1 8 8 6 . KAPLAN, Alex, JACK, Rhona, OPHEIM, Kent E., TOIVOLA, B e r t , L Y O N , A n d r e w W . Clinical chemistry: interpretation and technoques. Baltimore : Williams & Wilkins, 1995. 514 p. ROSANO, T. G., AMBROSE, R. T. WU, A. H. B. et al. Ca n didate reference method for determining creatinine in serum: method development and interlaboratory v a l i d a t i o n . C l i n . C h e m . , 3 6 :1 9 5 1 -5 , 1 9 9 0 . SWAIN, R. R., BRIGGS, S. L. Positive interference with the J a f f é r e action by cephalosporin antibiotics. Clin. Chem., 2 3 :1 3 4 0 -2 , 1 9 7 7 . Nitrogênio não-protéico Á CIDO 241 ÚRICO O ácido úrico é o principal produto do catabo lismo das bases purínicas (adenina e guanina) sendo formado, principalmente no fígado, a partir da xantina pela ação da enzima xantina oxidase. Quase todo o ácido úrico no plasma está na forma de urato monossódico. O H H N N O O N N H H xantina e adenina. Estas são convertidas em xantina e posteriormente em ácido úrico em re aç ã o catalisada pela xantina oxidase. Via de salvação. As bases purínicas livres (guanina e adenina) formadas pela degradação hidrolítica dos ácidos nucléicos, e a hipoxantina derivada da adenin a, podem ser reconvertidas em nucleotídios purínicos pela via de salvação envolvendo a enzima hipoxantina-guanina fosforribosil transferase (HGPRT) e adenina fosforribosil transferase (APRT). O outro substrato em ambos os casos é a PRPP. A via de salvação não requer ATP. Ácido úrico M ETABOLISMO DO URATO As bases purínicas, adenina e guanina, os n u cleosídios e os nucleotídios estão presentes nos ácidos nucléicos e outros compostos metabolic amente importantes (ex.: AMP, ATP). S ÍNTESE DAS PURINAS São inicialmente obtidos a partir da dieta, mas também são sintetizados in vivo. S ã o d o i s o s p ro cessos de síntese das purinas: síntese de novo e síntese de salvação. S í n t e s e d e n o vo. Inicia com a formação de 5fosforribosil pirofosfato (PRPP) a partir de ribose 5-fosfato e ATP catalisada pela enzima fosforribosil pirofosfatase (PRPPS). A conversão do PRPP mais a glutamina em 5-fosforribosilamina é catalisada pela enzima 5-fosforribosil-1-pirofosfato (PRPP)-amidotransferase (PRPP-AT) que é a reação limitante da síntese das purinas estando sujeita a feedback negativo pelos nucle o t í d i o s purínicos. Após várias fases intermediárias que necessitam energia na forma de ATP, a inosin a monofosfato (IMP) pode ser convertida à guan o sina monofosfato (GMP) e adenosina monofosfato (AMP). Os nucleotídios purínicos GMP, IMP e AMP são desdobrados durante a renovação c elular nas respectivas bases purínicas: guanina, hipo- Como resultado da contínua renovação das substâncias contendo purinas, quantidades constantes de ácido úrico são formadas e excretadas. O teor de urato encontrado no plasma (ao redor de 6 mg /dL) representa o equilíbrio entre a produção (700 mg/d) e a excreção pela urina (500 mg/d) e fezes (200 mg/d). Quase todo o ácido úrico excretado pelos glomerúlos é reabsorvido pelos t ú bulos proximais; pequenas quantidades são secret a d a s p e l o s t ú b u l o s distais e excretadas na urina. O teor de ácido úrico na urina é influenciada pelo conteúdo de purina na dieta. O urato excretado pelo sistema digestório é degredado pelas enzimas bacterianas. O ácido úrico plasmático varia influenciado por vários fatores fisiológicos: § Sexo. Os valores de referência para o ácido úrico plasmático são maiores em homens do que em mulheres. § Obesidade. O ácido úrico plasmático tende ser maior em indivíduos obesos. § C l a s s e s o c i a l . A s c l a s s e s m a i s a b a s t a d a s t endem à hiperuricemia . 241 242 Bioquímica Clínica: Princípios e Interpretações Síntese de novo dos nucleotídios purínicos + CO, asparato, formato, glutamina 2 Interconversões dos nucleotídios, seu desdobramento e a 'via de salvação' IMP PRPP - Amidotransferase AMPD IMP HGPRT IMP 5' Nucleotidase 5' Nucleotidase Purina nucleosídio fosforilase Purina nucleosídio fosforilase Purina nucleosídio fosforilase Xantina Oxidase Xantina Oxidase Guanase HGPRT 5' Nucleotidase Xantina Xantina Oxidase § Figura 15.1. Síntese do IMP, AMP e GMP. Formação de ácido úrico. D i e t a . Dietas ricas em proteínas e ácidos n u cléicos, como também, o elevado consumo de álcool aumentam o teor de uricemia. Nitrogênio não-protéico H IPERURICEMIA A importância clínica das purinas reside fundamentalmente nas desordens caracterizadas pelo aumento do teor de ácido úrico no plasma. O acú mulo de urato pode ser devido ao aumento da sua síntese ou por defeitos em sua eliminação. Soluções de urato monossódico tornam-se s u persaturados quando a concentração excede 0,42 mmol/L. No entanto, a relação entre a severidade da hiperuricemia e a conseqüente artrite ou cálculo renal é mais complexa do que estas consid erações sobre solubilidade dos uratos. Gota. É uma desordem clínica caracterizada por hiperuricemia, deposição de cristais de uratos monossódicos (tofos) insolúveis nas juntas das extremidades, ataques recorrentes de artrite inflamatória aguda, nefropatia , cálculos renais de ácido úrico e, eventualmente, várias deformidad e s . A g o t a p o d e s e r primária ( s u p o s t a m e n t e g e nética) ou s e c u n d á r i a (adquirida). A gota primária é causada por hiperprodução ou secreção deficiente de ácido úrico, ou ambas. Ocorre principalmente em ho mens e se manifesta por hiperuricemia e crises de artrite gotosa. Os sintomas agudos da gota são provavelmente devidos ao trauma ou modificações metabólicas locais que levam a deposição de urato monossód ico nas juntas. Os cristais são fa gocitados pelos leucócitos e macrófagos. Nos leucócitos promo vem lesões nas membranas internas. O conteúdo lisossomal e outros mediadores da resposta à in flamação aguda (citoquinas, prostaglandinas, radicais livres etc.) são então liberados, provocando tanto as manifestações sistêmicas como as locais da gota. Alguns pacientes mostram claras evidências de elevação na produção de urato e marcado aumento de excreção urinária do mesmo. Em alguns casos a deficiência de HGPRT foi demonstrada. Pacientes com g ota primária muitas vezes des envolvem cálculos renais, principalmente composto de ácido úrico, mas a incidência varia gra n demente, pois depende de outros fatores como a desidratação e pH urinário baixo. O diagnóstico da gota é realizado clinicamente c o m base do envolvimento das juntas, história de 243 episódios similares e a presença de hiperuricemia. No entanto, nem todos os casos são tipificados clinicamente. Nem sempre o aumento da uricemia é devido à gota, além do que muitos pacientes apresentam ácido ú rico plasmático normal no momento do ataque. Nos casos não esclarecidos, é necessária a a s p iração do líquido sinovial durante o ataque agudo. Este é então examinado microscopicamente e a presença de cristais de urato em forma de agulha que mostra birefringência negativa estabelece o diagnóstico. Em tratamentos não adequados pode ocorrer o desenvolvimento de urolitíase, ou doença renal, ou ambos: § Urolitíase. Ao redor de 5% de todos os cálculos renais tem urato em sua composição, sendo que 10-20% dos indiv í d u o s g o t o s o s d e s e n v o lvem cálculo. § D o e n ç a r e n a l . A insuficiência renal crônica progressiva é uma importante causa de morb id a d e d a g o t a n ã o -tratada (deposição de cristais de uratos nos túbulos renais) e insuficiência renal aguda provocada pela uropatia o bstrutiva motivada por hiperuricemia severa desenvolv ida durante a terapia citotóxica contra o câncer. Defeitos na eliminação de uratos. Exceto para uma pequena porção ligada à proteínas, o urato é completamente filtrado no glomérulo e q u a s e t o d o r e a b s o rvido no túbulo proximal. No túbulo distal, existe tanto a secreção ativa como a r e a b s o r ç ã o p ó s -secretória em sítio mais distal. Estes processos podem ser afetados por doenças ou drogas: § Insuficiência renal crônica. Leva a um pro gressivo aumento de ácido ú rico plasmático causado pela redução na excreção. Nestes c asos, a gota clínica é rara. § S a l i c i l a t o s . São drogas que afetam as vias de transporte. Paradoxalmente reduzem a excreção urinária quando em pequenas doses por diminuição na secreção tubular distal mas aume n - 244 Bioquímica Clínica: Princípios e Interpretações tam a excreção por redução da reabsorção t u bular quando em doses elevadas. § R e d u ç ã o d a s e c r e ç ã o t u b u l a r d i s t a l . O ácido láctico, o ácido β-hidroxibutírico e algumas drogas (ex.: clorotiazida, frusemida) competem com o urato, por esta via de excreção. Assim, condições que provocam acidose láctica ou cetoacidose tendem a hiperuricemia. § Psoríase. A hiperuricemia é provocada pelo aumento na velocidade de renovação das células da pele. § E s t a d o s h i p e r c a t a b ó l i c o s e i n a n i ç ã o . Pelo a umento na velocidade de destruição celular e por reduzir a excreção de urato pela acidose láctica associada. Defeitos enzimáticos específicos § Doenças metabólicas inerentes. Aquelas associadas com acidose láctica, como a doença de armazenamento do glicogênio tipo I (von Gierke) que muitas vezes causam hip eruricemia. § H i p e r t e n s ã o e d o e n ç a c a r d í a c a i s q u ê m i c a . Em 4 0 % d o s c a s o s e s t ã o a s s o c i a d a s c o m h i p e r u ricemia por várias razões, como a obesidade e tratamento por drogas. § Outras causas. Envenenamento pelo chumbo. Ingestão prolongada de álcool. Endocrinopat ias : hipotireoidismo, hiperparatireoidismo, h ipertensão, desidratação, acidemia orgânica (lactato, acetoacetato e β-hidroxibutirato são inibidores competitivos da secreção tubular r enal). A depleção do volume do líquido extracelular estimula a reabsorção d o ácido úrico, reduzindo a excreção. Aumento da renovação dos ácidos nucléi cos. N o s c a s o s o n d e o c o r r e a u m e n t o d a r e n o v ação ou destruição das células. § Desordens mieloproliferativas. Policitemia rubra vera é provavelmente a mais comum d e s t a s d e s o r d e n s , q u e estão associadas com s inais de gota. É promovida pelo aumento da r enovação dos precursores dos eritrócitos causando hiperuricemia. § Terapia com drogas citotóxicas. Especialmente em leucemias e linfomas. A insuficiência renal ocorre pela deposição de cris t a i s d e u r a t o n o s ductos coletores e uretéres. A manutenção de elevada ingestão de líquidos e profilaxia com alopurinol muitas vezes, previnem este estado. § Deficiência da HGPRT (hipoxantina-g u a n i n a fosforribosil transferase). A síndrome de Lesch-N y a h a n é uma condição inerente muito rara presente na primeira infância com retardo mental, movimentos involuntários e auto-mu tilação.(moléstia ligada ao cromossomo X, é encontrada em indivíduos do sexo masculino). A atividade da HGPRT está grandemente redu zida tornando a “via de salvação” inoperante e as purinas não são reconvertidas a nucleosídios; em lugar disso são transformadas em urato. Está associada com a aumento ácido ú rico plasmático, manifestações de gota, hipers ecreção d e urato e formação de cálculos re nais. Existe outra condição inerente onde ocorre a deficiência parcial da HGPRT que causa uma forma severa de gota. Os pacientes s ã o a t i n g idos no início da fase adulta e apre sentam elevadas concentrações de ácido úrico n o plasma e urina. § Hiperatividade da fosforribosil pirofosfato sintetase. Uma desordem que resulta no au mento na produção de purinas com hiperuric emia intensa. § Deficiência de glicose 6 -fosfatase. A doença de von Gierke resulta no acúmulo de glicogênio h e p á tico e renal, hipoglicemia em jejum, acidose láctica, hipertrigliceridemia e hiperuric emia promovidos pela deficiência da enzima glicose 6-fosfatase. A hiperuricemia é produzid a p e l a e l e v a ç ã o d a s í n t e s e d e n o v o e redução da excreção de uratos em conseqüência da acidose láctica. Nitrogênio não-protéico H IPOURICEMIA A hipouricemia é de pouca importância clínica. Teores reduzidos de ácido úrico (abaixo de 2 mg/dL) são encontrados: d o e n ç a h e p a t o c e l u l a r severa com redução da sínt e s e d a s p u r i n a s o u d a x a n t i n a o x i d a s e . Também está diminuido nos d efeitos de reabsorção do ácido úrico – adquiridos ou congênitos (síndrome de Fanconi e doença de Wilson). Também está diminuído após administração de alopurinol, 6-mercaptopurina ou azatio p rina (inibidores da síntese “de novo” das purinas). Os diuréticos tiazídicos associados com pro b e n ecid e fenilbutazona aumentam a excreção de u rat o s . D ETERMINAÇÃO ou íon cianeto. Alguns destes métodos apresentam contra si a desvantagem do aparecimento de turvação no desenvolvimento de cor. A adição de sulfato de lítio ao reagente reduz este problema. A reação que emprega o cianeto deve ser evitada pela sua ação tóxica e pela instabilidade das soluções. Outros compostos podem interferir também por reduzir o ácido fosfotúgstico. Uricase. Maior especificidade é conseguida com métodos que empregam a enzima uricase que catalisa a oxidação do ácido úrico à alantoína com a conseqüente formação de peróxido de hidrogênio. Vários métodos são utilizados para quantificar o ácido úrico baseados nesta ação enzimática: § Quantificação por diferença da absorção antes e depois da ação da uricase. § Medida colorimétrica da quantidade de peró xido de hidrogênio produzido. § Medida polarográfica da quantidade de oxigênio consumido na reação. DO ÁCIDO ÚRICO P a c i e n t e . Não necessita jejum nem cuidado s especiais. Apesar da dieta poder afetar os níveis de ácido úrico, uma refeição recente não apresenta alterações significativas. Amostras. Soro, plasma e urina. O plasma para a determinação por métodos enzimáticos não deve ser colhido com EDTA ou fluore t o p o r s u a s i n t e rferências positivas. Separar o soro e o plasma mais rápido possível das células. Evitar amostras com lipemia intensa e com traços de hemólise. O ácido úrico na amostra é estável por três a cinco dias sob refrigeração e por seis meses a – 20 0 C. À urina de 24 h adicionar 10 mL de hidróxido de sódio (50 g/dL) para evitar a precipitação de sais de urato. O ácido úrico na urina é preservado por três dias em temperatura ambiente, quando protegido de contaminação bacteriana. Métodos. A alantoína produzida pela oxidação do ácido úrico é um agente redutor empregado em muitos ensaios para o ácido úrico. Ácido fosfotúgstico. Estes métodos estão fundamentados na capacidade do ácido úrico em s o lução alcalina reduzir o ácido fosfotúngstico a azul de tugstênio. A intensificação da cor desen volvida é conseguida pela emprego de carbonatos 245 Cromatografia líquida de alta performance. São métodos propostos como referência para a determinação do ácido úrico. Não são realizados rotineiramente. Valores de referência para o ácido úrico Homens Mulheres Soro sangüíneo Urina de 24 h 3,5 a 7,2 mg/dL 2,6 a 6,0 mg/dL 250 a 750 mg/d Bibliografia consultada EMERSON, B. T. Identification of the causes of persistent h y p e r u r i c a e m i a . L a n c e t , 3 3 7 : 1 4 6 1 -3 , 1 9 9 1 . GOCHMAN, N., SCHMITZ, J. M. Automated determination o f u r i c a c i d , w i t h u s e o f a u r i c a s e -p e r o x i d a s e s y s t e m . C l i n . C h e m . , 1 7 :1 1 5 4 -9 , 1 9 7 1 . HENRY, R. J., SOBEL, C., KIM, J. A modified carbonatephosphotugstate method for the determination of uric acid and comparison with the spectrophotometric u r i ca s e m e t h o d . A m . J . C l i n . P a t h . , 2 8 :1 5 2 -60, 1957. SMITH, A. F., BECKETT, G. J., WALKER, S. W., ERA, P. W. H. C l i n i c a l b i o c h e m i s t r y . 6 ed. London : Blackwell S c i e n c e , 1 9 9 8 . P . 1 8 6 -9 0 . Nitrogênio não-protéico 246 246
Download