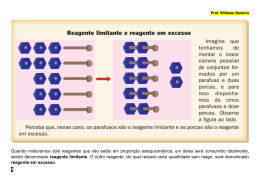
TUTORIAL – 10B Data: Aluno (a): Série: 3ª Ensino Médio Turma: Equipe de Química QUÍMICA PUREZA Pureza: É comum o uso de reagentes impuros, principalmente em reações industriais, ou porque são mais baratos ou porque já são encontrados na natureza acompanhados de impurezas (o que ocorre, por exemplo, com os minérios). Grau de pureza: é o quociente entre a massa da substância principal e a massa total da amostra (ou massa do material bruto). Em 200g de calcário encontramos 180g de CaCO3 e 20g de impurezas. Qual o grau de pureza do calcário? 200g---------------100% 180g --------------- x x = 90% Uma amostra de 200 kg de calcário (com teor de 80% de CaCO3) foi tratada com ácido fosfórico H3PO4 - conforme a equação química balanceada: 3CaCO3 + 2H3PO4 -------1Ca3(PO4)2 + 3H2O + 3CO2. Calcule a massa de Ca3(PO4)2 formado. Os coeficientes já estão acertados: 3CaCO3 + 2H3PO4 ---------- 1Ca3(PO4)2 + 3H2O + 3CO2 Veja os dados informados (200 kg de Calcário com 80% de pureza, ou seja, temos apenas 160kg de CaCO3) e o que está sendo solicitado (massa do sal formado - Ca3(PO4)2) e estabeleça uma regra de três. 3CaCO3--------------1Ca3(PO4)2 3x100g----------------1x310g 160kg --------------- x x=165,33 Mkg Considere a reação FeS + HCl ---------- FeCl2 + H2S. Qual a massa de cloreto ferroso - FeCl2 - obtida quando 1100g de sulfeto ferroso - FeS de 80% de pureza reagem com excesso de ácido clorídrico HCl? Acerte os coeficientes da equação: 1FeS + 2HCl ------------1FeCl2 + 1H2S Veja os dados informados (1100g de sulfeto ferroso com 80% de pureza, ou seja, 880g de sulfeto ferroso puro) e o que está sendo solicitado (massa de cloreto ferroso) e estabeleça uma regra de três. 1FeS--------------1FeCl2 1x88g-------------1x127g 880g -------------- x x= 1270g Colégio A. LIESSIN – Scholem Aleichem -1- NANDA/AGO/2014 – 1014 RENDIMENTO Rendimento de uma reação é o quociente entre a quantidade de produto realmente obtida e a quantidade de produto que seria teoricamente obtida pela equação química correspondente. Queimando-se 30g de carbono puro, com rendimento de 90%, qual a massa de dióxido de carbono (CO2) obtida, conforme a equação: C + O2 ---------- CO2 . Os coeficientes já estão acertados: 1C + 1O2 ---------- 1CO2 . Veja os dados informados (30g de Carbono puro com 90% de rendimento) e o que está sendo solicitado (massa de dióxido de carbono obtida) e estabeleça uma regra de três. 1C-------------1CO2 1x12g-------------1x44g 30g --------------- x x=110g (considerando que o rendimento seria de 100%) estabeleça outra regra de três para calcular o rendimento (90%) 110g------------100%(rendimento teórico) y --------------- 90% y=99g Reagente/Limitante Quando são dadas as quantidades de dois ou mais participantes: É importante lembrar que as substâncias não reagem na proporção que queremos (ou que as misturamos), mas na proporção que a equação (ou seja, a Lei de Proust) as obriga. Quando o problema dá as quantidades de dois participantes, provavelmente um deles está em excesso, pois, em caso contrário, bastaria dar a quantidade de um deles e a quantidade do outro seria calculada. Para fazer o cálculo estequiométrico, baseamo-nos no reagente que não está em excesso (denominado reagente limitante). Nesse caso devemos seguir as etapas: 1ª - Considere um dos reagentes o limitante e determine quanto de produto seria formado; 2ª - Repita o procedimento com o outro reagente; 3ª - A menor quantidade de produto encontrada corresponde ao reagente limitante e indica a quantidade de produto formada. Exercícios: 1. O gás sulfeto de hidrogênio é uma substância que dá aos ovos podres o nauseabundo odor que exalam. Esse gás é formado na reação de um ácido forte, como o ácido clorídrico, HCl(aq), com sulfeto de sódio, Na2S. Considerando que a reação química se processa até consumir todo o reagente limitante, quando são transferidos para um recipiente 195 g de sulfeto de sódio, 584 g de ácido clorídrico a 25% em massa e água destilada, a quantidade produzida de sulfeto de hidrogênio, em gramas, é igual a Colégio A. LIESSIN – Scholem Aleichem -2- NANDA/AGO/2014 – 1014 a) b) c) d) e) 779. 683. 234. 85 68. 2. O tanque externo do ônibus espacial Discovery carrega, separados, 1,20 x 10 6 L de hidrogênio líquido a –253 ºC e 0,55 x 106 L de oxigênio líquido a –183 ºC. Nessas temperaturas, a densidade do hidrogênio é 34mol/L (equivalente a 0,068 g/mL) e a do oxigênio é 37mol/L (equivalente a 1,18 g/mL). Dados: H = 1,0; O =16 Considerando o uso que será feito desses dois líquidos, suas quantidades (em mols), no tanque, são tais que há a) b) c) d) e) 100% de excesso de hidrogênio. 50% de excesso de hidrogênio. proporção estequiométrica entre os dois. 25% de excesso de oxigênio. 75% de excesso de oxigênio. 3. A geração de lixo é inerente à nossa existência, mas a destinação do lixo deve ser motivo de preocupação de todos. Uma forma de diminuir a grande produção de lixo é aplicar os três R (Reduzir, Reutilizar e Reciclar). Dentro desta premissa, o Brasil lidera a reciclagem do alumínio, permitindo economia de 95% no consumo de energia e redução na extração da bauxita, já que para cada kg de alumínio são necessários 5 kg de bauxita. A porcentagem do óxido de alumínio (Al 2O3) extraído da bauxita para produção de alumínio é aproximadamente igual a a) b) c) d) e) 20,0%. 25,0%. 37,8%. 42,7%. 52,9%. 4. O óxido de cálcio é obtido segundo a equação representada abaixo e gera durante sua produção grande quantidade de dióxido de carbono. CaCO3(s) CaO(s) CO 2(g) A massa de dióxido de carbono formada partindo-se de 200,0 g de carbonato de cálcio com 90% de pureza é Dados: Massas molares (g mol–1) Ca ......40 C ........12 O.........16 Colégio A. LIESSIN – Scholem Aleichem -3- NANDA/AGO/2014 – 1014 a) b) c) d) e) 7,9 g. 8,8 g. 79,2 g. 88,0 g. 96,8 g. 5. A osteoporose é uma doença que resulta da carência de cálcio nos ossos, havendo uma redução da massa óssea e deterioração da qualidade dos mesmos. Os ossos ficam cada vez mais porosos e, após alguns anos, ficam suficientemente frágeis e fraturam com facilidade. Uma das medidas de prevenção consiste no fornecimento de cálcio aos ossos nas quantidades que eles necessitam diariamente. Segundo recomendações médicas, um adulto deve ingerir uma dose diária de 800 mg de cálcio. Suponha que um adulto esteja tomando, diariamente, um tablete de 1,30 g de um suplemento nutricional, à base de casca de ostras, o qual contém 82% de carbonato de cálcio. Com base no texto e nos conhecimentos sobre o carbonato de cálcio, considere as afirmativas a seguir. I. O carbonato de cálcio não pode ser ingerido porque, sendo um composto covalente, é um sal pouco solúvel em água. II. O adulto em questão está ingerindo cerca de 53,4% da dose diária recomendada do elemento cálcio. III. O carbonato de cálcio pode resultar da reação de dupla troca entre um ácido fraco e uma base forte. IV. O adulto em questão está ingerindo cerca de 65,0% da dose diária recomendada do elemento cálcio. Assinale a alternativa que contém todas as afirmativas corretas: a) b) c) d) e) I e II II e III II e IV III e IV I, III e IV 6. A porcentagem de TiO2 em um minério pode ser determinada através da seguinte reação: 3TiO2(s) + 4BrF3(l) 3TiF4(s) + 2Br2(l) + 3O2(g) Se 12,0 g do minério produzem 0,96 g de O2, a porcentagem aproximada de TiO2 nesse minério é de: a) b) c) d) e) 10% 20% 30% 40% 50% 7. (Uepb PB/2007) O óxido nitroso é usado como anestésico em partos. A sua obtenção é dada pela reação apresentada na equação química abaixo: NH4 NO3 N 2O 2H 2 O Se foram usados 6 gramas de nitrato de amônio e foram obtidos 2,97 g de óxido de dinitrogênio, qual o rendimento da reação? Colégio A. LIESSIN – Scholem Aleichem -4- NANDA/AGO/2014 – 1014 a) b) c) d) e) 91% 110% 97% 90% 80% 8. No laboratório de química, um grupo de alunos realizou o experimento esquematizado na figura, que simula a fabricação do bicarbonato de sódio, um produto químico de grande importância industrial. O frasco II, imerso em um banho de água e gelo, contém solução aquosa com carbonato de amônio e 23,4 g de cloreto de sódio. O frasco I, gerador de gás carbônico, contém “gelo seco”, que quando borbulhado na solução do frasco II causa uma reação, produzindo como único produto sólido o bicarbonato de sódio. Decorrido o tempo necessário de reação, os cristais foram separados e secados, obtendo-se 25,2 g de NaHCO3. Considerando que reagente limitante é NaCl, o rendimento percentual desse processo, corretamente calculado pelo grupo de alunos, foi igual a: a) b) c) d) e) 85%. 80%. 75% 70%. 39%. 9. Sódio metálico, Na0, e cátion sódio, Na+, são exemplos de espécies que apresentam propriedades químicas diferentes. Quando são utilizados 3g de sal de cozinha (NaCl) na dieta alimentar, o organismo absorve sódio na forma iônica. No entanto, a ingestão de quantidade equivalente de sódio metálico, por sua violenta reação com a água do organismo e pelo efeito corrosivo do hidróxido de sódio formado, causaria sérios danos à saúde. A equação a seguir mostra essa reação. Na (s) H 2 O (l) NaOH(aq) 1 H 2(g ) energia 2 Considerando rendimento de 100%, a ingestão de 3g de sódio metálico produziria, aproximadamente, uma massa de hidróxido de sódio, em gramas, igual a: a) 5,2 b) 8,3 c) 12,1 d) 23,0 e) 25,7 Colégio A. LIESSIN – Scholem Aleichem -5- NANDA/AGO/2014 – 1014 10. O cromo é um metal empregado na produção do aço inox e no revestimento (cromação) de algumas peças metálicas. Esse metal é produzido por meio da reação abaixo: Cr2O3( s ) 2 Al( s ) 2Cr( s ) Al2O3( s ) Partindo-se de 15,2 gramas de Cr2O3 e admitindo-se que este processo tem um rendimento de 75 %, a massa produzida de cromo é igual a: a) b) c) d) e) 11,8 g. 10,4 g. 13,8 g. 15,2 g. 7,8g. Gabarito: 1. E 2. C 3. C 4. C 5. B 6. B 7. D 8. C 9. A 10. E Colégio A. LIESSIN – Scholem Aleichem -6- NANDA/AGO/2014 – 1014
Baixar