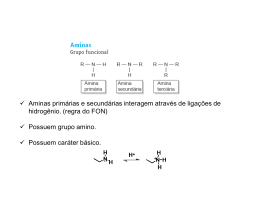
Aminas Introdução Derivados orgânicos da amónia Muitos são biológicamente activos. Classes de aminas Primárias (1): uma ligação C-N, 2 ligações N-H. Secundárias (2): duas ligações C-N, 1 ligação N-H. Tertiárias (3): três ligações C-N, nenhuma ligação NH. Quaternária (4): quatro ligações C-N, azoto tem uma carga formal positiva. Nomes IUPAC Nome é baseado na cadeia de carbono mais comprida. -a do alcano é substituido por -amina. Substituintes no azoto têm o prefixo N-. Br N(CH3)2 NH2CH2CH2CHCH2CH3 CH3CH2CHCH2CH2CH3 3-bromo-1-pentanamina N,N-dimethyl-3-hexanamina Aminas Aromaticas Grupo amina está ligado ao anel de benzeno. O composto mais familiar é a anilina NH2 CH3 NH2 N CH3 H3C anilina N,N-dimetilanilina 4-metilanilina ou p-toluidina Estrutura das Aminas Azoto tem uma hibridação sp3 com o par de electrões não partilhado em uma orbital sp3. Pontos de ebulição N-H é menos polar que o O-H. Forma ligações de hidrogénio mais fracas. Aminas terciárias não formam ligações de hidrogénio. Solubilidade e cheiro Aminas pequenas (<6 C) solúveis em água. Todas as aminas aceitam ligações de hidrogénio do álcool e da água. Basicidade de aminas O par de electrões não partilhado pode aceitar o protão do ácido Soluções aquosas são básicas. Amónia pKb = 4.74 Aminas alquilicas são normalmente bases mais fortes que amónia. Diagrama de energia Grupos alquilo são dadores de electrões e desestabilizam o catião. Efeitos de ressonância Qualquer deslocalização do par de electrões enfraquece a base. Efeitos de hibridação Electrões são mais fortemente seguros em orbitais com mais caracter s portanto esses compostos são bases mais fracas. Alquilação de Amines Aminas reagem com haletos de alquilo 1 via mecanismo de SN2. Misturas de produtos mono-, di-, e tri-alquilados são obtidos. Alquilações úteis Alquilação exaustiva para formar sais de tetralquilamónio. NH2 CH3CH2CHCH2CH2CH3 3 CH3I NaHCO3 _ + N(CH3)3 I CH3CH2CHCH2CH2CH3 • Reacção com elevado excesso de NH3 para formar uma amina primária. CH3CH2CH2Br NH3 (xs) CH3CH2CH2NH2 + NH4Br Eliminação de Hofmann Sais de amónio quaternário têm um bom grupo abandonante - a amina neutra. Aquecer o sal de amónio produz o alceno menos substituído. + N(CH3)3 _ I CH3CHCH2CH2CH3 Ag2O H2O _ + N(CH3)3 OH CH3CHCH2CH2CH3 heat CH2 CHCH2CH2CH3 E2 Mecanismo Sintese de Arilaminas 1° A maioria é sintetizada por nitração do anel aromático a que se segue redução catalitica do grupo nitro a grupo amina. COOH COOH + 3 H2 NO2 3-N itroben zoic acid Ni (3 atm) + 2 H2 O NH2 3-Aminobenzoic acid Reagente ácido nitroso Ácido nitroso é produzido in situ misturando nitrito de sódio com HCl. O ácido nitroso é protonado, perde água para formar o ião nitrosonium. + H O N O H H H O N O + + H2O + N O + N O Reacção com ácido nitroso Tratando a amina primária aromática com HNO2 forma-se o sal de diazonium. NH2 + NaNO2 + HCl Anilin e (a 1° aromatic amin e) Sodium n itrite H2 O 0°C + N N Cl + H2 O Ben zenediazoniu m chloride Aquecendo a solução aquosa forma-se o fenol e o gas, N2. + N N Cl- + H2 O Benzenediazonium chloride OH + N2 Phenol Fim
Baixar