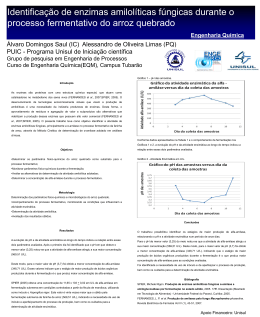
Através das análises gráficas e das tabelas notamos que a melhor atividade obtida foi utilizando a menor concentração de amido de arroz, isso se deve ao fato de que onde há maior umidade, há também maior acessibilidade ao nutriente e conseqüentemente maior o crescimento. Observa-se também que as atividades se diferiram muito umas das outras não seguiram um padrão, neste caso pode ter havido inibição pelo substrato esse tipo de inibição ocorre utilizando altas concentrações de substrato, o que não é possível de se observar em reações com baixas concentrações. Emprego de diferentes fontes amiláceas (arroz, madioca e milho) em processos fermentativos e enzimáticos. Engenharia Química: Processos Bioquímicos. Fernanda Mateus da Silva (IC) Alessandro de O.Limas (PQ) Dile Pontarolo Stremel (PQ) PUIC - Programa Unisul de Iniciação científica Grupo de pesquisa em Engenharia de Processos Curso de Engenharia química(EQM), Campus Tubarão. Introdução As fontes amiláceas (arroz, mandioca e milho) podem ser utilizadas para produção de inúmeras alternativas de produtos, desde alimentos a matéria-prima para a indústria farmacêutica (MATZ, 1991). Inicialmente foi proposta a utilização de amido de arroz, mandioca e milho. Devido à importância regional, a alternativa estudada foi a utilização do arroz, como fonte de amido, para produzir enzimas amilolíticas. O amido do arroz é diferente dos demais, quanto às características dos grânulos e da fração de amilose e amilopectina, a % relativa destes polímeros varia, constituindo a amilose entre 15 e 30% do total (FIGUEIREDO, 2008). As enzimas são catalisadores biológicos produzidos por seres vivos de natureza protéica dotados de alta especificidade e termo-sensíveis atuando em condições fisiológicas (STREMEL, 2008). A catálise enzimatica possui inúmeras vantagens em relação aos catalisadores químicos, dentre as quais, às condições temperatura e pressão, sendo menos exigentes. Deste modo, a produção torna-se viável, quanto ao consumo de energia comparada com outros catalisadores. Estes catalisadores biológicos são capazes de decompor moléculas complexas em unidades menores, de catalisam alterações estruturais em uma molécula, como a isomerização da glicose em frutose. A alta conversão do substrato no produto desejado é outra vantagem do uso de enzimas como catalisadores, gerando apenas uma pequena quantidade de resíduo e por ser também muito seletivas não há formação de subprodutos (STREMEL, 2008). A produção de enzimas amilolíticas teve início no começo do século passado, em decorrência do interesse industrial da produção de glicose a partir de materiais amiláceos (SPIER, 2005). O fungo utilizado neste trabalho foi o Aspergillus Níger para a produção de enzimas amilolíticas. Este fungo tem sido estudado para produção de enzimas importante para a indústria (STREMEL, 2008). Resultados Atividade da α-amilase (U/g quirera de arroz) Tabela 1: Parâmetros analisados (fermentação) Figura 1: Atividade x Amido hidrolisado Objetivos • Empregar fontes amiláceas em processos fermentativos e enzimáticos; • Acompanhar os processos fermentativos, através do monitoramento de parâmetros físico-químicos; • Identificar a atividade enzimática, após a fermentação das fontes amiláceas empregadas; • Identificar a potencialidade de produção de produtos a partir de enzimas amilolíticas. Metodologia 1- Processso Fermentativo: • Foram testadas nas fermentações concentrações de substrato de 0,5; 1; 3 e 5%. O meio fermentativo foi preparado da seguinte forma: • A fermentação foi conduzida sem agitação, com os frascos de Erlenmeyer mantidos em estufa a 30°C por 48h, utilizando como inóculo Aspergillus niger. • As concentrações dos componentes foram calculadas em relação a quantidade de substrato adicionado, sendo a solução salina 30%,CaCO3 4,6%, KNO3 6%. 2- Medida da concentração de amido de arroz: • A medida da concentração de amido de arroz utilizada no processo fermentativo foi realizada com a dosagem do mesmo para determinação da curva padrão, utilizando-se um reativo iodo-iodeto e diluindo-se a 4% de uma solução de base KI 30g/L e I2 3g/L. • Os dados de concentração foram analisados e elaborado um gráfico de concentração (g/L) relacionado com a absorbância. 3- Atividade enzimática: • Para determinação da atividade enzimática (α-amilase) retirou-se 5 g do sobrenadante da fermentação e posteriormente misturado a 50 mL de água deionizada. Esta suspensão permaneceu sob agitação contínua durante 30 minutos. • Para calcular a atividade da enzima foram levadas em conta as seguintes considerações: uma unidade de α-amilase é definida como a quantidade de enzima capaz de hidrolisar 10 mg de amido em 30 minutos. Através das análises gráficas e das tabelas nota-se que a melhor atividade obtida foi utilizando a menor concentração de amido de arroz, isso se deve ao fato de que onde há maior umidade, há também maior acessibilidade ao nutriente e conseqüentemente maior o crescimento fúngico. Observa-se também que as atividades se diferiram muito umas das outras não seguiram um padrão, neste caso pode ter havido inibição pelo substrato esse tipo de inibição ocorre utilizando altas concentrações de substrato, o que não é possível de se observar em reações com baixas concentrações. Conclusões Os resultados obtidos indicam que a fonte amilácea empregada (amido de arroz) pode ser usada para produção de enzimas e posteriormente aplicá-la em diferentes processos industriais. Com as enzimas amilolíticas, podem-se obter açúcares redutores (como maltose e glicose) utilizados amplamente nas indústrias cervejeira e farmacêutica. Desta forma, além da utilização dos grãos quebrados de arroz para produção de enzimas, pode-se agregar valor a este produto através da hidrólise enzimática na produção destes xaropes. O processo de obtenção de enzimas utilizando o amido de arroz é economicamente interessante, de acordo com os resultados obtidos. Identificou-se que apenas uma pequena quantidade da quirera moída (solução de 0,5%) foi utilizada para obter enzimas com alto poder de catálise. Faz-se necessária a aplicação de novos testes com diferentes substratos para analisar outros tipos de amido (arroz, mandioca e milho) e avaliar a qualidade e os rendimentos do produto para a produção de enzimas. Bibliografia HARGER, C.; SPRADA, D.; HIRATSUKA, E. Amilase Fúngica. In: Bioquímica das Fermentações, 1982. 56 p. MATZ, S. A . The Chemistry and Technology of Cereals as Food and Feed. 2ªed. New York, United States: Van Nostrand Reinhold, 1991. SPIER, Michele Rigon. Produção de enzimas amilolíticas fúngicas α-amilase e amiloglucosidase por fermentação no estado sólido, 2005. 178f. Dissertação (Mestrado em Tecnologia de Alimentos) - Universidade Federal do Paraná, Curitiba ,2005. STREMEL, Dile Pontarolo. Engenharia Bioquímica: Núcleo orientado IX semestre – Período letivo 2008. Tubarão, 2008. Apoio Financeiro: Unisul
Baixar