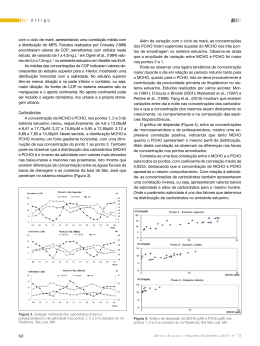
bem misturado e com macromarés. É margeado por manguezais que são uma importante fonte de matéria orgânica, mas também recebe aportes da bacia de drenagem e da produção autóctone, além de fontes antrópicas oriundas de fossas, lixo e esgotos domésticos. Portanto, o ambiente estuarino tem altas concentrações de matéria orgânica particulada e dissolvida. A matéria orgânica nos ambientes aquáticos tem, entre outras funções, a capacidade de complexar metais pesados e atuar como uma fonte potencial de nutrientes. A maioria dos estudos, apesar de sua importância, fica restrita ao carbono orgânico dissolvido (COD) e o carbono orgânico particulado (COP) e é bastante complexa do ponto de vista das técnicas analíticas empregadas e quanto aos fatores que afetam sua dinâmica no ambiente estuarino (produção, consumo, decomposição). No Brasil, poucos estudos têm sido feitos sobre os carboidratos e, no Estado do Maranhão, até o momento não foi encontrado nenhum trabalho com este enfoque. Assim, o objetivo deste trabalho foi determinar a variação nictimeral dos carboidratos no estuário do rio Paciência, observando sua variação em dois ciclos de maré e no gradiente horizontal em função da salinidade e do pH. Parte Experimental Área de estudo abaixo da superfície e utilizando-se garrafas de polietileno de um litro de capacidade. Em seguida as amostras foram colocadas em isopor com gelo até a chegada ao laboratório. Análises químicas Em laboratório foram retiradas alíquotas de cada amostra para determinação dos parâmetros pH e salinidade, em seguida procedeu-se à filtração das amostras em membrana de acetato de celulose (0,45µm de porosidade e 47mm de diâmetro) para determinação do material particulado em suspensão (MPS). O filtrado resultante foi utilizado para determinar dos nutrientes inorgânicos dissolvidos. Para a determinação dos carboidratos dissolvidos foi utilizado um filtro de fibra de vidro (0,7µm de porosidade e 47mm de diâmetro); o material retido sobre este foi utilizado para determinação do carbono orgânico particulado (COP). Para os parâmetros salinidade, pH, MPS e COP utilizou a metodologia descrita por Aminot e Chaussepied (1983). Os monossacarídeos (MCHO) foram determinados pelo método de Myklestad et al. (1997) modificado. Trata-se de duas reações: redução de Fe3+ para Fe2+ por açúcares redutores na presença de uma base (Eq. 1), e, em seguida, o Fe2+ é complexado com 3-(2-Pyridyl)-5,6-diphenyl-1,2,4-triazina-4,4’- dissulfônico de sal hidrato monossódico=FZ) (Eq. 2). RCHO + 2Fe(CN)63-+ 3OH- → RCO2- + 2Fe(CN)64-+ 2H2O Eq.1 A bacia do rio Paciência localiza-se na porção nordeste da ilha do Maranhão compreendida entre as coordenadas geográficas: de 2° 23’ 05’’ a 2° 36’ 42’’ S e de 44° 02’ 49’’ a 44° 15’ 49’’ W. Tem uma área de aproximadamente 171,74 km2, distribuindo-se pelos quatro municípios integrantes da ilha do Maranhão, apresentando uma extensão de 32 km, percorridos na direção sul– leste (MARANHÃO, 1998). O rio Paciência nasce na parte central da ilha do Maranhão, entre os bairros de São Cristóvão e Santa Bárbara, no município de São Luís. A partir da nascente, desloca-se em direção nordeste, ocasião em que, deixando São Luís, passa por parte do meio rural dos municípios de São José de Ribamar e Paço do Lumiar. Desemboca na baía de São José, em frente ilha do Curupu, através de um pequeno estuário numa área intensamente recortada, daí a sua morfologia apresentar uma série de braços e canais, resultado da influência da penetração das marés (FSADU, 2007). Em relação às características físicas, a bacia hidrográfica do Rio Paciência apresenta um perímetro de 69,13 km; altitude média de 30,54 m; 0,75km/km2 de densidade de drenagem e, além disso, apresenta cursos d’água de 4ª ordem (LABOHIDRO, 2007). Resumidamente: foi adicionado 1mL da amostra num tubo de ensaio e 1mL de solução de ferricianeto de potássio (0,7mM) - hidróxido de sódio (0,1·10-4M) e a solução resultante foi aquecida a 100ºC durante 30 min. em banho-maria. Em seguida, e imediatamente, se adicionou 1mL de solução de cloreto férrico (2,0 mM) e 2mL de solução de ferrozina (2,5mM). Deixou-se em repouso por 30 minutos para a formação de um complexo de cor violeta e finalmente a leitura foi efetuada a 595nm de comprimento de onda em um espectrofotômetro UV-Vis. Os polissacarídeos foram determinados pelo método anterior, mas precedido primeiramente de uma hidrolise ácida, ou seja, se adicionou 1ml de ácido clorídrico 0,1M à amostra, seguida de aquecimento em banho-maria por 10 minutos. A quantificação dos carboidratos totais (TCHO) foi obtida pela seguinte fórmula: TCHO=MCHO + PCHO. As curvas para determinação de carboidratos foram preparadas usando solução padrão de glicose 10 mg.L-1. O coeficiente de variação do método foi <3%. Coletas das amostras e medidas in situ Resultados e Discussão As coletas de água foram realizadas em apenas uma campanha, no mês de novembro de 2011 (estiagem máxima). Foram selecionados três pontos de amostragem, caracterizados como Ponto 1, Ponto 2 e Ponto 3, localizados, respectivamente, na parte superior, média e inferior do sistema estuarino. O início da coleta se deu às 8h00 do dia 11 até às 8h00 do dia 12 de novembro de 2011, com uma frequência de amostragem horária, a 30cm R evista A nalytica • Outubro/Novembro 2014 • nº 73 2 Fe2+ + 2(CN)6- + 3(FZ) 2- → [Fe(FZ)6]4- + 2(CN)6- Eq.2 pH e salinidade O valor de pH variou entre 6,5 e 7,7 para o ponto 1; de 6,7 à 7,7 para o ponto 2 e de 7,2 a 8,01 para o ponto 3 (Figura 2). Os valores ficaram praticamente iguais entre os dois primeiros pontos (estuário superior e médio) e ligeiramente mais alcalinos no ponto 3 (estuário inferior). Desta forma, os valores de pH que 57
Baixar