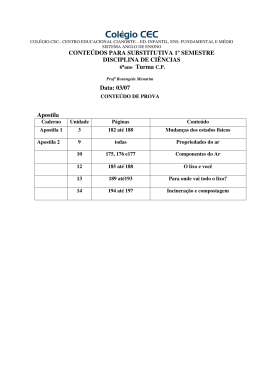
SOCIEDADE MINEIRA DE CULTURA Mantenedora da PUC Minas e do COLÉGIO SANTA MARIA ROTEIRO DE RECUPERAÇÃO – III ETAPA LETIVA QUÍMICA – 2.º ANO/EM – 2015 I– CONTEÚDOS SOLUÇÕES Calcular a concentração de soluções em g/L, mol/L, porcentagem e ppm e as grandezas relacionadas. Aplicar os conhecimentos sobre soluções em contextos que envolvam uso de concentrações. Classificar as soluções em diluída ou concentrada, de acordo com a quantidade relativa entre soluto e solvente. Utilizar raciocínios de proporcionalidade para realizar cálculos estequiométricos com reagentes em solução. Executar cálculos necessários para determinar a concentração de uma solução, a partir de dados provenientes de um processo de titulação. TERMOQUÍMICA Classificar processos exotérmicos e endotérmicos por meio da análise de dados experimentais. Calcular a variação de energia de processos físico-químicos por meio do calor específico e da variação de temperatura entre sistema e vizinhança. Calcular a variação de entalpia (∆H) de processos, a partir do conhecimento do ∆H de outros processos, aplicando a Lei de Hess. Empregar valores tabelados de entalpias-padrão de combustão, de entalpias-padrão de formação, de energias médias de ligação para estimar o ∆H de uma reação. Prever a quantidade de calor envolvida em processos, a partir da análise de diagramas de entalpia. ELETROQUÍMICA (CELAS GALVÂNICAS E CELAS ELETROLÍTICAS) Determinar o estado de oxidação dos elementos, a partir das fórmulas químicas. Equacionar e balancear equações de oxidação e redução, identificando os agentes oxidantes e redutores. Entender os fenômenos de óxido redução como uma transferência de elétrons. Representar as semirreações anódicas, catódicas e reação global de uma pilha. Calcular a força eletromotriz envolvida numa transformação química a partir dos potenciais-padrão de eletrodo. Analisar a possibilidade de ocorrência de uma reação espontânea, de oxidação e redução, utilizando o valor do potencial-padrão da pilha obtido, a partir de dados de uma tabela de potencias padrão. Analisar a possibilidade de ocorrência de uma reação não espontânea, de oxidação e redução, utilizando o valor do potencial padrão obtido, a partir de dados de uma tabela de potências-padrão. Identificar os produtos obtidos a partir da eletrólise ígnea ou da eletrólise aquosa. Explicar, por meio de equações químicas e/ou por meio de esquemas, os diferentes tipos de eletrólise, apresentando o ânodo, cátodo, semiequações e produtos. 1 CINÉTICA QUÍMICA Calcular a velocidade média por meio da analise de gráficos que mostrem a variação ao longo do tempo da quantidade de um participante. Reconhecer os principais fatores que modificam a rapidez de reações por meio da descrição de experimentos. Explicar, pela teoria de colisões moleculares, os fatores que influem na rapidez de uma reação: temperatura, superfície de contato, pressão, concentração e catalisador. Determinar a Lei Cinética de uma reação química, utilizando dados experimentais. Analisar a influência das concentrações iniciais dos reagentes na rapidez de uma reação, a partir da expressão matemática da Lei Cinética. Calcular a constante de velocidade de uma reação, a partir da expressão cinética. EQUILÍBRIO QUÍMICO Reconhecer o estado de equilíbrio químico por meio de dados experimentais e de sua natureza dinâmica. Identificar o estado de equilíbrio por meio da análise de gráficos. Escrever a expressão da constante de equilíbrio de uma equação química. Efetuar cálculos relativos à constante de equilíbrio. Identificar os fatores que afetam o estado de equilíbrio, prevendo o comportamento das substâncias presentes numa reação química. Prever o sentido de deslocamento de um equilíbrio químico, aplicando o princípio de Le Chatelier. Avaliar a influência da temperatura, pressão, catalisador, concentração e superfície de contato, na otimização de processos na indústria química, a partir da análise de dados. Escrever a equação de ionização de ácidos e dissociação de bases e a correspondente expressão da constante de equilíbrio. Correlacionar os valores das constantes de ionização à força de ácidos e bases. Reconhecer o comportamento ácido, básico e neutro de substâncias em solução aquosa. Calcular valores de pH e pOH. Compreender o funcionamento dos indicadores ácido-base. Comparar a acidez e a basicidade de meios aquosos por meio de valores de pH. Explicar o caráter ácido-base de sais por meio de sua hidrólise. Relacionar, matematicamente, constante de solubilidade com solubilidade. Analisar uma curva de solubilidade, classificando a dissolução em endotérmica ou exotérmica. II – ATIVIDADES 01. Refaça todos os exercícios da apostila de revisão – Módulo III – Soluções. 02. Refaça todos os exercícios da apostila de revisão – Módulo II – Termoquímica. 03. Refaça todos os exercícios da apostila de revisão – Módulo V – Cinética Química. 04. Refaça todos os exercícios da apostila de revisão – Módulo VI – Equilíbrio Químico. 05. Refaça todos os exercícios da apostila de revisão – Módulo VII – Eletroquímica. 06. Refaça as Avaliações de Química da III Etapa de 2015. Bons estudos! DRB/vlbj 2
Download