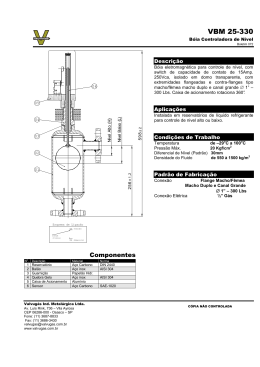
UVV – CENTRO UNIVERSITÁRIO VILA VELHA PROGRAMA DE MESTRADO EM CIÊNCIA ANIMAL AVALIAÇÃO ODONTOLÓGICA EM SINCRÂNIOS DE MACACO-ARANHA (ATELES sp.) Fernanda Rocha de Oliveira Pais Vila Velha – Espírito Santo Janeiro de 2011 UVV – CENTRO UNIVERSITÁRIO VILA VELHA PROGRAMA DE MESTRADO EM CIÊNCIA ANIMAL AVALIAÇÃO ODONTOLÓGICA EM SINCRÂNIOS DE MACACO-ARANHA (ATELES sp.) Fernanda Rocha de Oliveira Pais Orientador: Prof. Dr. João Luiz Rossi Júnior Dissertação apresentada ao Programa de Mestrado em Ciência Animal do Centro Universitário Vila Velha, para a obtenção do título de Mestre em Ciência Animal. Vila Velha – Espírito Santo Janeiro de 2011 Catalogação na publicação elaborada pela Biblioteca Central / UVV-ES P149a Pais, Fernanda Rocha de Oliveira. Avaliação odontológica em sincrânios de macaco-aranha (Ateles sp.) / Fernanda Rocha de Oliveira Pais. – 2011. 141 f.: il. Orientador: Profº. Dr. João Luiz Rossi Júnior. Dissertação (Mestrado em Ciência Animal) – Centro Universitário Vila Velha, 2011. Inclui bibliografias. 1. Odontologia Veterinária. 2. Macacos. I. Rossi Júnior, João Luiz . II. Centro Universitário Vila Velha. III. Título. CDD 636.08976 “Quando o homem aprender a respeitar até o menor ser da criação, seja ele animal ou vegetal, ninguém precisará ensiná-lo a amar seus semelhantes” Albert Schweitzer A Deus, por ter aberto as portas desse mestrado, mesmo quando já julgava tudo perdido. Pai, obrigada por me sustentar durante todo esse período e por ter me dado forças para chegar até aqui. Aos meus “pais” da pós-graduação, João e Flaviana. Obrigada por me “adotarem” e por terem feito desse sonho uma realidade. AGRADECIMENTOS A Deus, Pai, obrigada por tudo que o Senhor tem feito por mim. Obrigada por ter me dado a oportunidade de concretizar mais esta fase da minha vida, sempre ao meu lado me guardando e sustentando. Ao meu bebê, Letícia, mesmo tão novinha você fez parte de cada uma das minhas conquistas. Foi tão bom ter você ao meu lado durante as avaliações das fotos... Muitas vezes eu estava séria e concentrada e, de repente, você me fazia sorrir com algum comentário do tipo: “O macaco não escovou os dentes e está cheio de bactérias na boca”. Filhinha linda, obrigada por tornar a minha vida muito mais feliz! Aos meus pais João Batista e Valéria, Mesmo distantes vocês estiveram presentes em cada uma das minhas vitórias. Sou grata a Deus por ter vocês dois sempre ao meu lado, tanto nas horas boas, quanto nas ruins. Obrigada pelos puxões de orelha quando eu dizia que não iria conseguir. Obrigada não só pelo suporte financeiro, mas por todo amor que vocês me dão. Pai, eu sei o quanto você trabalhou para que eu pudesse estudar nos melhores colégios. Sei que esse mestrado é motivo de orgulho para você. Quero sempre poder retribuir todas as oportunidades que você lutou para que eu tivesse. Amo vocês! Aos meus avós Elvira e Izidoro, Vocês dois foram essenciais para que eu concluísse o mestrado. Sem vocês aqui, ajudando em absolutamente todas as coisas da minha casa, da clínica e principalmente cuidando da Letícia, eu não teria conseguido. Vô, obrigada pelas correções ortográficas! Tia Aredina, Mesmo sendo minha “tia emprestada”, sei que seu amor por mim é puro e verdadeiro. Obrigada por cuidar da Letícia, por ter tomado conta tão bem da clínica neste mês de total ausência. Sei que você fez o seu melhor! Flaviana, Acho que você não tem noção do quanto a sua ligação transformou a minha vida. Você acreditou em mim sem nem me conhecer direito, aceitando no mestrado uma veterinária de pequenos animais interessada em selvagens. Deu-me a mão em um momento em que eu estava totalmente desacreditada. Você é parte não só da conclusão do mestrado, mas do meu crescimento como pessoa. Muito obrigada! João, Eu escutei falar em um professor novo, que andava feito Indiana Jones pela faculdade. Nunca poderia imaginar que esse “cara” seria meu orientador... Aprendi muito com você e espero que, ao fim desta fase, possamos conquistar muito mais coisas juntos! Admiro muito o grande profissional que você é! Aos meus amigos, Perla, Tanure, Carlos e Soraia. Obrigada por entenderem tão bem a minha ausência e por terem aturado meu mau-humor neste final de dissertação. Cada um de vocês tem uma participação nesta conquista. Amo vocês! Aos curadores do Museu Paraense Emílio Goeldi, Especialmente a João A. Queiroz, pela recepção e apresentação à coleção de Mastozoologia. Muito obrigada! A todos do Museu de Zoologia da Universidade de São Paulo, Juliana Gualda, obrigada pela recepção e ajuda durante esta pesquisa! A todos do Museu Histórico Nacional da Universidade Federal do Rio de Janeiro, Especialmente a João Alves Oliveira, por ter dedicado um enorme tempo na procura de artigos científicos relacionados ao meu trabalho. Obrigada por ter perdido seu horário de almoço para me ajudar! À Fundação de Amparo à Ciência e Tecnologia do Espírito Santo – FAPES, Obrigada pela bolsa a mim dedicada. Aos meus animais, Billie Joe, Lilica, Bentinho, Tucha, Léo, Hawk e Oscar. Obrigada por tanto amor. Obrigada por me fazer uma pessoa melhor. Não seria o que sou sem o carinho de vocês! LISTA DE APÊNDICES Apêndice I: Identificação dos sincrânios avaliados segundo instituição, ano e local de coleta................................................................................................................129 Apêndice II: Identificação dos sincrânios avaliados segundo espécie, sexo e habitat..............................................................................................................135 LISTA DE ANEXOS Anexo A: Ficha odontológica (odontograma) específica para primatas, desenvolvida pelo Laboratório de Odontologia Comparada (LOC), vinculado ao Departamento de Cirurgia da Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo (FMVZ-USP)..................................................................................142 LISTA DE FIGURAS Figura 1: Ateles paniscus do Zoológico de São Paulo...................................................27 Figura 2: Representação da anatomia dentária e tecidos adjacentes em dente de carnívoro..........................................................................................................32 Figura 3: Classificação de fratura dentária adotada pelo AVDC, adaptada de Basrani (1983) e ilustrada por Lopes (2008)................................................................54 Figura 4: Vista lateral esquerda do sincrânio de Ateles marginatus (MZ-USP-5288) posicionado para a avaliação odontológica.....................................................60 Figura 5: Vista rostral de sincrânio de Ateles marginatus (MPEG-4073)......................63 Figura 6: Distribuição sexual dos sincrânios de Ateles sp. avaliados de acordo com a espécie..............................................................................................................64 Figura 7: Distribuição das espécies de Ateles sp. avaliadas de acordo com o local de vida...................................................................................................................64 Figura 8: Padrão oclusivo normal em sincrânio de fêmea de Ateles geoffroyi (MPEG21835)..............................................................................................................66 Figura 9: Prognatismo mandibular em sincrânio de vida livre de Ateles belzebuth (MPEG-5049)..................................................................................................67 Figura 10: Prognatismo mandibular em sincrânio de macho de vida livre de Ateles paniscus (MPEG-13243).................................................................................67 Figura 11: Alteração de simetria em sincrânio de fêmea de vida livre da espécie Ateles belzebuth (MPEG-5040)..................................................................................68 Figura 12: Alteração de simetria em sincrânio de macho de vida livre da espécie Ateles belzebuth (MPEG-1534)..................................................................................69 Figura 13: Alteração de simetria em sincrânio de fêmea de vida livre da espécie Ateles paniscus (MPEG-1274)..................................................................................69 Figura 14: Mineralização incompleta na transição do ramo vertical com ramo horizontal da mandíbula de fêmea de Ateles belzebuth de vida livre (MPEG-5039).......70 Figura 15: Mineralização incompleta na transição do ramo vertical com ramo horizontal da mandíbula de fêmea de Ateles paniscus de vida livre (MPEG-1275).........70 Figura 16: Mineralização incompleta do ramo vertical da mandíbula de macho de Ateles marginatus de vida livre (MHN-UFRJ-33606)...............................................71 Figura 17: Formação periostal bilateral em osso parietal de fêmea da espécie Ateles belzebuth de vida livre (MPEG-5048).............................................................71 Figura 18: Fratura mandibular em Ateles chamek de sexo indeterminado de vida livre (MHN-UFRJ-33621).......................................................................................72 Figura 19: Fratura mandibular em ramo horizontal esquerdo de fêmea de vida livre da espécie Ateles chamek (MZ-USP-5602)..........................................................72 Figura 20: Trauma de mandíbula de origem desconhecida em porção lateral direita em fêmea de vida livre da espécie Ateles chamek (MHN-UFRJ-6037)................73 Figura 21: Fratura com consolidação incompleta de ramo horizontal de mandíbula esquerda de fêmea jovem da espécie Ateles paniscus oriunda de cativeiro (MPEG-4069)..................................................................................................73 Figura 22: Fratura com proliferação óssea na inserção do arco zigomático esquerdo (osso maxilar) de fêmea de vida livre da espécie Ateles paniscus (MPEG1243)................................................................................................................74 Figura 23: Fêmea de vida livre da espécie Ateles paniscus com lábio leporino e fenda palatina (MPEG-1245).....................................................................................74 Figura 24: Fêmea de vida livre da espécie Ateles paniscus com lábio leporino e fenda palatina (MPEG-1267).....................................................................................75 Figura 25: Fêmea de vida livre da espécie Ateles paniscus com lábio leporino e fenda palatina (MPEG-6979).....................................................................................75 Figura 26: Distribuição dos sincrânios de Ateles sp. com afecções dentárias de acordo com a espécie e sexo................................................................................................76 Figura 27: Distribuição dos sincrânios de Ateles sp. com afecções dentárias de acordo com a espécie e local de vida...................................................................................76 Figura 28: Geminação do dente 204 e seu correspondente supranumerário com o 205...................................................................................................................78 Figura 29: Anomalia dentária de conformação em dente 205 de fêmea de vida livre da espécie Ateles belzebuth (MPEG-5033)..........................................................79 Figura 30: Anomalia de conformação em fêmeas de vida livre da espécie Ateles chamek...............................................................................................................79 Figura 31: Anomalia de conformação em elemento 109 de fêmea de vida livre da espécie Ateles paniscus (MPEG-1166).........................................................................80 Figura 32: Ausência dentária de 209 em fêmea de Ateles chamek de vida livre (MHNUFRJ-31293)...................................................................................................81 Figura 33: Dentes supranumerários adjacentes ao elemento 209 em fêmeas de vida livre da espécie Ateles paniscus...............................................................................81 Figura 34: Dentes pré-molares supranumerários em fêmeas de vida livre da espécie Ateles belzebuth..........................................................................................................82 Figura 35: Presença de dentes pré-molares supranumerários e apinhamento dentário em fêmea de vida livre da espécie Ateles marginatus (MPEG-5143)...................82 Figura 36: Presença de dentes pré-molares superiores supranumerários e apinhamento dentário em animal de vida livre da espécie Ateles chamek (MHN-UFRJ33620)..............................................................................................................83 Figura 37: Perda dentária antes e após a morte.................................................................84 Figura 38: Fêmea de vida livre da espécie Ateles paniscus apresentando perda dentária ocorrida antes da morte....................................................................................85 Figura 39: Fratura dentária em dente 203, com exposição de câmara pulpar coronal e reabsorção de margem alveolar, em animal de sexo indefinido da espécie Ateles paniscus (MPEG-1571).........................................................................85 Figura 40: Presença de pigmentação de esmalte em Ateles sp. de sexo indeterminado (MPEG-23209)................................................................................................86 Figura 41: Macho de Ateles sp. de cativeiro (MPEG-4063) com alterações ósseas características de doença periodontal..............................................................87 Figura 42: Fêmea de Ateles marginatus de vida livre (MZ-USP-5606) com alterações ósseas características de doença periodontal ...................................................87 Figura 43: Fêmea de Ateles marginatus de vida livre evidenciando reação periostal em face vestibular da crista alveolar, desde dente 203 até o 207 (MZ-USP19325)..............................................................................................................87 Figura 44: Apinhamento dentário dos dentes 303 e 304 em macho de Ateles paniscus de cativeiro (MPEG-8855)...................................................................................88 Figura 45: Apinhamento dentário dos dentes 301 e 401 em fêmea de Ateles paniscus de vida livre (MPEG-6992)..................................................................................88 Figura 46: Apinhamento dentário de dentes pré-molares superiores de Ateles marginatus de vida livre (MZ-USP-19322)........................................................................89 Figura 47: Deiscência óssea alveolar e fenestração em dentes 205 e 206 de Ateles paniscus de vida livre (MPEG-6992).............................................................................89 Figura 48: Deiscência óssea alveolar em dente 303 fraturado de Ateles paniscus de vida livre (MPEG-22052)........................................................................................90 Figura 49: Deiscência óssea alveolar em dente 203 de fêmea jovem da espécie Ateles chamek (MHN-UFRJ-506)..............................................................................90 Figura 50: Fenestração óssea alveolar em dente 206 de Ateles marginatus de vida livre (MZ-USP-19324).............................................................................................91 Figura 51: Fenestração óssea alveolar em dente 305 de macho jovem de cativeiro da espécie Ateles paniscus (MPEG-6984)............................................................92 Figura 52: Fenestração óssea alveolar em fêmea jovem de cativeiro da espécie Ateles paniscus (MPEG-4070)...................................................................................92 Figura 53: Desgaste dentário grau 2 em dentes 301 e 401 de fêmea de Ateles marginatus de vida livre (MPEG-5041).............................................................................93 Figura 54: Exposição de furca grau 1 em dente 207 de macho de vida livre da espécie Ateles belzebuth (MPEG-5036).......................................................................95 Figura 55: Exposição de furca grau 2 em dente 107 de fêmea de vida livre da espécie Ateles paniscus (MPEG-1166).........................................................................95 Figura 56: Exposição de furca grau 3 em dente 207 de fêmea de vida livre da espécie Ateles paniscus (MPEG-996)...........................................................................96 Figura 57: Exposição de câmara pulpar coronal com escurecimento dentário em dentes 405 e 406 fraturados em macho de vida livre da espécie Ateles belzebuth (MPEG-5036)..................................................................................................97 Figura 58: Exposição de câmara pulpar coronal com escurecimento dentário em dente 103 fraturado de macho de vida livre da espécie Ateles paniscus (MPEG1158)................................................................................................................97 Figura 59: Exposição de câmara pulpar coronal, em dente 204 com alterações sugestivas de cárie, de macho de vida livre da espécie Ateles paniscus (MPEG21796)..............................................................................................................98 Figura 60: Exposição de câmara pulpar coronal, em dente 103 com alterações sugestivas de cárie, de fêmea de vida livre da espécie Ateles marginatus (MZ-USP19325)..............................................................................................................98 Figura 61: Fratura dentária grau 2, com exposição de câmara pulpar coronal e escurecimento dentário em elemento 203 de macho de vida livre de Ateles paniscus (MPEG-21617).................................................................................100 Figura 62: Fratura dentária longitudinal, grau 2, com exposição de câmara pulpar e escurecimento dentário em elemento 209 de macho de vida livre de Ateles paniscus (MPEG-1158)...................................................................................100 Figura 63: Giroversão dos dentes 109 e 209 de macho de vida livre da espécie Ateles marginatus (MHN-UFRJ-32701)....................................................................101 Figura 64: Giroversão de todos os pré-molares inferiores em Ateles chamek de vida livre e sexo indeterminado (MHN-UFRJ-33613).......................................................101 Figura 65: Reabsorção da crista alveolar em pré-molares e molares superiores de fêmea de Ateles paniscus de vida livre (MPEG-1238)...................................................102 Figura 66: Reabsorção da crista alveolar em pré-molares e molares superiores de Ateles paniscus de vida livre e sexo indeterminado (MPEG-1571)...........................102 LISTA DE TABELAS Tabela 1: Distribuição do número de sincrânios avaliados de acordo com a espécie e coleção de procedência....................................................................................59 Tabela 2: Distribuição dos sincrânios de Ateles sp. de acordo com as principais afecções e local de vida..................................................................................................65 Tabela 3: Distribuição e ocorrência das alterações oclusivas segundo espécie e sexo...................................................................................................................66 Tabela 4: Distribuição e ocorrência dos sincrânios assimétricos segundo espécie e sexo..................................................................................................................68 Tabela 5: Distribuição da ocorrência das afecções dentárias avaliadas de acordo com o local de vida em sincrânios de Ateles sp..........................................................77 Tabela 6: Distribuição e ocorrência de sincrânios com perda dentária antes da morte segundo espécie e sexo....................................................................................83 Tabela 7: Distribuição dos indivíduos com perda dentária ocorrida antes da morte de acordo com a espécie e grau da lesão..............................................................84 Tabela 8: Distribuição e ocorrência do desgaste dentário por espécie e grau da lesão.................................................................................................................93 Tabela 9: Identificação dos sincrânios acometidos pela exposição de furca com informações referentes ao sexo, local de vida e grau da lesão........................94 Tabela 10: Distribuição do número de dentes fraturados por grau de fratura...................99 SUMÁRIO 1 INTRODUÇÃO..................................................................................................................... 22 2 REVISÃO DE LITERATURA.............................................................................................. 25 2.1 Macaco-Aranha (Ateles sp.)............................................................................................ 26 2.1.1 Características Gerais da Espécie........................................................................... 26 2.1.2 Dieta......................................................................................................................... 28 2.2 Sincrânios............................................................................................................................ 29 2.2.1 Mandíbula.................................................................................................................... 30 2.2.2 Rostro........................................................................................................................... 30 2.2.3 Abobada Craniana....................................................................................................... 31 2.2.4 Arcos Zigomáticos........................................................................................................31 2.2.5 Dentes...........................................................................................................................31 2.3 Dentes..................................................................................................................................32 2.3.1 Anatomia e Fisiologia.................................................................................................. 32 2.3.2 Classificação................................................................................................................ 34 2.3.3 Linguagem Anatômica para Odontologia....................................................................36 2.3.4 Dentição dos Primatas................................................................................................. 37 2.3.5 Dentição dos Primatas da Família Atelidae................................................................ 40 2.4 Avaliação Odontológica...................................................................................................... 40 2.5 Principais Lesões Odontológicas dos Primatas Neotropicais............................................. 43 2.5.1 Anomalias Dentárias de Número................................................................................. 43 2.5.2 Anomalias Oclusivas.................................................................................................... 45 2.5.3 Alterações Amelo-Cementárias....................................................................................46 2.5.4 Doença Periodontal..................................................................................................... 47 2.5.5 Cárie.............................................................................................................................50 2.5.6 Desgaste....................................................................................................................... 52 2.5.7 Trauma......................................................................................................................... 53 2.5.8 Outras Alterações em Ossos do Sincrânio................................................................... 55 3 OBJETIVOS.......................................................................................................................... 58 4 MATERIAL E MÉTODOS................................................................................................... 59 5 RESULTADOS...................................................................................................................... 64 5.1 Alterações em Sincrânios................................................................................................ 65 5.1.1 Alterações Oclusivas................................................................................................ 66 5.1.2 Assimetria.................................................................................................................67 5.1.3 Alterações Ósseas.................................................................................................... 69 5.2 Afecções Dentárias......................................................................................................... 75 5.2.1 Anomalia Dentária de Conformação....................................................................... 77 5.2.2 Anomalia de Número............................................................................................... 80 5.2.3 Alterações Amelo-Cementárias................................................................................85 5.2.4 Doença Periodontal................................................................................................. 86 5.2.5 Apinhamento Dentário............................................................................................. 88 5.2.6 Deiscência Óssea Alveolar...................................................................................... 89 5.2.7 Fenestração Óssea Alveolar.................................................................................... 91 5.2.8 Desgaste Dentário....................................................................................................92 5.2.9 Exposição de Furca................................................................................................. 94 5.2.10 Exposição de Câmara Pulpar................................................................................ 96 5.2.11 Fratura Dentária....................................................................................................98 5.2.12 Giroversão Dentária............................................................................................ 100 5.2.13 Reabsorção da Crista Alveolar............................................................................ 102 6 DISCUSSÃO....................................................................................................................... 103 7 CONCLUSÕES................................................................................................................... 115 8 REFERÊNCIAS................................................................................................................... 116 Pais, F. R. O. Avaliação Odontológica em Sincrânios de Macaco-Aranha (Ateles sp.). [Dissertação de Mestrado]. Vila Velha: Pós-Graduação em Ciência Animal, UVV – Centro Universitário Vila Velha, 2011. RESUMO Os dentes, com suas incontáveis formas, desempenham importante papel no estudo da vida animal, tendo como vantagem o fato de serem formados por materiais resistentes que sobrevivem a situações adversas. A história natural de uma espécie pode ser determinada através de interpretações do seu sincrânio. O estudo da dentição pode qualificar uma espécie animal, assim como fornecer informações sobre abundância, idade, sexo, demografia e dieta. O objetivo deste trabalho foi avaliar sincrânios de Ateles sp., oriundos de vida livre e cativeiro, armazenados em coleções de mastozoologia, com o intuito de estabelecer as principais alterações de sincrânios e afecções dentárias. Foi efetuada avaliação de 253 Ateles sp. depositados nas coleções do Museu Paraense Emílio Goeldi, Museu Histórico Nacional da Universidade Federal do Rio de Janeiro e do Museu de Zoologia da Universidade de São Paulo. Em sincrânios foram encontradas: alterações oclusivas (26,5%), assimetria (14,7%) e alterações ósseas (5,3%). As afecções dentárias foram: anomalia dentária de conformação (2,6%), anomalia de número (28,6%), alterações amelo-cementárias (85,5%), apinhamento dentário (7,9%), deiscência (4,4%), fenestração (3%), desgaste dentário (36,1%), exposição de furca (3,1%), exposição de câmara pulpar (15%), fratura dentária (13,2%), giroversão dentária (0,9%) e reabsorção de crista alveolar (27,8%). Conclui-se que os Ateles sp. possuem afecções em sincrânio, sendo as alterações oclusivas os achados mais significativos em animais de cativeiro (55%); foram encontrados animais de vida livre de regiões distintas com lesões características de lábio-leporino e fenda palatina, sendo este achado incomum para este gênero; os dois grupos de Ateles sp. possuem afecções dentárias semelhantes. Palavras-chave: primata neo-tropical, estomatognático, lesões orais, dentes. Atelidae, odontologia veterinária, sistema Pais, F. R. O. Odontological Evaluation in Skulls of Spider Monkeys (Ateles sp.). [Dissertação de Mestrado]. Vila Velha: Pós-Graduação em Ciência Animal, UVV – Centro Universitário Vila Velha, 2011. ABSTRACT The countless teeth forms play an important role in animal study, since teeth are made of tough materials that can survive even the most adverse situations. Animal history can also be determined by the skull interpretation. The dentition’s study may qualify animal species, as well as provide information about abundance, age, sex, demography and diet. The present study aimed to evaluate skulls of free-raging and captive Ateles sp., kept in museum collections, in order to establish the most important oral lesions and skull diseases. For this purpose, this study evaluated 253 Ateles sp., kept in the Museu Paraense Emilie Goeldi, Museu Histórico Nacional da Universidade Federal do Rio de Janeiro and Museu de Zoologia de São Paulo. In skulls were found: malocclusion (26,5%), asymmetry (17,7%) and osteological lesions (5,3%). The most important oral lesions found were: Dental conformation anomaly (2,6%), numbering anomaly (28,6%), enamel and cementum lesions (85,5%), crowding (7,9%), dehiscence (4,4%), fenestration (3%), teeth wear (36,1%), furcation exposure (3,1%), exposure of tooth chamber (15%), dental fracture (13,2%), dental giroversion (0,9%) and resorption of alveolar crest (27,8%). It was concluded that Ateles sp. has skull diseases, represented mostly by malocclusion in captive animals (55%); free-raging animals from different locations were found with lesions that were similar to oral and palate cleft, which was uncommon for this genus; both free-raging and captive Ateles sp. have similar oral diseases. Keywords: neotropical primate, Atelidae, veterinary dentistry, oral, stomatognathic system, oral lesions, tooth. 22 1 INTRODUÇÃO A história natural de uma espécie animal pode ser determinada por meio de interpretações detalhadas das formas dos sincrânios (HILLSON, 1996; ELBROCH, 2006). As coleções são essenciais para o entendimento da evolução, taxonomia e filogenia. A importância de uma coleção está não apenas na diversidade de espécimes mantidas em um determinado acervo, como também se manifesta de acordo com o número de indivíduos de uma mesma espécie coletados durante um dado período de tempo (ELBROCH, 2006). Os museus permitem a avaliação de condições patológicas sofridas por animais selvagens durante a vida, sem o perigoso e árduo manejo de algumas espécies (DEGUSTA e MILTON, 1998). Por esse motivo, é crescente o número de pesquisas que utilizam sincrânios com essa finalidade (FITCH e FAGAN, 1982; PENZHORN, 1984; ERB e NORMAN, 1996; SIMÕES-LOPES, 2006; ROSSI Jr. et al., 2007a; ROSSI Jr. et al., 2007b; FECCHIO et al., 2008). Os dentes, com suas incontáveis formas, desempenham um importante papel no estudo da vida animal (HILLSON, 1996; UNGAR e WILLIAMSON, 2000; DAYAN et al., 2002; ELBROCH, 2006). Eles são achados comuns em sítios arqueológicos de vários períodos, tendo como vantagem o fato de serem formados por materiais resistentes que resistem a uma ampla variedade de situações adversas (HILLSON, 1996; DEGUSTA et al., 2003; DENNIS et al., 2004). Entretanto, poucos trabalhos se propõem a avaliar detalhadamente aspectos clínicos do sincrânios de primatas neotropicais. O estudo da dentição pode qualificar uma determinada espécie animal, assim como fornecer informações sobre sua abundância, idade, sexo (HILLSON, 1996; WOOD et al., 1991; ELBROCH, 2006), demografia e dieta (HILLSON, 1996). Segundo Badyaev (1998), os dentes dos mamíferos figuram também como indicadores de estresse ambiental. As consequências das alterações odontológicas na saúde geral do paciente, seja ele doméstico ou selvagem, fizeram com que a odontologia ocupasse um lugar de destaque no meio veterinário. A odontologia preventiva é importante para que haja preservação dos mecanismos de digestão, mantendo assim a sanidade geral, a eficiência reprodutiva e aumentando a expectativa de vida dos animais selvagens mantidos em cativeiro (PACHALY, 2006; FECCHIO et al., 2009). 23 O programa de cuidados de um plantel de uma instituição que abriga animais selvagens em cativeiro deve incluir a odontologia preventiva, para que se detectem precocemente as lesões já existentes, eliminando assim as causas de seu agravamento e, consequentemente, aumentando a eficácia do tratamento (PACHALY, 2006). Alguns trabalhos têm sido escritos visando descrever a anatomia do crânio e os diferentes tipos de dentição animal, assim como suas alterações (AZARIAS et al., 2006; ROSSI Jr. et al., 2007a; ROSSI Jr. et al., 2007b; FECCHIO et al., 2008). Entretanto, o variado número de espécies dificulta o diagnóstico das condições patológicas, visto que a forma dentária varia demasiadamente entre os animais selvagens (MILES e GRIGSON, 2003; FECCHIO et al., 2009). A estreita relação filogenética dos primatas não-humanos (PNH) com o homem tornou-os excelentes modelos para o estudo da biologia e comportamento (SIBAL e SAMSON, 2001). Algumas pesquisas sobre a evolução da gengivite e periodontite foram feitas utilizando esses animais, permitindo que variáveis impossíveis em modelos humanos fossem avaliadas (BARDACH e KELLY, 1988; SIBAL e SAMSOM, 2001). Da mesma forma, alguns trabalhos têm sido desenvolvidos utilizando sincrânios de primatas para outros fins diversos (SHAW, 1927; HORNBECK e SWINDLER, 1967; KANAZAWA e ROSENBERGER, 1989; RAVOSA e ROSS, 1994; DEGUSTA e MILTON, 1998; DEGUSTA et al., 2003). Os primatas neotropicais representam um desafio ao médico veterinário, já que além do potencial zoonótico, existem muitas diferenças entre as dentições das variadas espécies (JOHNSON-DELANEY, 2008). As afecções dentárias são frequentes em platirrinos (espécies do novo mundo ou neotropicais) mantidos em cativeiro (VALENÇA-MONTENEGRO et al., 2005; VERONA e PISSINATTI, 2006) e sua fórmula dentária quase nunca é estudada com riqueza de detalhes, a não ser por valores históricos. O número de dentes, assim como sua forma e posição, pode afetar a dieta, a determinação da idade, a socialização, a dominância sexual, os ábitos alimentares e a mastigação (AMAND e TINKELMAN, 1985). Como consequência, transtornos sistêmicos como desnutrição ou infecções podem estar presentes (PACHALY, 2006). As espécies do gênero Ateles estão ameaçadas pela caça e pela destruição do seu habitat, pelo simples fato de não conseguirem sobreviver em áreas fragmentadas (BICCAMARQUES et al., 2006). Segundo a International Union for Conservation on Nature (2001), as populações de Ateles belzebuth, Ateles chamek e Ateles marginatus estão em declínio, o que as coloca na lista das espécies em perigo de extinção. A espécie Ateles paniscus está 24 classificada pela mesma organização como vulnerável. De acordo com a Lista Nacional das Espécies Brasileiras Ameaçadas de Extinção do Ministério do Meio Ambiente (BRASIL, 2010), A. belzebuth e A. marginatus são consideradas espécies ameaçadas. Em decorrência da escassez de estudos referentes à odontologia de espécies brasileiras de Ateles sp., principalmente em animais de vida livre, este trabalho avaliou lesões odontológicas em 253 sincrânios, oriundos de indivíduos coletados por pesquisadores e depositados nas coleções do Museu de Zoologia da Universidade de São Paulo (MZ-USP), do Museu Paraense Emílio Goeldi (MPEG) e do Museu Nacional da Universidade Federal do Rio de Janeiro (MHN-UFRJ). 25 2 REVISÃO DE LITERATURA A cavidade oral, os dentes e os tecidos associados de todos os animais, sejam eles domésticos ou selvagens, têm importância fundamental na manutenção da sanidade, podendo afetar a eficiência do processamento dos alimentos (FAGAN, 1983; PACHALY, 2006). A dentição tem como função não apenas a preensão e a mastigação, mas também é usada na higiene da pelagem, demonstrações sociais, demonstrações de agressividade e como meio de defesa (HILLSON, 1996). Algumas espécies animais a utilizam na inoculação de peçonha, como meio de interação sexual, na predação, locomoção, fonação, como ferramenta de trabalho e como instrumento para limpeza corpórea (FECCHIO et al., 2009). As afecções da cavidade oral, causadas por microorganismos ou seus produtos, podem ou não estar relacionadas a uma doença odontológica primária, podendo afetar tanto o tecido e as estruturas que dão suporte ao dente, quanto lesioná-lo diretamente com a formação de cáries. As fraturas dentárias, consideradas defeitos primários, podem levar à infecção da cavidade pulpar, abscessos apicais com subsequente erosão do osso adjacente, resultando em osteomielite e fistulação (PACHALY, 2006). Portanto, toda vez que um animal selvagem for contido e anestesiado por qualquer que seja a razão, a cavidade oral deve ser examinada (AMAND e TINKELMAN, 1985; PACHALY, 2006), já que o diagnóstico da maioria das enfermidades orais é feito desta maneira (PACHALY, 2006). As principais enfermidades orais que afetam os mamíferos selvagens cativos são as alterações no desenvolvimento de tecidos calcificados, maloclusão, traumas e degeneração dentária por atrito, abrasão, erosão e reabsorção. A dieta inadequada pode levar à ação de microorganismos patogênicos, destruindo tecidos calcificados e causando inflamação dos tecidos moles (PACHALY, 2006). O trauma dentário, com consequente exposição da polpa dentária, é muito comum tanto em carnívoros como primatas, ocorrendo principalmente pela mordedura de objetos e lutas com animais do recinto. As ações humanas criminosas que ocorrem no tráfico de animais e nos circos também podem ser responsáveis por esses traumas, com o simples intuito de diminuir a periculosidade de algumas espécies (PACHALY, 2006). 26 2.1 Macaco-Aranha (Ateles sp.) 2.1.1 Características Gerais da Espécie O macaco-aranha pertence à família Atelidae, subfamília Atelinae e gênero Ateles. A taxonomia do referido gênero está sob discussão e ainda não foi totalmente esclarecida (TAKAHASHI, 2008). As espécies reconhecidas do gênero e encontradas no Brasil são: A.. paniscus, A. belzebuth, A. chamek e A. marginatus. Esses animais habitam as florestas primárias e as bordas dos rios da floresta amazônica, ocorrendo nos estados do Amazonas, Acre, Pará, Rondônia, Roraima, Amapá e Mato Grosso (BICCA-MARQUES et al., 2006) (Figura 1). Segundo Verona e Pissinatti (2006), o gênero Ateles pode ser encontrado também na América Central. Figura 1 – Distribuição geográfica das espécies brasileiras de Ateles sp. 27 As espécies do gênero Ateles são reconhecidas por serem grandes primatas neotropicais, com peso entre 7 e 9 kg, membros longos e cauda preênsil (BICCA-MARQUES et al., 2006), vivendo em média 20 anos (VERONA e PISSINATTI, 2006). O comprimento médio da cabeça e corpo é de 540 mm e o da cauda 800 mm (BICCA-MARQUES et al., 2006). Esses primatas não apresentam dimorfismo sexual, podendo o clitóris proeminente ser facilmente confundido com o pênis (BICCA-MARQUES et al., 2006). O pênis é alongado e apresenta morfologia simples (VERONA e PISSINATTI, 2006). Os dedos são longos e delgados e as mãos não têm polegares, característica esta que está relacionada à sua locomoção por braquiação e escalada (BICCA-MARQUES et al., 2006). Esses primatas são arborícolas, ocupando o estrato mais alto da floresta, chegando a alcançar 30 metros de altura, local com maior quantidade de frutos maduros (BICCAMARQUES et al., 2006). O macaco-aranha é extremamente adaptado à vida nas árvores (CAMPBELL et al., 2005), descendo ao chão somente para beber água e consumir importantes recursos ou, em áreas com baixa ocorrência de predadores, para socializar-se ou atravessar áreas abertas (BICCA-MARQUES et al., 2006) (Figura 2). Figura 2 – Ateles paniscus do Zoológico de São Paulo 28 2.1.2 Dieta Os primatas neotropicais são animais que apresentam uma alimentação variada, com o consumo de diferentes tipos de alimentos para suprir suas necessidades nutricionais, o que torna difícil a correta descrição de suas tendências, preferências e adaptações dietéticas (ROSENBERGER, 1992). Um primata raramente come uma fruta inteira (KINZEY e NORKONK, 1990). O processamento do alimento inclui processos de grande pressão de oclusão (perfuração, corte e o cisalhamento) e de baixa pressão de oclusão (trituração e moedura) (ROSENBERGER e KINZEY, 1976). As frutas representam cerca de 90% de toda ingestão de alimentos de A. paniscus, que dedica pouco tempo na ingestão de folhas, flores ou cascas (ROSENBERGER e KINZEY, 1976). A espécie tem preferência por frutas maduras, frescas e inteiras. Quando a fruta é pequena e seu exocarpo pouco espesso, A. paniscus a come inteira. Estes animais também podem remover o exocarpo com os dentes, engolindo as sementes juntamente com o arilo (ROSENBERGER e KINZEY, 1976; WHITE, 1986). A ingestão de invertebrados não foi observada nenhuma vez no estudo de Rosenberger e Kinzey (1976). Bicca-Marques et al. (2006) relatam que a alimentação da espécie inclui uma grande variedade de frutos, porém folhas, flores, sementes, cascas de árvores, madeira em decomposição e terra estão presentes em menor quantidade. De acordo com Laska et al. (2000), macacos-aranha em cativeiro mostram preferência por frutas maduras, ricas em carboidratos, altamente energéticas, com baixo teor de água e com altos teores de magnésio, cobre e manganês. As famílias Atelinae e Alouattinae apresentam dietas totalmente distintas, apesar da similaridade de seus pesos corpóreos e afinidade filogenética. Enquanto Atelinae é altamente frugívora, Alouattinae é folívora (ANTHONY e KAY, 1993). Russo et al. (2005) relatam que diferentes espécies de Ateles sp. consomem dietas similares, possuem organização social e comportamento parecidos, tornando-as bons exemplos a serem utilizados em comparações interespecíficas. Em 1986, Frances White realizou um estudo no Peru com a espécie Ateles paniscus chamek. Assim como fora observado por Rosenberger e Kinzey (1976), as frutas representaram cerca de 80% da alimentação desses animais. Para White (1986), a maior 29 proporção de folhas e brotos pode ser resultado da menor disponibilidade de frutas e a abundância de novas folhas na estação das secas. Kinzey e Norkonk (1990) observaram que A. paniscus e Chiropotes satanas consomem diferentes partes das mesmas espécies de frutas, cada uma delas com dureza específica, usando diferentes técnicas de processamento. No estudo por eles realizado, A. paniscus consumiu apenas o mesocarpo macio e a dureza das sementes não foi uma influência significativa para a espécie, já que esses animais não são capazes de mastigá-las ou digeri-las. Kinzey e Norkonk (1990) puderam ainda observar que nenhuma das sementes encontradas nas fezes de A. paniscus foi mastigada, tendo sido cuspidas. De acordo com Russo et al. (2005), esse padrão de alimentação do macaco-aranha mostra seu importante papel na dispersão de sementes. Segundo Rosenberger (1992), é provável que A. paniscus, um primata substancialmente de grande porte, tenha mandíbula, músculos, vestíbulo e dentes não especializados no processamento de alimentos tão duros quanto C. satanas, usando como referência o estudo realizado anteriormente por Kinzey e Norkonk (1990). 2.2 Sincrânios O sincrânio caracteriza-se por um conjunto de ossos que abriga e protege o cérebro e as porções iniciais do sistema digestório e respiratório. Ele é formado pelo crânio e pela mandíbula, que trabalham de forma conjunta em funções como alimentação e comunicação. (ELBROCH, 2006). Os ossos do sincrânio podem ser classificados como pareados ou não pareados. Ossos pareados são aqueles encontrados em ambos os antímeros, enquanto os não pareados são encontrados em singularidade e estão geralmente associados com a linha média (ELBROCH, 2006). Pode-se observar uma nítida simetria em todos os sincrânios, porém uma análise detalhada pode revelar que é extremamente raro encontrar um animal cujos lados direito e esquerdo sejam idênticos (ELBROCH, 2006). 30 2.2.1 Mandíbula A mandíbula pode variar tanto no tamanho quanto na forma. Ela apresenta três processos onde há inserção muscular e articulação com os ossos do crânio através do côndilo. Esses processos são denominados angular, condilóide e coronóide e podem divergir de acordo com as espécies e famílias em questão (ELBROCH, 2006). A articulação temporomandibular (ATM) é responsável pela conexão da mandíbula ao crânio. Por conta da enorme diversidade de conformações da ATM entre os primatas, sua anatomia comparada é importante para a taxonomia (WALL, 1999). 2.2.2 Rostro O formato do rostro varia consideravelmente entre as espécies. O comprimento e a forma do osso nasal na superfície dorsal são muito importantes nessa identificação. A sutura nasal pode estar fusionada e obliterada, sendo impossível determinar o início ou fim do osso nasal. O limite posterior deste osso também é significativo, principalmente quando comparado ao comprimento e formato dos ossos maxilar e pré-maxilar, que formam a superfície lateral e ventral do rostro. A cavidade nasal é uma abertura criada pelos ossos nasais, pré-maxilares e maxilares, onde se encontram os nervos e receptores olfatórios. Ela pode ser maior ou menor, vertical ou abruptamente angulada (ELBROCH, 2006). O forame infraorbital serve de passagem para nervos, veias e artérias e encontra-se localizado lateralmente ao rostro. O tamanho e a forma do forame infraorbital podem variar entre as espécies. Na superfície ventral do rostro estão o palato e os foramens incisivos. A análise da forma e comprimento do palato, assim como seu fim, é essencial para o estudo do sincrânio. O formato e tamanho dos forames incisivos e o alinhamento dos seus limites anterior e posterior são igualmente importantes nessa tarefa (ELBROCH, 2006). 31 2.2.3 Abóbada Craniana A região interorbital dos sincrânios dos mamíferos é formada pelo osso frontal. A amplitude interorbital é uma variante importante na identificação, principalmente quando comparada a amplitude pós-orbital. Os processos pós-orbitais são caracterizados por extensões ósseas que se projetam do osso frontal para dar suporte à órbita (ELBROCH, 2006). A superfície ventral é bastante complexa, sendo formada por numerosos ossos e foramens. Podem-se observar também as bulhas auditivas, que são estruturas importantes quando há comparações entre espécies. Os côndilos occipitais são duas grandes protuberâncias em ambos os lados do forâmen magno, por onde passa a medula óssea (ELBROCH, 2006). 2.2.4 Arcos Zigomáticos Os arcos zigomáticos podem ser largos ou estreitos, delgados ou robustos, paralelos ou convergentes. O ramo maxilar do arco zigomático conecta a parte anterior ao crânio, enquanto o ramo escamoso o conecta ao posterior (ELBROCH, 2006). 2.2.5 Dentes O estudo da dentição é uma importante ferramenta para a interpretação da vida animal (ELBROCH, 2006). Os dentes podem variar em número, tamanho, formato e posição, até mesmo em animais da mesma espécie (MILES e GRIGSON, 2003). Este assunto figura como peça primordial para o entendimento do presente trabalho, portanto será abordado de forma detalhada no capítulo 2.3. 32 2.3 Dentes 2.3.1 Anatomia e Fisiologia A dentição dos mamíferos é formada por dentes de formato, constituição e distribuição variada que, em conjunto com o periodonto, formam o órgão dentário (PACHALY, 2006). O dente é constituído basicamente pela raiz firmemente inserida na cavidade óssea alveolar e pela coroa (ELBROCH, 2006; PACHALY, 2006). O periodonto é responsável pela fixação e sustentação do elemento dentário, sendo constituído de tecido mole (gengiva e ligamento periodontal) e tecido duro (osso alveolar e cemento). O ligamento periodontal é formado por fibras de tecido conjuntivo denso, responsáveis pela união do dente ao osso alveolar através das fibras periodontais. A gengiva fixa-se ao dente por meio do epitélio juncional, cuja região mais coronal forma o sulco gengival. O epitélio juncional hígido une-se ao esmalte e forma um sulco gengival que, no cão, apresenta em média 2 mm de profundidade (GIOSO, 2003) (Figura 3). Figura 3 – Representação da anatomia dentária e tecidos adjacentes em dente de carnívoro: esmalte (a), dentina (b), polpa (c), gengiva (d), cemento (e), ligamento periodontal (f) e osso alveolar (g) (LOPES, 2008) 33 A coroa dentária é recoberta por uma delgada camada de esmalte, que é considerado a estrutura biológica mais rígida do corpo de um animal (HILLSON, 1996; SWINDLER, 2002). Segundo Pachaly (2006), essa estrutura duríssima e lisa é produzida pelos ameloblastos. A coroa pode variar em tamanho, largura, altura e possuir um número variado de cúspides (HILLSON, 1996; SWINDLER, 2002). O esmalte é semitranslúcido, variando em cor de amarelo claro a branco. Esse componente atinge sua espessura total antes da erupção dentária, sendo mais espesso nas cúspides dos pré-molares e molares ainda não erupcionados e mais delgado ao redor da região cervical. Os dentes decíduos têm uma camada de esmalte mais fina do que os permanentes e podem ser ligeiramente mais brancos. O esmalte maduro é formado por cerca de 96% de fosfato de cálcio inorgânico e pertence ao grupo mineral hidroxiapatita (HILLSON, 1996; SWINDLER, 2002). A dentina, constituída de materiais orgânicos e minerais (HILLSON, 1996) como colágeno e hidroxiapatita (HILLSON, 1996; SWINDLER, 2002), é produzida pelos odontoblastos (PACHALY, 2006). Essa estrutura é mais macia que o esmalte, porém mais dura do que os ossos (HILLSON, 1996; SWINDLER, 2002). A dentina compõe tanto a massa do dente, como sua raiz, sendo mais compressível e elástica do que o esmalte (HILLSON, 1996; SWINDLER, 2002). De acordo com Pachaly (2006), a dentina caracterizase por uma estrutura permeada por microcanais. Ao contrário dos ameloblastos, os odontoblastos continuam produtivos por toda vida. Após a completude do crescimento dentário há produção de dentina secundária, que protege a polpa da exposição, conforme o esmalte é desgastado. Essa característica pode ser observada na forma de pequenas áreas de tecido escuro na superfície de oclusão dos dentes, podendo ocupá-la totalmente com o passar dos anos (SWINDLER, 2002; GIOSO, 2003). Os odontoblastos desempenham um importante papel nos traumatismos dentários, pois são capazes de produzir a dentina restauradora ou terciária, que tem a função de tentar impedir a comunicação da cavidade oral com a pulpar (GIOSO, 2003). A raiz dentária é revestida externamente pelo cemento (SWINDLER, 2002; PACHALY, 2006). Os cementoblastos produzem dois tipos de cemento: celular e acelular (SWINDLER, 2002). O cemento celular é menos rígido que o esmalte e a dentina, podendo ser comparado aos ossos (HILLSON, 1996; SWINDLER, 2002), exceto pelo fato de que não pode ser reabsorvido e remodelado, crescendo camada por camada por aposição (SWINDLER, 2002). 34 O remodelamento, entretanto, pode ocorrer quando o cemento é destruído pelos odontoclastos, sendo estes os responsáveis pelo reparo das áreas lesionadas. Pelo fato do cemento envolver a raiz do dente, as fibras do ligamento periodontal passam do osso alveolar para se ligarem a ele, com o intuito de manter o dente em seu respectivo alvéolo (HILLSON, 1996; SWINDLER, 2002). O cemento, além de agregar tamanho e força ao dente, também é responsável pela proteção da dentina (SWINDLER, 2002). A polpa dentária ocupa a cavidade pulpar e é circundada pela dentina (HILLSON, 1996; SWINDLER, 2002). Ela é formada por artérias e veias, nervos, vasos linfáticos, filetes nervosos, células e substância intercelular (SWINDLER, 2002; GIOSO, 2003). Essas estruturas entram e saem do dente através do forame apical situado na extremidade da raiz. Quando a polpa é exposta, por qualquer que seja a razão, ocorre dor intensa (SWINDLER, 2002; GIOSO, 2003). A região do ápice dentário é o local por onde os vasos sanguíneos e as terminações nervosas têm acesso ao dente (GIOSO, 2003). Ela varia de acordo com a espécie animal estudada e sua anatomia deve ser observada, principalmente para a realização do tratamento endodôntico. Esta região também mantém contato direto com o ligamento periodontal e, em casos de periodontite, a polpa do dente também pode ser acometida (GIOSO, 2003). 2.3.2 Classificação A maior parte dos mamíferos são difiodontes, o que significa que eles apresentam dois conjuntos de dentes durante a vida. O primeiro conjunto é formado pela dentição decídua. Os dentes molares não têm precursores decíduos. A dentição permanente repõe a dentição decídua ao longo do tempo (WIGGS e BLOOM, 2003; ELBROCH, 2006). Animais elodontes apresentam crescimento dentário contínuo durante toda a vida, sendo necessário o desgaste constante. Os carnívoros, primatas e a maioria dos herbívoros são anelodontes, ou seja, seus dentes permanentes não continuam a crescer após terem atingido sua extensão máxima (PACHALY, 2006). Os anelodontes hipsodontes têm coroas muito longas e raízes menores, como os equídeos e os ruminantes. Todavia, os anelodontes braquiodontes como os carnívoros e os primatas, apresentam pequena diferença entre a 35 extensão da coroa clínica e da coroa anatômica (WIGGS e BLOOM, 2003; PACHALY, 2006). A dentição também pode ser heterodonte ou homodonte. Um grande número de espécies mamíferas apresenta mais de um tipo de dente, ou seja, são considerados heterodontes. Quase todos os carnívoros e onívoros têm quatro tipos de dentes: incisivos, caninos, pré-molares e molares. Esses dentes podem variar em número de acordo com a espécie estudada (ELBROCH, 2006). Os dentes incisivos são pequenos dentes em forma de cinzel localizados na região frontal, mantêm suas raízes inseridas nos ossos pré-maxilares do crânio e seus correspondentes inseridos na mandíbula. Eles são usados para cortar e retirar pedaços e, em carnívoros e onívoros, no ato de cortar frutas, vegetais e carnes macias (ELBROCH, 2006). Geralmente os carnívoros e onívoros possuem quatro caninos unicuspidados. Eles caracterizam-se por grandes dentes de formato cônico usados para perfurar, capturar, segurar e matar, além de servirem como armas nas disputas por território e na autodefesa (ELBROCH, 2006). Os dentes pré-molares e molares estão localizados distalmente e são usados na mastigação, para cortar alimentos grandes e duros e moer materiais fibrosos. A grande variedade de alimentos mastigados pelos animais é refletida na grande diversidade de formas e formatos apresentados por esses dentes (POPOWICS e FORTELIUS, 1997; ELBROCH, 2006). Os dentes pré-molares, ao contrário dos molares, apresentam correspondentes decíduos (ELBROCH, 2006). Segundo Popowics e Fortelius (1997), o padrão de superfície oclusiva também pode estar associado aos diferentes potenciais de corte de um dente. Animais carnívoros apresentam dentes de conformação carniceira, enquanto os herbívoros podem apresentar formas solenodontes e bilofodontes. Os molares dos mamíferos podem assumir diferentes formas adaptadas para a mastigação. Apesar dos molares dos primatas nunca expressarem algumas das condições extremas observadas em outros mamíferos, os termos seguintes são úteis na descrição de sua morfologia. Animais com molares de coroas largas e baixas são denominados braquiodontes, enquanto os hipsodontes possuem uma coroa relativamente elevada. Quando as espécies têm molares de cúspides moderadamente arredondadas, baixas e separadas elas são chamadas bunodontes. Se as cúspides formam cumes alinhados tanto transversalmente, quanto obliquamente ao longo da cadeia da superfície de oclusão do dente, eles são chamados de lofodontes. O molar selodonte caracteriza-se por cúspides que se expandem de forma crescente, porém não é encontrado em nenhum primata (SWINLDER, 2002). Há um 36 questionamento no fato dos dentes molares serem dentes decíduos que nunca serão substituídos ou se são dentes permanentes sem predecessores. A erupção dos molares é normalmente usada como evidência de maturidade (ELBROCH, 2006). De acordo com Ungar e Williamson (2000), a dentição dos mamíferos reflete sua dieta, já que alimentos de diferentes consistências requerem formatos igualmente distintos para o seu processamento. Muitos paleontólogos têm utilizado a relação entre formato do dente e dieta de mamíferos vivos para inferir adaptações dietéticas de fósseis. Grande parte desses estudos está baseada em dentes não desgastados, cujos aspectos funcionais são mais facilmente medidos (UNGAR e WILLIAMSON, 2000; DENNIS et al., 2004). No entanto, o formato dos dentes muda de acordo com a sua utilização e a maior parte dos dentes encontrados apresenta algum tipo de desgaste (UNGAR e WILLIAMSON, 2000). 2.3.3 Linguagem Anatômica para Odontologia Devido a sua uniformidade de conformação, é possível utilizar muitos termos em diferentes tipos de dentes (HILLSON, 1996). Com o intuito de seguir uma mesma referência anatômica, diversos autores adotaram a seguinte nomenclatura para os diversos posicionamentos dentários (HILLSON, 1996; GIOSO, 2003; KOWALESKY, 2005; AZARIAS et al., 2006): - Face vestibular: face externa de um dente, que mantém contato com o vestíbulo ou lábio. - Face mesial: face do dente mais próxima da linha mediana do arco dentário em direção ao plano entre os incisivos centrais direito e esquerdo. - Face lingual: face dos dentes maxilares e mandibulares que se volta para a língua. - Face oclusal: é a superfície de mastigação dos dentes posteriores com cúspides, cristas e sulcos. Para Kowalesky (2005), os dentes caninos e incisivos não apresentam face oclusal. - Margem incisal: é citada por Kowalesky (2005) e Gioso (2003) como sendo a margem, crista ou superfície cortante dos dentes que terminam em lâmina. - Palatina: face voltada para o palato. 37 - Apical: em direção ao ápice da raiz. - Coronal: em direção à coroa do dente. - Distal: face do dente mais distante da sínfise mentoniana. - Interproximal: entre os dentes; faces distal ou mesial. - Jugal, vidiana ou vestibular: relativas à bochecha, geralmente mucosa. 2.3.4 Dentição dos Primatas O dente típico de um mamífero é formado por uma coroa coberta por esmalte (HILLSON, 1986; SWINDLER, 2002). Em todos os primatas, assim como na maior parte dos mamíferos, o dente é preso ao seu respectivo alvéolo pelo ligamento periodontal (SWINDLER, 2002). Os primatas são animais heterodontes que possuem dentes incisivos, caninos, prémolares e molares (SWINDLER, 2002; WIGGS e HALL, 2003). Esses animais possuem dentes com uma, duas ou três raízes. Em muitas famílias de prossímios os dentes anteriores inferiores formam uma espécie de “pente”, que é usado no ato de retirar os próprios pelos. Os dentes superiores anteriores são comumente reduzidos e espaçados (HILLSON, 1996). Os primatas, assim como os carnívoros, são classificados como anelodontes braquiodontes. Esses animais apresentam uma diferença anatômica no ápice radicular, com grande importância na planificação e execução do tratamento endodôntico. Os primatas e carnívoros mais jovens apresentam ápice radicular aberto na forma de um amplo forame apical, porém essa característica se mantém nos primatas ao longo de toda sua vida (PACHALY, 2006). Normalmente os primatas apresentam mandíbula isognata, ou seja, a zona oclusal dos molares é coberta ou quase totalmente coberta pelo oposto maxilar (WIGGS e HALL, 2003). Segundo Swindler (2002), a dentição decídua de todos os primatas do novo mundo é: di2 – dc1 – dp3 / di2 – dc1 – dp3, ou seja, possuem dois incisivos, um canino e três pré-molares no hemi-arco dentário superior e inferior. Os incisivos superiores dos primatas apresentam uma forma laminar cortante, enquanto os incisivos inferiores e caninos da grande maioria dos prossímios formam um alinhamento dental procumbente (SWINDLER, 2002). 38 Tanto os caninos inferiores quanto os superiores têm função perfurante e formato de cone, exceto em alguns gêneros de prossímios, cujos caninos inferiores e incisivos se unem para formar o arco dentário. Existe pouca ou nenhuma característica significante do dente canino que permita a diferenciação sexual em primatas do novo mundo (SWINDLER, 2002). Segundo Amand e Tinkelman (1985), o dimorfismo sexual do tamanho do canino é indício de que este dente, além de atuar na alimentação, também tem um papel importante na predação, defesa e nas demonstrações comportamentais. Alguns gêneros de platirrinos, como Cebus e Ateles (Ateles geoffroyi) apresentam um grau modesto de dimorfismo sexual destes dentes (GUATELLI-STEINBERD et al., 2009). Gingerich e Shoeninger (1979) estudaram 48 espécies de primatas e concluíram que a variação observada em dentes caninos não pode ser explicada apenas pelo dimorfismo sexual, devendo a variação geográfica ser considerada. Em um estudo realizado com muriquis (Brachyteles arachnoides), as fêmeas do norte e sul do Brasil não demonstraram diferenças em relação ao comprimento de seus caninos superiores e inferiores. Entretanto, machos do sul apresentaram caninos superiores mais compridos que os machos do norte. Os caninos inferiores desses animais, assim como os das fêmeas, não apresentaram nenhuma alteração significativa (SÁ et al., 1993). Os pré-molares estão situados entre os caninos e os molares, apresentando variável número de cúspides. Os molares possuem entre três e cinco cúspides principais e, junto com os pré-molares, são responsáveis pela trituração (SWINDLER, 2002). O padrão de desenvolvimento do cisalhamento das cúspides dos molares também sofre influência dos hábitos dietéticos. Enquanto espécies folívoras demonstram maior desenvolvimento de cisalhamento, nas frugívoras como Ateles sp. ele ocorre em menor grau (ANTHONY e KAY, 1993). No estudo de Popowics e Fortelius (1997), as faces das extremidades bucais dos dentes de primatas folívoros possuíam pequeno potencial de corte. Os primatas selecionam uma dieta de baixa dureza e possuem uma morfologia oclusal pré-formada, o que significa que sua coroa é totalmente funcional desde a erupção e necessariamente de baixa altitude. O potencial de corte de um dente pode ser mantido apenas com um atrito relativamente alto, o que por sua vez é incompatível com a manutenção de um formato oclusal pré-formado. Sendo assim, a altura da coroa torna-se uma variável fundamental no controle da afiação e, dentes com coroas baixas, podem suportar um atrito relativamente limitado (POPOWICS e FORTELIUS, 1997). 39 Animais heterodontes precisam ter pelo menos duas habilidades para conseguirem se alimentar. A primeira delas consiste na abertura da fonte da comida e, a segunda, em mastigála antes de engoli-la. Na maior parte das vezes, a dentição anterior é usada para perfurar e a posterior para triturar (KINZEY e NORKONK, 1990). Os primatas folívoros selecionam folhas de baixa dureza que não requerem uma alta força de oclusão para serem partidas. Assim como os animais ungulados, os primatas estão limitados a uma alimentação não abrasiva que pode ser processada com uma baixa força de oclusão, ou a alimentos com alta energia que possibilitem a ingestão de pequenas quantidades. A habilidade de utilizar as mãos no ato da alimentação permitiu que os primatas fossem mais seletivos em sua dieta quando comparados à maior parte dos herbívoros. Portanto, primatas folívoros devem consumir poucas plantas duras para que possam minimizar o desgaste causado pelo atrito na superfície oclusiva dos dentes (POPOWICS e FORTELIUS, 1997). De acordo com Henderson (2007), existe uma grande variação na sequência da erupção dentária em platirrinos, com algumas espécies apresentando a erupção dos molares precocemente e outras tardiamente. Em seu estudo, 73 animais das espécies A. belzebuth, Ateles fusciceps, A. geoffroyi e A. paniscus foram avaliados. Todos os espécimes apresentaram similaridade em sua erupção dentária, portanto foram incluídos em um só grupo. Em 15 animais, os incisivos erupcionaram antes do primeiro molar e, em 13 deles, antes do segundo molar. Todos os animais tiveram o segundo pré-molar erupcionando antes do segundo molar. Os caninos precederam o terceiro molar na erupção em 16 dos 18 animais avaliados. Uma metodologia para a classificação dos animais do gênero Alouatta por faixa etária, utilizando a erupção dentária como critério, foi elaborada por Ravosa e Ross (1994). Nessa metodologia, os sincrânios foram divididos em cinco estágios etários, onde: 1, apenas a dentição decídua erupcionada; 2, permanente I1, I2 e M1 erupcionados; 3, M2 permanente. Bowen e Koch (1970), em seu trabalho sobre a determinação da idade por meio da dentição em primatas da espécie Macaca irus, afirmaram que a consistência física da dieta pode influenciar a erupção dentária, o que torna questionável a utilização de dados coletados de animais nascidos em cativeiro. Dependendo da espécie animal estudada e o conhecimento sobre suas características específicas, podem-se utilizar outros meios para que a idade seja então estimada. Segundo Winkler (1991), a natureza espécie-específica da dieta, o crescimento crânio-facial, e os padrões diferentes de erupção dentária fazem com que a comparação entre táxons tenha um valor limitado. Azarias et al. (2006), em seu estudo sobre a morfologia dos dentes do bicho-preguiça-de-coleira (Bradypus torquatus), classificou os 40 animais em jovens e adultos de acordo com a variação fenotípica da pelagem que esta espécie apresenta. 2.3.5 Dentição dos Primatas da Família Atelidae A fórmula dentária de A. paniscus é composta por 36 dentes, sendo dois incisivos superiores e dois inferiores; um dente canino superior e um inferior; três dentes pré-molares superiores e três inferiores; três dentes molares superiores e três inferiores (di2 – dc1 – dp3– dm3 / di2 – dc1 – dp3– dm3) (Bateson, 1894). De acordo com Colyer (1919), o gênero Ateles apresenta uma grande variação de posicionamento dos dentes. Apesar da proximidade filogenética, ocorre uma clara diferenciação dos incisivos de espécies de primatas folívoras e frugívoras. Táxons folívoros como Alouatta e Brachyteles possuem incisivos estreitos, enquanto nos frugívoros Ateles e Lagothrix esses mesmos dentes são relativamente mais largos (HYLANDER, 1975; ANTHONY e KAY, 1993). Segundo Miles e Grigson (2003), os molares de Ateles sp. apresentam quatro cúspides, com exceção do terceiro molar, que possui cinco. O padrão de desenvolvimento do cisalhamento das cúspides dos molares também sofre influência dos hábitos alimentares. Enquanto espécies folívoras demonstram maior desenvolvimento de cisalhamento, nas frugívoras como Ateles ele ocorre em menor grau (ANTHONY e KAY, 1993). Em 1990, Kinzey e Norkonk realizaram um estudo no Suriname sobre a dureza como base na escolha de frutas por C. satanas e A. paniscus. Pode-se então perceber que os molares de A. paniscus têm elevações mais altas que os de C. satanas e seus caninos não são tão lateralmente divergentes ou robustos. 2.4 Avaliação Odontológica A avaliação odontológica é muitas vezes negligenciada, principalmente pelo risco na manipulação da boca e suas estruturas (PACHALY, 2006; GIOSO et al., 2008). Diversos 41 fatores contribuem para o diagnóstico tardio das alterações odontológicas dos animais selvagens, incluindo a alta periculosidade, o variado número de espécies e a presença de recintos amplos e coletivos (FECCHIO et al., 2009). Entretanto, esses problemas podem ser minimizados treinando adequadamente a equipe de biólogos, tratadores e os demais profissionais que mantêm contato com os animais, para que eles sejam capazes de identificar possíveis sinais sugestivos de enfermidades odontológicas com precocidade (PACHALY, 2006). De forma geral, a detecção das lesões orais dos animais selvagens só é feita a partir da manifestação dos seus sinais físicos (WIGGS e BLOOM, 2003; FECCHIO et al., 2009). Mesmo à distância, alterações como sialorréia, fraturas dentárias, secreção oronasal, maloclusão, crescimento dentário excessivo e tumefações na cabeça podem ser observadas (WIGGS e HALL, 2003; WIGGS e BLOOM, 2003; PACHALY, 2006; FECCHIO et al., 2009). Equipamentos auxiliares como lunetas, binóculos ou câmeras digitais com aproximação de imagens podem melhorar a inspeção nesses casos (PACHALY, 2006; FECCHIO et al., 2009). Algumas alterações físicas e comportamentais são fortes indicativos de distúrbios na cavidade oral. Os animais selvagens podem mudar sua forma de comer ou beber, manifestar reações agudas à ingestão de água fria, dar preferência aos alimentos macios, escavar o solo, friccionar os membros contra a face, balançar a cabeça ou comprimi-la contra obstáculos e, em alguns casos, apresentar comportamento agressivo atípico. Como consequência dessas lesões, sinais clínicos como anorexia, perda de peso e sialorréia podem estar presentes (PACHALY, 2006). Os tratadores dos animais quase sempre são os primeiros a observarem as alterações comportamentais resultantes de lesões da cavidade oral (WIGGS e HALL, 2003; WIGGS e BLOOM, 2003; FECCHIO et al., 2009). Esses profissionais lidam diariamente com os animais mantidos em cativeiro e conhecem até mesmo particularidades individuais. Eles devem ser treinados de forma que, ao identificarem esses sinais, possam relatá-los ao médico veterinário (FECCHIO et al., 2009). Uma vez realizada uma observação à distância, torna-se possível estudar com precocidade o melhor tratamento a ser instituído (PACHALY, 2006). Segundo Wiggs e Bloom (2003), as possibilidades de tratamento diminuem em animais que não são rotineiramente observados ou que não passam por avaliações clínicas anuais. A avaliação odontológica deve ser precedida por anamnese e exame físico geral do paciente, devendo a cavidade oral ser examinada ao final. A anamnese específica é feita após a realizada rotineiramente pelo médico veterinário e informações como tipo de alimentação 42 fornecida, hábito de mordiscar objetos duros, higienização bucal, tratamentos realizados previamente, comportamentos anormais, sangramento e halitose são de grande importância na investigação (GIOSO, 2003). Após a contenção física e farmacológica, devem-se registrar todas as alterações em uma ficha clínica apropriada (WIGGS e BLOOM, 2003; PACHALY, 2006). De acordo com Wiggs e Bloom (2003), os odontogramas das espécies domésticas podem ser adaptados para o uso em animais selvagens ou, caso as diferenças anatômicas sejam grandes, um novo odontograma deve ser confeccionado. Grande parte dos procedimentos odontológicos em animais domésticos de pequeno porte requer a contenção física por meio de anestesia geral, portanto o exame físico completo deve ser realizado, principalmente visando órgãos sensíveis à anestesia (GIOSO, 2003). Segundo Rossi Jr. (2006), a utilização de uma metodologia de trabalho durante a contenção física ou farmacológica de um animal selvagem evita manipulações desnecessárias ou demora na tomada de decisões. Após a contenção farmacológica, deve-se realizar a inspeção da cavidade oral (WIGGS e BLOOM, 2003; PACHALY, 2006). O planejamento do tratamento pode então ser feito com base nas anotações das alterações encontradas, que devem ser registradas em uma ficha clínica apropriada (WIGGS e BLOOM, 2003; GIOSO, 2003; PACHALY, 2006; FECCHIO et al., 2009). É de extrema importância o uso de equipamentos individuais de proteção ao realizar o manejo de qualquer espécie animal, com o intuito de prevenir zoonoses (FECCHIO et al., 2009). O exame da cavidade oral deve visar tanto os tecidos duros quanto os moles (FECCHIO et al., 2009). De acordo com Gioso (2003), o órgão dentário deve ser examinado com o uso de um explorador e uma sonda periodontal. Inicialmente, deve-se observar assimetria crânio-facial, aumentos de volume, ptialismo e oclusão dos dentes incisivos. Podese então avaliar a coloração e higidez das mucosas, lábios e gengiva. Os dentes devem ser examinados na busca de alterações oclusivas, fraturas, descoloração, presença de placa bacteriana ou cálculo dentário, mobilidade, cárie, lesões reabsortivas e defeitos em seu desenvolvimento (FECCHIO et al., 2009). Com base nos achados clínicos, pode-se então fazer uso de exames complementares como a radiografia intra-oral, extra-oral e a biópsia (WIGGS e HALL, 2003; GIOSO, 2003). O clínico deve estar apto a discernir o caráter primário ou secundário da lesão oral e, nesses casos, exames laboratoriais como hemograma, bioquímica sérica e sorologia são fundamentais (GIOSO, 2003). 43 2.5 Principais Lesões Odontológicas dos Primatas Neotropicais As alterações odontológicas ocorrem como resposta ao desenvolvimento anormal dos tecidos, displasia ou influências ambientais. As anormalidades de desenvolvimento incluem irregularidades no número, tamanho, forma, estrutura, posição e erupção dos dentes. Outras anomalias, que não estão relacionadas com esse processo, geralmente incluem a descoloração ou lesão direta a estrutura do dente, afetando tanto os decíduos quanto os permanentes (AMAND e TINKELMAN, 1985). As principais afecções odontoestomatológicas dos primatas neotropicais incluem exposições pulpares traumáticas, enfermidades periodontais e cáries, porém alterações sistêmicas como a osteodistrofia fibrosa e a herpesvirose também são comuns (PACHALY, 2006). De acordo com Johnson-Delaney (2008), as afecções orais mais comuns dos primatas são similares as encontradas na clínica de pequenos animais como o cálculo, gengivite, fraturas, cáries, doença periodontal, abscessos e osteomielite. A osteodistrofia fibrosa é causada por desequilíbrios minerais com origem em deficiências dietéticas e erros de manejo. O periodonto é o primeiro local a apresentar reabsorção óssea e posterior substituição por tecido fibroso (PACHALY, 2006). As alterações nas coroas, raízes e no número de dentes têm sido relatadas em muitas espécies. Fatores congênitos, hereditários e de desenvolvimento podem estar relacionados a essas anormalidades. Além disso, fatores ambientais, nutricionais, inflamatórios, traumáticos, infecciosos e aqueles relacionados à textura e ao estresse podem causar variações entre os animais de vida-livre e cativeiro (WIGGS e BLOOM, 2003). 2.5.1 Anomalias Dentárias de Número Algumas espécies de mamíferos apresentam variações frequentes do número típico de dentes, enquanto em outras essas diferenças raramente ocorrem. A razão pela qual isso acontece é desconhecida (HALL, 1940). 44 A erupção dentária é o processo através do qual o dente deixa o seu local de desenvolvimento até sua posição funcional na boca (MILES e GRIGSON, 2003). A erupção dos dentes decíduos e permanentes segue uma ordem e uma cronologia. A falha na erupção dentária pode ser uma consequência de outras anomalias ou se tratar de uma real agenesia (AMAND e TINKELMAN, 1985; MILES e GRIGSON, 2003). Segundo Miles e Grigson (2003), essas falhas podem surgir por fatores mecânicos, odontomas e cistos foliculares generalizados. Essas alterações já foram descritas por Amand e Tinkelman (1985) em ursos, mandris e felinos. A impactação pode ser consequência de obstruções à emergência, falta de espaço no arco dentário ou perda de dentes decíduos por trauma, gerando mudanças de posicionamento nos dentes adjacentes. A permanência de dentes decíduos pode ocasionar impactação do dente definitivo ou fazer com que ele erupcione na face bucal (MILES e GRIGSON, 2003). Em primatas, a permanência de dentes decíduos ocorre principalmente por alterações de posicionamento, que são mais comuns em animais de cativeiro do que nos de vida livre. Nesses animais, alterações odontológicas como hipoplasia de esmalte, malformações de elementos dentários e ausência dentária antes da morte podem ocorrer secundariamente à permanência da dentição decídua (MILES e GRIGSON, 2003). Animais senis frequentemente apresentam a falta de alguns elementos dentários. A perda antes de morte pode ser diferenciada da ocorrida após a morte por meio da observação do remodelamento do alvéolo dentário (ELBROCH, 2006). Segundo Miles e Grigson (2003), dentes supranumerários parecem surgir como alterações espontâneas de desenvolvimento, com exceção de alguns casos onde são conhecidas as relações de parentesco entre os animais ou onde a variação entre determinadas populações foram quantificadas. A permanência de dentes decíduos ocorre com frequência em cães e é considerada rara em gatos. Essa alteração pode trazer prejuízos como o maior acúmulo de placa bacteriana, já que o dente definitivo ocupará o mesmo alvéolo (GIOSO, 2003). Os dentes supranumerários podem ser divididos morfologicamente em três categorias. A primeira delas consiste em dentes suplementares com morfologia de coroa e raiz semelhante àqueles das séries normais, porém nem sempre do mesmo tamanho. Eles podem ser tão parecidos nesse aspecto que se torna quase impossível identificar o elemento supranumerário. Dentes haplodontes têm coroas simples e geralmente cônicas, assim como raiz única. Dentes supranumerários tuberculados apresentam coroas mais complexas, com 45 superfície oclusiva suportando vários tubérculos, geralmente com indentações profundas (MILES e GRIGSON, 2003). A existência de dentes supranumerários não é tão rara se comparada à agenesia em humanos. Normalmente essa condição envolve os incisivos superiores e, menos comumente, caninos, pré-molares e molares (HILLSON, 1996). Existem duas teorias para o aparecimento de dentes fusionados, entretanto há poucas evidências que determinem sua etiologia (MILES e GRIGSON, 2003). Shaw (1927) relatou a presença de quatro casos de quarto molar supranumerário em babuínos africanos. Em todos os casos, os dentes apresentavam quatro cúspides, variando apenas no número de raízes e grau de esfoliação. A etiologia desta alteração foi por ele descrita como resultado de influências hereditárias, do prolongamento alveolar e de uma nova tendência da lâmina dentária acomodar um número de dentes maior que o normal. Segundo Degusta et al. (2003), a correlação existente entre molares reduzidos e diminuição do escore corporal demonstrou que o tamanho do dente está sob seleção fenotípica. Esses autores também relatam que outros fatores além da seleção natural podem influenciar no tamanho dos molares, como o estado nutricional materno, já que a coroa do primeiro molar superior se forma logo após o nascimento. 2.5.2 Anomalias Oclusivas Entende-se por oclusão o contato entre os dentes, ou seja, a forma que esses elementos se encaixam em posições características da mandíbula. Poucos indivíduos humanos alcançam a oclusão normal, ou seja, o estado de máximo contato oclusal. É relativamente comum a presença das mesmas anormalidades de oclusão em primatas neotropicais (HILLSON, 1996). Segundo Miles e Grigson (2003), existe uma ampla variedade de tipos de maloclusão, como dentes isolados que se encontram fora do seu posicionamento normal, defeitos de desenvolvimento e crescimento da mandíbula ou maxila (especialmente se o grau de acometimento de uma delas é maior que o outro). A maloclusão pode ser causada pelo desgaste dos dentes, assim como por irregularidades em seu formato, tamanho e posição. A maior parte dessas alterações em pequenos animais tem cunho hereditário (HILLSON, 1996). Segundo Miles e Grigson (2003), 46 a maior parte das maloclusões são produtos de alterações do crescimento da maxila. Amand e Tinkelman (1985) relataram que cerca de 5-12% dos mamíferos selvagens apresentam maloclusão, podendo este valor chegar a 40% nos primatas. A oclusão normal deve ser conhecida com a finalidade de garantir o entendimento dos desajustes relacionados à oclusão (GIOSO, 2003). Algumas alterações de posicionamento dos dentes podem levar à maloclusão, como apinhamento dentário, diastema, giroversão e transposição (HILLSON, 1996). Segundo Miles e Grigson (2003), em primatas é comum haver deslocamento e rotação dos incisivos superiores e pré-molares, assim como transposição e deslocamento de caninos. A etiologia da maloclusão pode estar relacionada a fatores ambientais, nutricionais, textura da dieta, trauma, estresse e doença periodontal. Esta alteração ocorre mais frequentemente em animais de cativeiro do que nos de vida livre (WIGGS e BLOOM, 2003). Rossi Jr. (2007) relata a prevalência de maloclusão em 12% de sincrânios de onça-pintada (Panthera onca) e em 7% de sincrânios de suçuarana (Puma concolor) de vida livre. A maloclusão é descrita em diversas espécies animais. Em cães domésticos, acreditase que tenha por principal etiologia o acasalamento consanguíneo, que diminui o tamanho do crânio, mas não o dos dentes (GIOSO, 1998). Em guepardos (Acinonyx jubatus), alterações causadas por anormalidades de tamanho e posicionamento dos primeiros molares inferiores foram tidas como as principais causas de erosão focal palatina (FITCH e FAGAN, 1982). As alterações oclusivas também foram descritas em suçuaranas (Puma concolor) por Rossi Jr. et al. (2007b), que relatou que o acúmulo de alimentos ou indutos moles na região dos dentes com espaço interproximal reduzido pode levar também à doença periodontal. Em roedores a maloclusão é a alteração odontológica mais comum, ocorrendo tanto pelo crescimento anormal dos incisivos em espécies de hábitos roedores, quanto crescimento excessivo dos molares e pré-molares no grupo dos herbívoros (LEGENDRE, 2003). Esta alteração também foi observada em sincrânios de zebras (Equus zebra zebra) (PENZHORN, 1984). 2.5.3 Alterações Amelo-Cementárias A hipoplasia ou hipocalcificação do esmalte pode ocorrer por vários fatores que alteram a gênese deste elemento. Esta anomalia pode se manifestar em diferentes graus de 47 severidade, ou seja, desde pequenas porosidades à perda total da cobertura de esmalte (AMAND e TINKELMAN, 1985; HILLSON, 1996). Segundo Hillson (1996), esta é a alteração de esmalte mais comumente observada, sendo facilmente confundida com cárie ou cálculo dentário (GIOSO, 2003). Geralmente o grau de hipoplasia em animais selvagens é pequeno e ocorre menos frequentemente em animais de vida-livre quando comparados aos mantidos em cativeiro. Normalmente esta alteração está associada às anormalidades ósseas e calcificação deficiente. (AMAND e TINKELMAN, 1985). As mudanças na coloração dos dentes podem ocorrer como resultado da hipoplasia de qualquer tecido dentário calcificado. A descoloração pode levar ao depósito de um biofilme, pigmento ou cálculo na superfície do esmalte, dentina exposta ou cemento (AMAND e TINKELMAN, 1985). As alterações de pigmentação em cães e gatos têm por principal etiologia o uso de tetraciclinas e seus derivados (GIOSO, 2003). As coroas dentárias dos dentes de diversos animais adultos de diferentes espécies animais podem estar recobertas por uma quantidade variável de depósitos negros extremamente aderidos. Em certos casos, apenas a face desgastada das superfícies oclusivas está livre deste material. Este pigmento está presente não apenas em animais ungulados que apresentam o esmalte da coroa recoberto por uma fina camada de cemento, como também em primatas e insetívoros. A origem deste pigmento é incerta, porém acredita-se que consista de finas camadas de placas mineralizadas com pigmentos incorporados (MILES e GRIGSON, 2003). 2.5.4 Doença Periodontal A doença periodontal acomete as estruturas que dão suporte ao dente e tem início com a formação da placa bacteriana (GIOSO, 2003; MILES e GRIGSON, 2003). Fatores como o baixo índice de higiene, dietas macias e ricas em carboidratos e algumas anomalias dentárias (apinhamento e maloclusão) são importantes na patogenia da periodontite (HILLSON, 1996). Esta alteração é mais frequente em animais de cativeiro, quando comparados aos de vida-livre (WIGGS e LOBPPRISE, 1997; WIGGS e BLOOM, 2003). 48 Segundo o American Veterinary Dental College (AVDC), a doença periodontal é classificada de acordo com a sua gravidade: - Normal (0): clinicamente normal. Ausência de inflamação gengival ou periodontite evidente. - Estágio 1: presença de gengivite sem perda de inserção periodontal. - Estágio 2: presença de periodontite inicial, caracterizada pela perda de menos de 25% da inserção periodontal e pela exposição de furca grau 1. - Estágio 3: presença de periodontite moderada, caracterizada pela perda de 25 a 50% da inserção periodontal e pela exposição de furca grau 2. - Estágio 4: presença de periodontite grave com perda de mais de 50% da inserção periodontal e exposição de furca grau 3. Segundo Lopes (2008), a perda da inserção periodontal pode ser avaliada tanto pela sondagem periodontal quanto pelo exame radiográfico, medindo-se a distância da margem alveolar à junção amelo-cementária em relação à raiz. Os primatas são frequentemente usados como modelos no estudo da doença periodontal. Em muitas espécies, a gengivite e a doença periodontal puderam ser induzidas por dietas contendo uma grande proporção de carboidratos fermentáveis como a sacarose (MILES e GRIGSON, 2003). De acordo com Wiggs e Lobprise (1997), a doença periodontal e a cárie são descritas em primatas mantidos em cativeiro e alimentados com uma dieta de carboidratos purificados ou refinados de consistência macia, em contraste com os alimentos fibrosos naturais ingeridos pelos animais de vida livre. Hungerford et al. (1999) acreditam que os altos índices de alterações odontológicas em diversas espécies animais estejam associados às dietas oferecidas por humanos. Os microorganismos da placa alojam-se por todo o elemento dentário, principalmente no sulco gengival. Para que haja dano é necessário que esta placa sofra uma reorganização de seus constituintes (GIOSO, 2003; MILES e GRIGSON, 2003). Com o acúmulo da placa bacteriana, as bactérias anaeróbias facultativas e estritas, além das GRAM-negativas, produzem através do seu metabolismo subprodutos capazes de lesar o periodonto, causando inicialmente uma gengivite (GIOSO, 2003). Como a gengivite não tem o envolvimento do osso alveolar, ela não pode ser observada na arqueologia (HILLSON, 1996). Wiggs e Lobprise (1997) classificam a placa bacteriana através do índice de placa, que varia do grau 0 ao 3, em ordem crescente de deposição. 49 A manutenção do agente agressor faz com que ocorra o desencadeamento de uma resposta inflamatória. Esta resposta caracteriza-se pela produção de prostaglandinas, estimulação de osteoclastos e ativação de enzimas, gerando uma destruição acelerada das estruturas que dão suporte ao dente. Com a reabsorção óssea e a retração gengival consequentes, esse processo irreversível é denominado periodontite (HILLSON, 1996; GIOSO, 2003). Amand e Tinkelman (1985) descreveram os sinais clínicos da periodontite como halitose, sialorréia, mobilidade dentária, sangramento, placa bacteriana, gengivite, cálculo dentário, exposição de furca, retração gengival e anorexia. A precipitação de sais minerais provenientes da saliva altera os efeitos patogênicos da placa e forma um material mineralizado e de superfície rugosa, chamado cálculo dentário (HILLSON, 1996; GIOSO, 2003; MILES e GRIGSON, 2003). Não há limite para a agregação supragengival contínua e intermitente de cálculo dentário (MILES e GRIGSON, 2003). Segundo Hillson (1996), a presença de cálculo dentário já fora relatada em diversas espécies animais, dentre elas o homem, os demais primatas, cães, gatos, furões, ursos, roedores e grandes ungulados. Em dentes presentes em sincrânios, dois tipos de cálculo podem ser facilmente distinguidos, principalmente pelo seu perfil. O cálculo supragengival tem coloração brancoamarelada, enquanto o subgengival é menos volumoso e tende a se manifestar como um anel de coloração preta ao redor do dente, pela presença de sangue (MILES e GRIGSON, 2003). A formação de bolsa periodontal ocorre conforme o osso é reabsorvido, fazendo com que haja a perda do nível clínico de inserção, que pode ser detectado com o auxílio de sondas (GIOSO, 2003). Com o avançar da lesão, o dente torna-se luxado no alvéolo e pode então ser eliminado (HILLSON, 1996; GIOSO, 2003). Os dentes multirradiculares podem ter exposição da região interproximal de suas raízes, denominada furca, expostas devido à reabsorção do osso alveolar que ocorre como consequência da doença periodontal. O grau de envolvimento dessa região influencia na escolha do tratamento a ser realizado, como exodontia ou cirurgia periodontal (WIGGS e LOBPRISE, 1997). Segundo Gioso (2003), quase todos os cães acima de quatro anos apresentam algum grau de doença periodontal em um ou mais dentes. Pachaly (2006) relata que as enfermidades periodontais são comuns em primatas sul-americanos mantidos em cativeiro e a forma localizada da enfermidade periodontal pode ser observada em todas as espécies de primatas, porém a generalizada é mais comum em macacos-aranha (Ateles spp.). 50 A mobilidade dentária é utilizada como método para avaliar o comprometimento do suporte periodontal do dente (LOPES, 2008). De acordo com Fedi e Lawrence (1995), o diagnóstico dessa alteração é difícil, pois durante o dia é normal haver uma variação decorrente da dieta e de estresse. A deiscência e a fenestração podem ocorrer principalmente na face vestibular do osso alveolar, embora também possam estar presentes nas faces linguais e palatinas. A fenestração corresponde a uma lesão circunscrita no osso, com exposição da raiz e a permanência da crista óssea alveolar intacta. Quando as áreas de reabsorção óssea estendem-se até a margem da crista alveolar, recebem o nome de deiscência (NEWMAN et al., 2002). Em um estudo realizado com gorilas, a deiscência e fenestração ósseas alveolares foram observadas em dentes de animais jovens, associadas ao processo de erupção e esfoliação dentária (KEKAHASHI et al., 1963). Segundo Wiggs e Hall (2003), abscessos dentários podem surgir de forma intermitente como resultado de dentes decíduos parcialmente reabsorvidos ou dentes fraturados. Em um estudo realizado por Kakehashi et al. (1963), a doença periodontal foi avaliada em 292 crânios de gorilas, sendo relatadas 468 lesões de fenestração na maxila e 13 na mandíbula, em todas as faixas etárias examinadas. A deiscência foi encontrada em 101 locais da maxila e 55 na mandíbula de animais adultos. Esses autores descartaram uma das etiologias propostas para esse tipo de lesão em humanos, que se refere ao desalinhamento dentário. Entretanto, a alta prevalência de defeitos ósseos na maxila, sugere que as diferenças anatômicas quanto à densidade e espessura óssea entre maxila e mandíbula, além da força oclusal exercida sobre os dentes pré-molares e molares podem ser os principais fatores envolvidos na espécie. Skinner e Newell (2003), também observaram os mesmos defeitos ósseos em primatas, entretanto as lesões de fenestração mais extensas foram observadas em caninos com as maiores cúspides. 2.5.5 Cárie As cáries caracterizam-se por processos de desmineralização do esmalte e da dentina e são comuns principalmente em primatas idosos (PACHALY, 2006). As cáries, alterações 51 causadas por bactérias e seus subprodutos, também envolver o cemento e penetrar a câmara pulpar (GIOSO, 2003). De acordo com Hillson (1996), essas lesões podem ter início tanto na coroa quanto na raiz do dente. Lopes (2008) relata que essa alteração é resultado de um processo multifatorial, ocorrendo na presença de fatores concomitantes como pH oral, dieta cariogênica, defeitos na anatomia dentária (fóssulas, fissuras e outros defeitos estruturais), além da presença de microorganismos cariogênicos. As cáries do esmalte e cemento ocorrem por um processo totalmente diferente do que é observado na dentina. Os túbulos dentinários são colonizados por bactérias produtoras de ácidos, que desmineralizam a dentina e deixam a matriz orgânica praticamente intacta (HILLSON, 1996). O pH tem importante papel na formação das cáries, já que em meios ácidos o potencial cariogênico aumenta. Para que a cárie ocorra, é necessária a presença concomitante de placa bacteriana organizada, pH oral abaixo de 5,5 (geralmente observado durante e após a alimentação) e desequilíbrio imunológico (GIOSO, 2003). Essas lesões inicialmente apresentam-se como pequenas manchas de coloração marrom-escura ou preta na superfície do esmalte (LOPES, 2008) ou, em casos mais avançados, podem penetrar a câmara pulpar e levar a perda dentária (HILLSON, 1996). Segundo Pachaly (2006), os dentes molares e pré-molares são os mais acometidos em função de suas características anatômicas. Miles e Grigson (2003) acreditam que molares e prémolares superiores são mais acometidos que seus correspondentes inferiores. Apesar da baixa incidência de cárie em carnívoros quando comparada aos primatas e herbívoros (MILES e GRIGSON, 2003), quando presente em cães, ela manifesta-se principalmente nas superfícies planas dos dentes molares (LOPES, 2008). Segundo Pachaly (2006), a incidência de cáries em primatas está diretamente relacionada com dietas inadequadas ricas em açúcares simples. A ocorrência de cáries em outros primatas não é tão comum quanto nos humanos, porém alterações na dieta, principalmente em animais senis, aumentam sua incidência (LOPES, 2008). Em primatas de idade avançada é relativamente frequente a ocorrência de cáries em superfícies radiculares em conjunto com desgaste dentário. Acredita-se que isto ocorra quando o desgaste do esmalte oclusal enfraqueça o esmalte interproximal, facilitando o acúmulo de debris alimentares e expondo a dentina a bactérias cariogênicas (MILES e GRIGSON, 2003). Segundo Hillson (1996), a incidência de cárie nos homens é 52 significativamente menor em áreas cuja água é tratada com flúor, pela incorporação dos íons fluoreto no esmalte, dentina e cemento durante a formação do dente. Em lesões recentes, o diagnóstico da cárie de esmalte é muito difícil. Os pontos claros e opacos podem ser facilmente confundidos com defeitos de desenvolvimento e essas lesões podem passar despercebidas até mesmo em fósseis. O uso de microscópio polarizado em finas e polidas secções de esmalte pode diagnosticar cáries logo no começo, evidenciando o aumento gradual das porosidades pela solubilização progressiva dos minerais (HILLSON, 1996). A histologia das lesões suspeitas é muito importante em fósseis, já que os pontos esbranquiçados e cavidades atribuídas às cáries podem ser resultados de agressões ocorridas após a morte. Além disso, lesões histologicamente compatíveis com esta alteração podem não ser o que parecem (HILLSON, 1996). 2.5.6 Desgaste O desgaste dentário ocorre fisiologicamente em muitas espécies animais, inclusive no homem. Essa alteração é uma importante ferramenta na estimativa da idade de um indivíduo. Entretanto, quando ocorre de forma acentuada, pode dificultar a ingestão de alimentos ou interferir em qualquer outra função da cavidade oral (WIGGS e BLOOM, 2003). Uma vez formado, o esmalte não pode ser remodelado. Portanto, caso haja alguma anormalidade durante esse período, ela estará presente durante toda a vida. As alterações do esmalte podem se manifestar de forma variada e suas causas podem ser hereditárias ou estarem relacionadas às complicações durante o crescimento (HILLSON, 1996). A coroa dos dentes é uma importante ferramenta para a descoberta da idade de um sincrânio, se desgastando à medida que um animal vive e se alimenta (ELBROCH, 2006). Segundo Martins et al. (2003), estudos comparativos com primatas e outros mamíferos sugerem que a microestrutura e espessura do esmalte têm um importante papel nas adaptações dietéticas. De acordo com Gioso (2003), o desgaste é frequente em animais de pequeno porte que mastigam objetos ou alimentos muito duros, ou que apresentam dermatopatias pruriginosas crônicas. 53 A superfície do esmalte é gasta pelo contato durante a oclusão até alcançar faces planas. A esse processo é dado o nome de atrito (POPOWICS e FORTELIUS, 1997). Reiter e Mendonza (2002) definem o atrito como a perda natural ou excessiva de substância dentária, consequente do contato de dentes antagonistas durante o processo mastigatório, ou por maloclusão. Esses mesmos autores conceituam a abrasão como um processo mecânico que não é causado pelos dentes, mas sim pela roedura de objetos. Segundo Lopes (2008), a “Síndrome do Mordedor de Grades” induz ao desgaste dentário acentuado das cúspides ou bordas incisais de incisivos ou caninos, além da face distal dos caninos. Essa alteração também foi relatada por Rossi Jr. (2002) em seu estudo com onças-pintadas (Panthera onca) e suçuaranas (Puma concolor) mantidas em cativeiro. Wiggs e Bloom (2003) recomendam mudanças nos recintos desses animais para reduzir o estresse e o tédio, na tentativa de corrigir e prevenir a progressão desse hábito. Com o desgaste excessivo do esmalte e da dentina, a polpa pode ser exposta, induzindo a formação de um abscesso periapical. Clinicamente, podem-se observar manchas escuras na superfície incisal dos dentes desgastados, que ocorrem devido à transparência da dentina terciária ou da exposição do canal pulpar. Os processos crônicos de desgaste podem induzir a formação de dentina reparadora ou terciária (GIOSO, 2003). 2.5.7 Trauma As alterações traumáticas da mandíbula e dos dentes podem ser observadas em quase todos os mamíferos e são achados comuns também em fósseis (HILLSON, 1996). As lesões orais geralmente ocorrem durante brincadeiras e autoagressões decorrentes de episódios de pânico ou ansiedade, normalmente associados à tentativa de fuga (ROSSI JR., 2002; WIGGS e BLOOM, 2003; LOPES, 2008). Essas alterações podem gerar consequências graves para o animal, como a anorexia em animais de vida livre (MILES e GRIGSON, 2003). As fraturas de esmalte e de coroa não complicada não têm grande importância clínica em pequenos animais. A dentina exposta fica sensível até que ocorra esclerose dos túbulos dentinários e formação de dentina terciária. Entretanto, fraturas complicadas com exposição da câmara pulpar levam à doença endodôntica (VERSTRAETE et al., 1996a). 54 As fraturas e o desgaste dentário são descritos em diversas espécies de carnívoros mantidos em cativeiro, normalmente acometendo incisivos, caninos e dentes carniceiros (WIGGS e BLOOM, 2003). As fraturas podem ser assintomáticas e não comprometerem a polpa, porém a etiologia mais comum de lesões pulpares é o traumatismo. O traumatismo pode resultar em fratura do esmalte ou dentina com ou sem exposição da polpa ou, em casos mais brandos e sem fraturas, gerar apenas uma concussão (GIOSO, 2003). Segundo Lopes (2008), existem diversas classificações utilizadas na odontologia veterinária e humana para fraturas dentárias, como a proposta por Basrani (1983) e ilustrada por ela na figura 4: Figura 4 – Classificação de fratura dentária adotada pelo AVDC, adaptada de Basrani (1983) e ilustrada por Lopes (2008): fratura incompleta de esmalte (A), fratura de esmalte (B), fratura de coroa não complicada (C), fratura de coroa complicada (D), fratura corono-radicular nãocomplicada (E), fratura corono-radicular complicada (F), fratura radicular (G). A exposição pulpar traumática ocorre em função de fraturas acidentais ou criminosas e geralmente acometem os caninos (PACHALY, 2006). A polpa exposta sofre contaminação bacteriana, levando à necrose pulpar e à ocorrência de abscessos dento-alveolares (HILLSON, 1996; PACHALY, 2006). Algumas fraturas de esmalte e dentina podem se tornar contaminadas, mesmo sem haver a exposição pulpar. Isso se deve ao fato de que os túbulos odontoblásticos expostos podem atuar como porta de entrada de microorganismos exógenos (HILLSON, 1996; GIOSO, 2003). 55 Segundo Gioso (2003), mesmo sem haver fratura ou exposição pulpar, pequenos vasos sanguíneos podem ser rompidos. Esse evento leva à inflamação e à formação de edema, resultando em necrose asséptica. A necrose pulpar faz com que o dente adquira uma coloração escurecida, resultado da penetração de substâncias de degradação sanguínea através dos túbulos dentinários. As fraturas de raízes podem induzir à formação de fístula, principalmente quando há lesão periodontal ou periapical concomitante. Em casos mais raros, a raiz pode ser reabsorvida ou eliminada (GIOSO, 2003). As fístulas sinusais são comuns na maxila, se manifestando externamente na forma das chamadas fístulas infraorbitárias. Na mandíbula, a infecção pode levar às fístulas mandibulares. A manutenção de um processo infeccioso na região periapical causa bacteremia crônica, podendo resultar em alterações sistêmicas (PACHALY, 2006). As lesões das lâminas ósseas que separam o alvéolo e a cavidade nasal levam às comunicações entre essas estruturas, o que pode ser facilmente identificado por meio de sinais clínicos como secreção nasal serosa e espirros frequentes. Na clínica de pequenos animais, essas alterações quase sempre são iatrogênicas e apresentam maior incidência em caninos superiores (GIOSO, 2003). 2.5.8 Outras Alterações em Ossos do Sincrânio As fraturas em sincrânios são consideradas comuns em animais de vida livre, embora sua prevalência ainda seja desconhecida, já que se baseia quase que exclusivamente em casos nos quais os animais sobreviveram e seus sincrânios puderam então ser avaliados (MILES e GRIGSON, 2003). De acordo com Hosey (2005), estudos recentes indicam que a superpopulação em recintos de primatas mantidos em cativeiro resulte em taxas elevadas de agressão entre os animais. Fedigan e Baxter (1984), em um estudo sobre as diferenças sexuais de A. geofffroyi de vida livre, observaram que os machos são mais agressivos, interagem fisicamente mais frequentemente e atacam e perseguem principalmente fêmeas adultas. As fraturas anteriores a morte podem ser facilmente identificadas por alterações de posicionamento, formação de calo e remodelamento ósseos (ELBROCH, 2006). Em um estudo sobre alterações ósseas em crânio e mandíbula de Alouatta palliata, realizado por 56 Degusta e Milton (1998), a incidência de fratura de arco zigomático foi consideravelmente maior do lado esquerdo, levantando a hipótese de lateralidade no comportamento de luta nessa espécie. Esses mesmo autores descreveram uma maior prevalência de fraturas nos machos então avaliados. Em pesquisa realizada por Fagot e Vauclair (1991), sobre lateralidade manual em primatas não-humanos, observou-se que nas tarefas que exigiam baixas habilidades manuais os animais não demonstraram preferência ao uso de uma das mãos. Entretanto, o comportamento manifestado pelos animais durante tarefas que exigiam grande habilidade manual demonstrou uma distribuição assimétrica entre as mãos utilizadas, que parece estar relacionado a uma especialização cerebral hemisférica contralateral. Existem relatos de graves fraturas em diferentes espécies animais. Um urso-negro (Ursus americanus) apresentou uma perda considerável da região posterior do corpo e do ramo ascendente da mandíbula, aparentemente causadas por um projétil. A proliferação óssea na margem da fratura sugere que ele não tenha morrido logo após o incidente (DYER, 1981). Erb et al. (1996) também descreveram alterações odontológicas consequentes de uma fratura de mandíbula em sincrânio de uma espécie de foca (Arctocephalus gazella) encontrada na natureza. Esse animal apresentava disjunção de sínfise mandibular e perda de ambos incisivos mandibulares direitos, com remodelamento ósseo de seus respectivos alvéolos. As alterações ósseas encontradas nesse animal também sugeriram que sua morte ocorrera até um ano depois da lesão. Segundo Verstraete et al. (1996b), gatos asselvajados com injúrias mandibulares podem ter sua autodefesa e ingestão de água e alimentos prejudicadas por fraturas, porém a cura espontânea destes animais foi possível. Segundo Rossi Jr. (2007), onças-pintadas (Panthera onca) e suçuaranas (Puma concolor) de vida livre com graves alterações ósseas mantiveram-se vivas tempo suficiente para que houvesse reparação óssea. Wobeser (1992), em um estudo sobre a prevalência de lesões traumáticas, degenerativas e de desenvolvimento em lobos (Canis lupus) e coiotes (Canis latrans) relatou que a consolidação de fraturas foi observada em dois dos três animais com essa lesão. A ATM pode apresentar distúrbios traumáticos, inflamatórios e de desenvolvimento, neoplasias e síndrome da disfunção dolorosa. As luxações da ATM podem ocorrer isoladamente ou associadas às fraturas de mandíbula, podendo conduzir à hipomotilidade e anquilose (GIOSO, 2003). As anomalias de formação das estruturas do palato em cães e gatos podem ter etiologia hereditária ou surgir como alterações durante o desenvolvimento fetal. A natureza esporádica 57 dessas condições em pequenos animais sugere que a maior parte dos casos seja consequência de lesão intrauterina, ou da utilização de corticóides durante a gestação (GIOSO, 2003) Os defeitos do palato primário (osso incisivo ou pré-maxila) são alterações congênitas que se manifestam clinicamente como lábio leporino. Em alguns casos pode haver associação de anormalidades do palato secundário (palato duro ou mole), com a formação de fendas palatinas. O lábio leporino não traz grandes consequências à saúde do animal, todavia as fendas palatinas podem levá-lo ao óbito (GIOSO, 2003). As fendas palatinas também podem ter origem embriogênica ou serem adquiridas por meio de traumatismos na face. Os sinais clínicos resultantes dessas alterações são secreção nasal, pneumonia e atraso no desenvolvimento de filhotes (GIOSO, 2003). Loffredo et al. (1994) relataram que, em humanos, as principais causas dessa anomalia incluem: o contato da mãe com pesticidas, hereditariedade, epilepsia materna, ingestão de anti-inflamatório e exposição a raio-x nos quatro primeiros meses de gestação. Em primatas de laboratório (Macaca mulatta), a indução de fenda palatina já foi comprovada com o uso de ciclofosfamida (MACCLURE et al., 1979). Existem diversos artigos utilizando primatas como modelos para o estudo do desenvolvimento crânio-facial em humanos (MACCLURE et al., 1979; HENDRICKX et al., 1983; SIEGEL et al., 1985), porém escassos relatos sobre a prevalência de lábio leporino e fenda palatina em animais selvagens. De acordo com Kraus e Garrettt (1968), é provável que as fendas palatinas em primatas não-humanos não sejam tão incomuns quanto se imaginava, com a ocorrência em muitas espécies ainda não relatada. 58 OBJETIVOS O objetivo deste trabalho foi avaliar sincrânios de Ateles sp., tanto de vida livre quanto de cativeiro, com o intuito de estabelecer as principais alterações ósseas de sincrânios e afecções dentárias. Para tanto, foram analisados 253 sincrânios armazenados em coleções de mastozoologia do Museu Paraense Emílio Goeldi (MPEG), do Museu Histórico Nacional da Universidade Federal do Rio de Janeiro (MH-UFRJ) e do Museu de Zoologia da Universidade de São Paulo (MZ-USP). 59 4 MATERIAL E MÉTODOS Para a realização do presente estudo foi efetuada a avaliação de 253 sincrânios de Ateles sp., provenientes de vida livre e cativeiro, durante o período de julho de 2009 a abril de 2010. Foram utilizadas para este fim as coleções do Museu Paraense Emílio Goeldi (MPEG), Museu Histórico Nacional da Universidade Federal do Rio de Janeiro (MHN-UFRJ) e do Museu de Zoologia da Universidade de São Paulo (MZ-USP), conforme a Tabela 1. Tabela 1 – Distribuição do número de sincrânios avaliados de acordo com a espécie e coleção de procedência Espécie MPEG i MHN-UFRJ ii MZ-USP iii Ateles belzebuth 46 3 0 Ateles geoffroyi 1 0 0 Ateles marginatus 7 11 29 Ateles paniscus 87 2 1 Ateles variegatus 4 0 0 Ateles chamek 0 34 9 Indefinido iv 11 8 0 TOTAL 156 58 39 i MPEG – Museu Paraense Emílio Goeldi ii MHN-UFRJ – Museu Histórico Nacional da Universidade Federal do Rio de Janeiro iii MZ-USP – Museu de Zoologia da Universidade de São Paulo iv Animais cuja espécie não foi definida A identificação dos sincrânios foi realizada utilizando o mesmo número de tombo de cada museu pesquisado. As etiquetas de identificação foram avaliadas em busca de informações sobre local e data de coleta. Essas informações foram resumidas no Apêndice I. Foram coletadas informações sobre espécie, sexo e habitat de cada sincrânio avaliado, de acordo com a disponibilidade dessas informações nas coleções utilizadas. Devido à falta de informações sobre a idade da maior parte dos sincrânios, a distribuição etária dos espécimes não foi realizada. A identificação dos sincrânios avaliados segundo a espécie, sexo e local de vida estão resumidas no Apêndice II. 60 A avaliação odontológica foi realizada com os sincrânios dispostos em bancada de trabalho sobre base escalonada em centímetros e polegadas, sendo articulados e apoiados em massa de modelar branca, conforme ilustrado na Figura 5. Figura 5 – Vista lateral esquerda de sincrânio de Ateles marginatus (MZ-USP-5288) posicionado para a avaliação odontológica Os sincrânios foram avaliados quanto à presença de assimetria, lesões ósseas e alterações oclusivas. As faces anatômicas dos dentes e do osso alveolar foram examinadas macroscopicamente, por meio de inspeção visual direta, com auxílio de sonda periodontal milimetrada e explorador clínico odontológico. Buscaram-se as seguintes afecções dentárias nos sincrânios: - Anomalia dentária de conformação - Anomalia dentária de número - Alterações amelo-cementárias - Doença periodontal - Apinhamento dentário - Desgaste dentário (grau 0, 1, 2, 3 e 4) - Exposição de furca (grau 1, 2 e 3) - Exposição da câmara pulpar - Fratura dentária (grau 1 e 2) 61 - Giroversão dentária - Reabsorção da crista alveolar - Reabsorção dentária - Outras alterações As anomalias dentárias de conformação incluíram a microdontia e os dentes geminados. As anomalias dentárias de número incluíram: perda dentária ocorrida antes da morte, presença de dentes supranumerários, persistência de dentição decídua e dentição não erupcionada ou agenesia dentária. Assim como Hall (1940), os dentes considerados ausentes foram aqueles que supostamente nunca existiram na dentição permanente. A agenesia dentária não pode ser distinguida da presença de dentição ainda não erupcionada pela ausência de exame radiográfico complementar. A classificação da ausência dentária ocorrida antes e depois da morte foi feita de acordo com a forma e o padrão da margem óssea alveolar. Foram consideradas perdas anteriores à morte aquelas cuja crista óssea alveolar apresentava-se irregular ou arredondada, com alvéolos de menor profundidade e reação periostal exuberante, caracterizada pela presença de grande número de foraminas (VERSTRAETE et al., 1996a). Essa perda foi classificada de acordo com o número de dentes acometidos: - Grau 1: perda de apenas um dente - Grau 2: perda de dois dentes - Grau 3: perda de três dentes - Grau 4: perda de quatro dentes - Grau 5: perda de cinco ou mais dentes A doença periodontal é classificada em estágios de 0 a 4 pelo AVDC, porém a mesma classificação não pode ser utilizada no presente estudo devido à falta de tecidos moles do periodonto em sincrânios e de exame radiográfico complementar. Foi adotada a mesma metodologia de Newman et al. (2002) para a diferenciação entre fenestração e deiscência ósseas alveolares. Essa metodologia classifica como fenestração a lesão circunscrita no osso, com exposição da raiz e a permanência da crista óssea alveolar intacta. Já a deiscência é descrita como áreas de reabsorção óssea que se estendem até a margem da crista alveolar. 62 Seguindo padronização adotada por Davies e Pedersen (1955), modificada por Aguiar et al. (2004), e utilizada por Rossi Jr. (2007), o desgaste dentário foi classificado da seguinte forma: - Nível 0: sem desgaste - Nível 1: desgaste somente de esmalte - Nível 2: formação de dentina terciária - Nível 3: exposição de câmara coronária - Nível 4: desgaste total da coroa até o nível radicular, com separação completa das raízes nos dentes multirradiculados A exposição de furca foi classificada em três estágios, de acordo com a Veterinary Dental Nomenclature, desenvolvida pelo AVDC: - Grau 1: a sonda periodontal penetra na região da furca do dente multirradicular em profundidade inferior à metade da distância até a face contra-lateral do dente, em qualquer direção. - Grau 2: a sonda periodontal penetra mais da metade da profundidade da região de furca, sem atravessar para o outro lado. - Grau 3: a sonda periodontal atravessa a região de furca para o outro lado. As fraturas dentárias foram classificadas em graus, utilizando uma adaptação da classificação adotada por Basrani (1983): - Grau 1: fratura de coroa - Grau 2: fratura de coroa com exposição de câmara pulpar Todas as informações acerca dos sincrânios foram registradas em ficha odontológica (odontograma) específica para primatas, desenvolvida pelo Laboratório de Odontologia Comparada (LOC), vinculado ao Departamento de Cirurgia da Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo (FMVZ-USP) (Anexo A). O odontograma usa como referência o sistema de identificação TRIADAN modificado, que se caracteriza por atribuir a cada dente um número de três dígitos. O primeiro dígito representa o quadrante em que o dente está inserido, de forma que: a série 100 é utilizada para denominar 63 os dentes do hemi-arco maxilar direito; a série 200 para os dentes do hemi-arco maxilar esquerdo; a série 300 para os dentes do hemi-arco mandibular esquerdo; e a 400 para os dentes do hemi-arco mandibular direito. Os elementos dentários individuais são representados pelo segundo e terceiro dígitos tendo por número “01” o primeiro dente da linha mediana que é seguido distalmente, em ordem crescente, ao longo do hemi-arco dentário. Foram realizados registros fotográficos por meio de câmera digital Canon PowerShot SX110 (9.0 mega pixels) de todos os sincrânios avaliados. Para cada espécime foram realizadas 11 projeções fotográficas: dorso-ventral e ventro-dorsal de crânio; lateral direita e esquerda de crânio; dorso-ventral e ventro-dorsal de mandíbula; leteral direita e esquerda de mandíbula; lateral direita e esquerda de sincrânio articulado; rostral do sincrânio articulado (Figura 6). Figura 6 – Vista rostral de sincrânio de Ateles marginatus (MPEG-4073) Além das imagens padronizadas para a avaliação dos sincrânios, outras fotografias foram realizadas, conforme a necessidade de documentação complementar de outras alterações observadas. 64 5 RESULTADOS Foram avaliados um total de 253 sincrânios de machos, fêmeas e animais de sexo indeterminado de seis espécies de Ateles sp., conforme a Figura 7. Número de Animais 61 33 23 22 25 20 14 ad a in In d At el et er m es ge o ze bu be l es At el Fêmea 1 ffr o th ek ch am es At el Macho 3 3 yi 1 ga tu s va rie At el es At el es m ar g pa n es 13 1 3 in at us isc us 6 At el 15 9 Indeterminado Figura 7 – Distribuição sexual dos sincrânios de Ateles sp. avaliados de acordo com a espécie No presente estudo foram avaliados animais de vida livre, cativeiro e de procedência desconhecida, conforme a Figura 8. Número de Animais 81 49 43 43 13 8 1 Ateles paniscus 4 4 Ateles marginatus Ateles variegatus Vida Livre 1 Ateles chamek Cativeiro Ateles belzebuth Ateles geoffroyi 2 4 Indeterminada Indeterminado Figura 8 – Distribuição das espécies de Ateles sp. avaliadas de acordo com o local de vida 65 Os resultados foram divididos em dois tópicos: alterações em sincrânios (que envolviam disparidades de conformação de crânio e mandíbula) e um segundo tópico relacionado às afecções dentárias. Mesmo tratando-se de alterações em sincrânios, a deiscência e a fenestração óssea alveolares foram inclusas no tópico das afecções dentárias, por estarem relacionadas diretamente a elas. 5.1 Alterações em Sincrânios Foram avaliados 253 sincrânios de Ateles sp. quanto à presença de alterações ósseas. Destes animais, 219 eram de vida livre, 20 de cativeiro e 14 de origem desconhecida. Alguns espécimes não puderam ser avaliados quanto à presença de alterações oclusivas e assimetria, por estarem representados apenas pela mandíbula (MHN-UFRJ507/508/11751), por não permitirem sua articulação com o crânio (MHN-UFRJ-21057 e MPEG-21618) ou por apresentarem grande perda dentária (MHN-UFRJ-1657/23727/25717). Sendo assim, o número de animais avaliados quanto à presença de alterações oclusivas e assimetria foi 245. Destes animais, 215 eram de vida livre, 20 de cativeiro e 10 de origem indeterminada. As principais alterações em sincrânios pesquisadas e observadas em Ateles sp. estão resumidas na Tabela 2. Tabela 2 – Distribuição dos sincrânios de Ateles sp. de acordo com as principais afecções e local de vida Afecções Alterações Oclusivas Assimetria Alterações Ósseas Vida Livre 49 (22,8%) 30 (14%) 12 (5,5%) Local de Vida Cativeiro 11 (55%) 2 (10%) 1 (5%) Total Indeterminado 5 (50%) 4 (40%) 0 65 (26,5%) 36 (14,7%) 13 (5,3%) 66 5.1.1 Alterações Oclusivas As alterações oclusivas foram observadas em 65 sincrânios de Ateles sp., correspondendo a 26,5% do total avaliado. Estas alterações foram observadas em sincrânios de machos e fêmeas e nas espécies A. belzebuth, A. marginatus, A. variegatus, A. chamek e A. paniscus (Tabela 3). Tabela 3 – Distribuição e ocorrência das alterações oclusivas segundo espécie e sexo Espécie Macho Ateles belzebuth 3 (20%) Ateles marginatus 7 (28%) Ateles variegatus 0 Ateles chamek 2 (28,6%) Ateles paniscus 9 (15,3%) Indeterminadai 2 (66,7%) i Espécie Indeterminada Fêmea Sexo Indeterminado Número Total 5 (15,2%) 3 (33,3%) 3 (100%) 6 (31,6%) 10 (43,5%) 1 (33,3%) 1 (100%) 0 0 4 (28,6%) 3 (50%) 6 (54,5%) 9 (18,4%) 10 (21,75%) 3 (75%) 12 (28,57%) 22 (25%) 9 (52,9%) A Figura 9 representa um sincrânio com o padrão oclusivo considerado normal neste estudo, enquanto as Figuras 10 e 11 representam animais com prognatismo. Figura 9 – Padrão oclusivo normal em sincrânio de fêmea de Ateles geoffroyi (MPEG-21835) 67 Figura 10 – Prognatismo em sincrânio de vida livre de Ateles belzebuth (MPEG-5049) Figura 11 – Prognatismo em sincrânio de macho de vida livre de Ateles paniscus (MPEG-13243) 5.1.2 Assimetria As alterações de simetria foram observadas em 36 sincrânios de Ateles sp., correspondendo a 14,7% do total avaliado. A assimetria foi observada em machos e fêmeas e nas espécies A. paniscus, A. belzebuth, A. chamek e A. marginatus (Tabela 4). 68 Tabela 4 – Distribuição e ocorrência dos sincrânios assimétricos segundo espécie e sexo Espécie Macho Ateles belzebuth 1 (6,7%) Ateles marginatus 5 (22,7%) Ateles chamek 2 (22,7%) Ateles paniscus 5 (21,7%) Indeterminada i 0 i Espécie Indeterminada Fêmea Sexo Indeterminado Número Total 4 (12,1%) 0 1 (5,3%) 8 (13,6%) 1 (33,3%) 0 0 3 (21,4%) 1 (16,7%) 5 (54,5%) 5 (10,2%) 5 (10,9%) 6 (15%) 14 (15,9%) 6 (35,3%) Alguns dos espécimes com assimetria em ossos do sincrânio encontram-se ilustrados nas Figuras 12, 13 e 14. Figura 12 – Alteração de simetria em sincrânio de fêmea de vida livre da espécie Ateles belzebuth (MPEG-5040). Notar que o dente 203 apresenta deslocamento ao plano sagital do animal 69 Figura 13 – Alteração de simetria em sincrânio de macho de vida livre da espécie Ateles belzebuth (MPEG-1534). Notar que o dente 103 apresenta deslocamento em relação ao plano sagital do animal Figura 14 – Alteração de simetria em sincrânio de fêmea de vida livre da espécie Ateles paniscus (MPEG-1274). Notar que a mandíbula apresenta desvio de eixo sagital para lado direito 5.1.3 Alterações Ósseas As alterações ósseas foram observadas em 13 sincrânios de Ateles sp., correspondendo a 5,3% do total avaliado. Dez animais eram fêmeas, um era macho e outro de sexo indeterminado, correspondendo respectivamente a 6,8%, 1,4% e 2,9% do total avaliado. Foram encontradas alterações ósseas em dois sincrânios da espécie A. belzebuth, três da espécie A. chamek, um da espécie A. marginatus e sete indivíduos da espécie A. paniscus. 70 Três dos sincrânios avaliados apresentaram alterações ósseas inespecíficas e de etiologia desconhecida na mandíbula, conforme as Figuras 15, 16 e 17. Figura 15 – Mineralização incompleta na transição do ramo vertical com ramo horizontal da mandíbula de fêmea de Ateles belzebuth de vida livre (MPEG-5039) Figura 16 – Mineralização incompleta na transição do ramo vertical com ramo horizontal da mandíbula de fêmea de Ateles paniscus de vida livre (MPEG-1275) 71 Figura 17 – Mineralização incompleta do ramo vertical da mandíbula de macho de Ateles marginatus de vida livre (MHN-UFRJ-33606) Uma fêmea da espécie Ateles belzebuth de vida livre (MPEG-5048) apresentou uma formação periostal bilateral em osso parietal, de etiologia desconhecida (Figura 18). Figura 18 – Formação periostal bilateral em osso parietal de fêmea da espécie Ateles belzebuth de vida livre (MPEG-5048) As fraturas de ossos do sincrânio foram observadas em seis animais, sendo esta a alteração óssea mais encontrada neste estudo (2,4%). Dentre essas lesões, as fraturas 72 mandibulares foram as mais observadas, com cinco animais acometidos, correspondendo a 2% dos espécimes avaliados (Figuras 19, 20 e 21). Figura 19 – Fratura mandibular em Ateles chamek de sexo indeterminado de vida livre (MHN-UFRJ33621). Pode-se notar a presença de aspecto irregular da borda da fratura e área de remodelamento ósseo Figura 20 – Fratura mandibular em ramo horizontal esquerdo de fêmea de vida livre da espécie Ateles chamek (MZ-USP-5602). Pode-se notar aspecto irregular da lesão 73 Figura 21 – Trauma de mandíbula de origem desconhecida em porção lateral direita em fêmea de vida livre da espécie Ateles chamek (MHN-UFRJ-6037) Em uma fêmea jovem de cativeiro da espécie Ateles paniscus (MPEG-4069), observou-se uma fratura com consolidação incompleta de ramo horizontal da mandíbula esquerda (Figura 22). Figura 22 – Fratura com consolidação incompleta de ramo horizontal de mandíbula esquerda de fêmea jovem da espécie Ateles paniscus oriunda de cativeiro (MPEG-4069) Uma fêmea de vida livre da espécie Ateles paniscus (MPEG-1243) apresentou fratura com proliferação óssea na inserção do arco zigomático esquerdo (osso maxilar) (Figura 23). 74 Figura 23 – Fratura com proliferação óssea na inserção do arco zigomático esquerdo (osso maxilar) de fêmea de vida livre da espécie Ateles paniscus (MPEG-1243) Foram observados três animais com alterações ósseas características de fenda palatina e lábio leporino, correspondendo a 1,2% dos animais avaliados. Todos esses animais eram fêmeas de vida livre da espécie A. paniscus (Figuras 24, 25 e 26). Figura 24 – Fêmea de vida livre da espécie Ateles paniscus com lábio leporino e fenda palatina (MPEG-1245): (A) vista ventro-dorsal, (B) vista rostral. Notar que não há união da sínfise palatina na porção do osso incisivo 75 Figura 25 – Fêmea de vida livre da espécie Ateles paniscus com lábio leporino e fenda palatina (MPEG-1267): (A) vista ventro-dorsal, (B) vista rostral. Notar que não há união da sínfise palatina na porção do osso incisivo Figura 26 – Fêmea de vida livre da espécie Ateles paniscus com lábio leporino e fenda palatina (MPEG-6979): (A) vista ventro-dorsal, (B) vista rostral. Notar que não há união da sínfise palatina na porção do osso incisivo 5.2 Afecções Dentárias Para o estudo das principais afecções dentárias foram avaliados um total de 227 sincrânios de Ateles sp. Foram excluídos do presente estudo 21 espécimes de animais jovens com dentição mista, quatro sincrânios que não puderam ser desarticulados e um sincrânio 76 representado apenas pelo crânio e maxila. A distribuição dos animais por espécie e sexo é ilustrada na Figura 27. Número de Animais 52 33 25 21 21 19 11 ad a in et er m At el In d es be l es At el Fêmea ge o ze bu ffr o th ek ch am es At el Macho 2 2 1 yi 1 ga tu s va rie es es At el At el m ar g pa n es 12 1 1 in at us isc us 5 At el 14 6 Indeterminado Figura 27 – Distribuição dos sincrânios de Ateles sp. com afecções dentárias de acordo com a espécie e sexo Os 227 sincrânios foram representados por 199 animais de vida livre, 16 de cativeiro e 12 de origem desconhecida, conforme ilustrado na Figura 28. Número de Animais 69 48 43 36 11 8 1 Ateles paniscus 3 2 Ateles marginatus Ateles variegatus Vida Livre 1 Ateles chamek Cativeiro Ateles belzebuth Ateles geoffroyi 2 3 Indeterminada Indeterminado Figura 28 – Distribuição dos sincrânios de Ateles sp. com afecções dentárias de acordo com a espécie e local de vida 77 As principais afecções dentárias encontradas nos 227 sincrânios de Ateles sp. encontram-se resumidas na tabela 5. Tabela 5 – Distribuição da ocorrência das afecções dentárias avaliadas de acordo com o local de vida em sincrânios de Ateles sp. Afecção Dentária Anomalia Dentária de Conformação Vida Livre 6 (3%) Habitat Cativeiro 0 Indeterminado 0 6 (2,6%) Anomalia de Número 60 (30,2%) 4 (25%) 1 (8,3%) 65 (28,6%) Alterações Amelo-Cementárias 177 (88,9%) 9 (56,25%) 8 (66,6%) 194 (85,5%) Apinhamento Dentário 14 (7%) 3 (18,6%) 1 (8,3%) 18 (7,9%) Deiscência Óssea-Alveolar 9 (4,5%) 0 1 (8,3%) 10 (4,4%) Fenestração Óssea-Alveolar 5 (2,5%) 2 (12,5%) 0 7 (3%) Desgaste Dentário 80 (40,2%) 1 (6,2%) 1 (8,3%) 82 (36,1%) Exposição de Furca 4 (2%) 2 (12,5%) 1 (8,3%) 7 (3,1%) Exposição de Câmara Pulpar 30 (15,1%) 2 (12,5%) 2 (16,7%) 34 (15%) Fratura Dentária 27 (13,6%) 1 (6,25%) 2 (16,7%) 30 (13,2%) 2 (1%) 0 0 2 (0,9%) 58 (29,1%) 3 (18,8%) 2 (16,7%) 63 (27,8%) Giroversão Dentária Reabsorção de Crista Alveolar Total 5.2.1 Anomalia Dentária de Conformação As anomalias dentárias foram observadas em seis sincrânios de macacos-aranha, correspondendo a 2,6% do total de animais avaliados. Todos os animais eram de vida livre, correspondendo a 3% do total de indivíduos neste grupo. 78 Uma fêmea da espécie A. marginatus de vida livre apresentou dentição supranumerária fusionada. Na maxila deste indivíduo foi observada geminação do dente 204 e seu correspondente supranumerário com o elemento 205 (Figura 29). Figura 29 – Geminação do dente 204 e seu correspondente supranumerário com o 205: (A) nota-se a possível separação entre as raízes dos 3 dentes em vista palatina; (B) a geminação entre os elementos 204 e o 205 é melhor observada na vista vestibular Foram observadas anomalias de malformação dentária de conformação em outros cinco sincrânios de vida livre avaliados, que apresentavam dentes com diâmetro de coroa reduzida. Essas alterações estiveram presentes em quatro fêmeas, sendo dois indivíduos da espécie A. chamek (MHN-UFRJ-505/22788) (Figura 30), um A. belzebuth (MPEG-5033) (Figura 31) e outro A. paniscus (MPEG-1166) (Figura 32). O único macho com esta afecção pertencia à espécie A. marginatus (MZ-USP-19320). 79 Figura 30 – Anomalia dentária de conformação em dente 205 de fêmea de vida livre da espécie Ateles belzebuth (MPEG-5033) Figura 31 – Anomalia de conformação em fêmeas de vida livre da espécie Ateles chamek. Nota-se a coroa clínica menor em comprimento e diâmetro se comparada ao dente molar proximal: (A) elemento 209 (MHN-UFRJ-505), (B) elemento 109 (MHN-UFRJ-22788) 80 Figura 32 – Anomalia de conformação em dente 109 de fêmea de vida livre da espécie Ateles paniscus (MPEG-1166). Aparentemente existem dois dentes 109, sendo um supranumerário 5.2.2 Anomalia de Número Foram encontrados 65 sincrânios com alterações do número de dentes, o que corresponde a 28,6% do número total de animais avaliados. As anomalias dentárias de número observadas no presente estudo foram: presença de dentes supranumerários, perda dentária antes da morte, agenesia ou dentes não erupcionados. Não foi observado nenhum caso de persistência de dentição decídua nos sincrânios de Ateles sp. Sete animais apresentaram alterações características de agenesia dentária ou de dentição ainda não erupcionada, o que corresponde a 3% do número total de sincrânios avaliados. Todos os casos envolviam os terceiros molares, estando todos os quatro dentes ausentes em quatro destes animais. Um sincrânio não possuía ambos os molares superiores, enquanto em dois desses indivíduos apenas um molar superior estava ausente (Figura 33). 81 Figura 33 – Ausência do dente 209 em fêmea de Ateles chamek de vida livre (MHN-UFRJ-31293) Os dentes supranumerários foram observados em 11 sincrânios de Ateles sp., correspondendo a 4,8% do número total avaliado. Quatro destes animais eram fêmeas de vida livre da espécie A. paniscus e, em todos esses sincrânios, havia um molar superior supranumerário (Figura 34). Figura 34 – Dentes supranumerários adjacentes ao dente 209 em fêmeas de vida livre da espécie Ateles paniscus: (A) MPEG-1229, (B) MPEG-1280 Foram observados dentes supranumerários em três animais da espécie A. belzebuth. Uma fêmea de vida livre apresentou dois pré-molares superiores supranumerários (Figura 82 35B), enquanto em um macho e uma fêmea também de vida livre esta mesma alteração foi observada unilateralmente (Figura 35A). Figura 35 – Dentes pré-molares supranumerários em fêmeas de vida livre da espécie Ateles belzebuth: (A) MPEG-5031, (B) MPEG-5148 Três fêmeas de vida livre da espécie A. marginatus apresentaram dentição supranumerária. Em um dos sincrânios observou-se dentes molares superiores supranumerários bilateralmente (Figura 36). Em dois indivíduos as alterações foram referentes aos dentes pré-molares superiores. Figura 36 – Presença de dentes pré-molares supranumerários e apinhamento dentário em fêmea de vida livre da espécie Ateles marginatus (MPEG-5143) 83 Um sincrânio de vida livre de sexo indeterminado da espécie A. chamek (MHN-UFRJ33620) apresentou pré-molares superiores supranumerários bilateralmente (Figura 37). Figura 37 – Presença de dentes pré-molares superiores supranumerários e apinhamento dentário em animal de vida livre da espécie Ateles chamek (MHN-UFRJ-33620) Dos 227 sincrânios avaliados, 48 apresentaram algum número de perda dentária antes da morte adquirida, o que corresponde a 21,1% do total estudado. A distribuição dessa alteração segundo a espécie e sexo está descrita na tabela 6. Tabela 6 – Distribuição e ocorrência de sincrânios com perda dentária antes da morte segundo espécie e sexo Espécie Macho Fêmea Ateles belzebuth 2 (14,3%) 7 (21,2%) Ateles marginatus 5 (23,8%) 6 (24%) Ateles variegatus 1 (100%) 0 Ateles chamek 2 (33,3%) 3 (15,8%) Ateles paniscus 7 (33,3%) 8 (15,4%) Indeterminadai 0 1 (50%) i Animais cuja espécie não foi definida Sexo Indeterminado Número Total 1 (100%) 0 0 3 (27,2%) 2 (40%) 0 10 (20,8%) 11 (23,9%) 1 (50%) 8 (22,2%) 17 (21,8%) 1 (7,1%) 84 As diferenças quanto à morfologia óssea alveolar nas perdas dentárias antes e depois da morte foram observadas nos sincrânios avaliados (Figura 38). Figura 38 – Perda dentária antes e após a morte: (A) Crânio de macho de vida livre da espécie A. paniscus com perda dentária ocorrida antes da morte. Observa-se remodelamento ósseo com arredondamento da crista óssea alveolar e não evidenciação dos alvéolos dentários (MPEG-13243); (B) mandíbula de macho de vida livre da espécie Ateles marginatus com perda dentária ocorrida após a morte. Observa-se ausência de reação periostal, contorno da crista óssea alveolar inalterado, e manutenção da profundidade dos alvéolos dentários (MHN-UFRJ-33606) As perdas dentárias ocorridas antes da morte (Figura 39) foram classificadas de acordo com o critério estabelecido anteriormente em graus de 1 a 5 (Tabela 7). Tabela 7 – Distribuição dos indivíduos com perda dentária ocorrida antes da morte de acordo com a espécie e grau da lesão Espécie Grau 1 Ateles belzebuth 7 Ateles marginatus 2 Ateles variegatus 0 Ateles chamek 4 Ateles paniscus 5 Indeterminadai 1 i Animais cuja espécie não foi definida Grau 2 Grau 3 Grau 4 Grau 5 1 1 0 1 5 0 1 2 1 1 1 0 0 1 0 1 2 0 1 5 0 1 4 0 85 Figura 39 – Fêmea de vida livre da espécie Ateles paniscus apresentando perda dentária ocorrida antes da morte: (A) perda de todos os pré-molares superiores; (B) perda de todos os incisivos inferiores e do elemento 404 5.2.3 Alterações Amelo-Cementárias Um total de 194 sincrânios apresentou alterações amelo-cementárias, o que corresponde a 85,5% dos animais avaliados. Todos os espécimes exibiram pigmentação de esmalte e o escurecimento dentário esteve presente em 15 animais com fraturas dentárias (Figura 40). Figura 40 – Fratura dentária de 203 com exposição de câmara pulpar coronal e reabsorção de margem alveolar, em animal de sexo indefinido da espécie Ateles paniscus (MPEG-1571) 86 Em animais de vida livre, a presença de pigmentação de esmalte esteve presente em 88,9% dos sincrânios avaliados, enquanto que naqueles sabidamente provenientes de cativeiro esta alteração esteve presente em 56,25% (Figura 41). Figura 41 – Presença de pigmentação de esmalte em Ateles sp. de sexo indeterminado (MPEG-23209) 5.2.4 Doença Periodontal Alguns dos sincrânios avaliados exibiram alterações características de doença periodontal, evidenciadas por mudanças no osso alveolar (Figura 42, 43 e 44). Devido à ausência de tecidos moles e pela perda de material durante o processamento dos sincrânios, a prevalência da doença periodontal não pode ser calculada com precisão. 87 Figura 42 – Macho de Ateles sp. de cativeiro (MPEG-4063) com alterações ósseas características de doença periodontal: (A) exposição de furca grau 3; (B) reabsorção de crista alveolar; (C) presença de cálculo dentário aderido aos dentes Figura 43 – Fêmea de Ateles marginatus de vida livre (MZ-USP-5606) com alterações ósseas características de doença periodontal: (A) reação periostal; (B) cálculo dentário; (C) reabsorção de crista alveolar Figura 44 – Fêmea de Ateles marginatus de vida livre evidenciando reação periostal em face vestibular da crista alveolar, desde dente 203 até o 207 (MZ-USP-19325) 88 5.2.5 Apinhamento Dentário Foram observados 18 sincrânios com apinhamento dentário, correspondendo a 7,9% do total de animais avaliados (Figuras 45, 46 e 47). Figura 45 – Apinhamento dentário de 303 e 304 em macho de Ateles paniscus de cativeiro (MPEG8855) Figura 46 – Apinhamento dentário de 301 e 401 em fêmea de Ateles paniscus de vida livre (MPEG6992) 89 Figura 47 – Apinhamento dentário de pré-molares superiores em Ateles marginatus de vida livre (MZ-USP-19322) 5.2.6 Deiscência Óssea Alveolar O defeito ósseo de deiscência foi encontrado em 10 sincrânios de Ateles sp., correspondendo a 4,4% dos espécimes avaliados. Dentre esses animais, nove eram provenientes de vida livre (Figura 48) e um de origem desconhecida. Figura 48 – Deiscência óssea alveolar e fenestração em dentes 205 e 206 de Ateles paniscus de vida livre (MPEG-6992) 90 Três animais apresentaram deiscência óssea alveolar em dentes caninos fraturados, como o animal da Figura 49. Figura 49 – Deiscência óssea alveolar em dente 303 fraturado de Ateles paniscus de vida livre (MPEG-22052) Dois indivíduos jovens (MHN-UFRJ-506/33615) apresentaram deiscência óssea alveolar em caninos em processo de erupção (Figura 50). Figura 50 – Deiscência óssea alveolar em dente 203 de fêmea jovem da espécie Ateles chamek (MHN-UFRJ-506) 91 5.2.7 Fenestração Óssea Alveolar O defeito ósseo de fenestração foi encontrado em sete sincrânios de Ateles sp., correspondendo a 3% dos sincrânios avaliados. Dentre esses animais, cinco eram provenientes de vida livre (Figura 51) e dois de cativeiro. Três destes animais também apresentavam deiscência óssea alveolar (MPEG-1234/1571/6992). Figura 51 – Fenestração óssea alveolar em dente 206 de Ateles marginatus de vida livre (MZ-USP19324) Dois indivíduos jovens (MPEG-4070/6984) apresentaram fenestração óssea alveolar em dentes em processo de erupção (Figuras 52 e 53). 92 Figura 52 – Fenestração óssea alveolar em dente 305 de macho jovem de cativeiro da espécie Ateles paniscus (MPEG-6984) Figura 53 – Fenestração óssea alveolar em fêmea jovem de cativeiro da espécie Ateles paniscus (MPEG-4070) 5.2.8 Desgaste Dentário Um total de 82 sincrânios apresentou desgaste dentário, o que corresponde a 36,1% dos animais avaliados. Deste total, 80 animais eram de vida livre, um de cativeiro e um de origem desconhecida, correspondendo a respectivamente, 40,2%, 6,2% e 8,3% do total avaliado. 93 Foram vistos animais com desgaste dentário desde o grau 1 até o 3, das espécies A. belzebuth, A. marginatus, A. chamek e A. paniscus, conforme resumido na Tabela 8. Tabela 8 – Distribuição e ocorrência do desgaste dentário por espécie e grau da lesão Espécie Grau 1 Ateles belzebuth 25 (52%) Ateles marginatus 9 (19,6%) Ateles chamek 8 (22,2%) Ateles paniscus 8 (10,3%) Indeterminada i 1 (6,3%) i Animais cuja espécie não foi definida Grau 2 Grau 3 Total 3 (6,25%) 3 (6,52%) 7 (19,4%) 7 (9%) 1 (6,3%) 1 (2,1%) 1 (2,2%) 2 (5,6%) 6 (7,7%) 0 29 (60,4) 13 (28,3%) 17 (47,2%) 21 (26,9%) 2 (12,5%) Foram avaliados 133 sincrânios de fêmeas, 65 de machos e 29 de sexo indefinido, totalizando 227 animais. Um total de 40 fêmeas apresentou algum grau de desgaste dentário (Figura 54), seguido por 28 machos e por 14 animais de sexo indefinido, resultando em uma ocorrência de respectivamente, 30,1%, 43,1% e 48,3%. Figura 54 – Desgaste grau 2 em dentes 301 e 401 de fêmea de Ateles marginatus de vida livre (MPEG-5041) 94 5.2.9 Exposição de Furca A exposição de furca foi encontrada em sete animais (cinco fêmeas e dois machos) correspondendo a 3,1% do total de sincrânios avaliados. Quanto ao local de vida, quatro espécimes eram provenientes de vida livre (2%), dois de cativeiro (12,5%) e um de origem desconhecida (8,3%). A distribuição das lesões está resumida na Tabela 9. Tabela 9 – Identificação dos sincrânios acometidos pela exposição de furca com informações referentes ao sexo, local de vida e grau da lesão Identificação Espécie 996 Ateles paniscus 1166 Ateles paniscus 1238 Ateles paniscus 4063 Indeterminada 4069 Ateles paniscus 5036 Ateles belzebuth 23210 Indeterminada i i Animais cuja espécie não foi definida ii Informação indisponível Sexo Local de Vida Grau da Lesão Fêmea Fêmea Fêmea Macho Fêmea Macho Macho Vida Livre Vida Livre Vida Livre Cativeiro Cativeiro Vida Livre Indeterminado ii 3 2 3 3 3 1 3 A exposição de furca grau 1 foi encontrada apenas no sincrânio 5036 (Figura 55), assim como o grau 2 da lesão foi observado apenas no espécime 1166 (Figura 56). Em ambos os casos, a ocorrência da lesão correspondeu a 0,4% de todos os animais avaliados no presente estudo. 95 Figura 55 – Exposição de furca grau 1 em dente 207 de macho de vida livre da espécie Ateles belzebuth (MPEG-5036) Figura 56 – Exposição de furca grau 2 em dente 107 de fêmea de vida livre da espécie Ateles paniscus (MPEG-1166) A exposição de furca grau 3 foi a mais prevalente, estando presente em cinco dos oito sincrânios, correspondendo a 2,2% do total de espécimes avaliados (Figura 57). 96 Figura 57 – Exposição de furca grau 3 em dente 207 de fêmea de vida livre da espécie Ateles paniscus (MPEG-996) 5.2.10 Exposição de Câmara Pulpar Um total de 34 sincrânios apresentou exposição de câmara pulpar, o que corresponde a 15% dos animais avaliados. Esta alteração esteve presente em 30 indivíduos de vida livre, dois de cativeiro e dois de origem desconhecida, correspondendo a respectivamente, 15,1%, 12,5% e 15% do total estudado. Foram avaliados 227 animais, sendo 133 fêmeas, 65 machos e 29 de sexo indeterminado. Esta alteração foi encontrada 12,8% das fêmeas, 16,9% dos machos e 37,9% de animais de espécie indefinida. Em 26 casos (11,5% do total de sincrânios avaliados), a exposição de câmara pulpar ocorreu como consequência de fraturas dentárias (Figuras 58 e 59). 97 Figura 58 – Exposição de câmara pulpar coronal com escurecimento dentário em 405 e 406 fraturados de macho de vida livre da espécie Ateles belzebuth (MPEG-5036) Figura 59 – Exposição de câmara pulpar coronal com escurecimento dentário em 103 fraturado de macho de vida livre da espécie Ateles paniscus (MPEG-1158) Em cinco animais (2,2% do total de sincrânios avaliados), a exposição de câmara pulpar ocorreu como consequência de desgaste dentário grau 3. Em três casos (1,3% do total de sincrânios avaliados), a exposição de câmara pulpar ocorreu possivelmente por lesões sugestivas de cárie (Figuras 60 e 61). 98 Figura 60 – Exposição de câmara pulpar coronal em dente 204 com alterações sugestivas de cárie em macho de vida livre da espécie Ateles paniscus (MPEG-21796) Figura 61 – Exposição de câmara pulpar coronal em dente 103 com alterações sugestivas de cárie em fêmea de vida livre da espécie Ateles marginatus (MZ-USP-19325) 5.2.11 Fratura Dentária Um total de 30 sincrânios apresentou fratura dentária, o que corresponde a 13,2% do total de animais avaliados. A maior parte desses animais (27 indivíduos) era de vida livre (16,6%), sendo um de cativeiro (6,25%) e dois de origem desconhecida (16,7%). Foram observadas fraturas dentárias grau 1 e 2. Estas lesões estavam presentes em A. belzebuth, A. marginatus, A. chamek, A. paniscus e em animais de origem indeterminada. 99 Um total de 13 indivíduos do sexo feminino apresentou algum grau de fratura dentária, seguido por 11 machos e por seis animais de sexo indefinido. Sendo assim, de acordo com o número total de sincrânios avaliados por sexo, observaram-se fraturas em 9,8% das fêmeas, 16,9% dos machos e em 20,7% dos animais de sexo indefinido. Foram encontrados 73 dentes fraturados nos 30 sincrânios com este tipo de lesão. Foram observadas fraturas em 17 incisivos, 29 caninos (Figura 61), 13 pré-molares e 14 molares (Figura 63). A distribuição destas lesões foi resumida na Tabela 10. Tabela 10 – Distribuição de dentes fraturados por grau em sincrânios de Ateles sp. Dente Grau 1 Grau 2 Total 101 102 103 105 106 107 108 201 202 203 209 301 302 303 304 305 306 307 308 309 401 402 403 404 405 406 407 408 1 0 4 0 0 1 1 0 0 2 0 0 1 5 1 0 2 1 2 1 0 0 2 1 1 1 2 1 0 1 3 1 1 1 1 3 1 9 1 3 4 2 1 1 0 0 0 0 2 1 2 1 1 1 1 1 1 1 7 1 1 2 2 3 1 11 1 3 5 7 2 1 2 1 2 1 2 1 4 2 2 2 3 2 100 Figura 62 – Fratura dentária grau 2 com exposição de câmara pulpar coronal e escurecimento dentário de 203 em macho de vida livre da espécie Ateles paniscus (MPEG-21617) Figura 63 – Fratura dentária longitudinal grau 2 com exposição de câmara pulpar e escurecimento dentário de 209 em macho de vida livre da espécie Ateles paniscus (MPEG-1158) 5.2.12 Giroversão Dentária A giroversão dentária foi encontrada em apenas dois sincrânios, correspondendo a 0,9% do total avaliado. Ambos os animais eram de vida livre, sendo um macho (MHN-UFRJ32701) e outro de sexo indeterminado (MHN-UFRJ-33613). Esta alteração foi vista em um macho de vida livre da espécie A. marginatus, acometendo ambos os terceiros molares superiores (Figura 64). 101 Figura 64 – Giroversão dos dentes 109 e 209 de macho de vida livre da espécie Ateles marginatus (MHN-UFRJ-32701) Um animal de vida livre e sexo indeterminado da espécie A. chamek apresentou giroversão em todos os dentes pré-molares da mandíbula (Figura 65). Figura 65 – Giroversão de todos os pré-molares inferiores em Ateles chamek de vida livre e sexo indeterminado (MHN-UFRJ-33613) 102 5.2.13 Reabsorção da Crista Alveolar Um total de 63 sincrânios apresentou reabsorção da crista alveolar, o que corresponde a 27,8% dos animais avaliados. Esta alteração esteve presente em 58 animais de vida livre (29,1%), três de cativeiro (18,85) e em dois animais de origem desconhecida (16,7%). A reabsorção da crista alveolar foi observada nas espécies A. belzebuth, A. marginatus, A. paniscus (Figuras 66 e 67) e A. chamek, estando presente em 33 fêmeas (24,8%), 22 machos (33,8%) e em oito animais de sexo indeterminado (27,6%). Figura 66 – Reabsorção da crista alveolar em pré-molares e molares superiores de fêmea de Ateles paniscus de vida livre (MPEG-1238) Figura 67 – Reabsorção da crista alveolar em pré-molares e molares superiores de Ateles paniscus de vida livre e sexo indeterminado (MPEG-1571) 103 6 DISCUSSÃO A avaliação odontológica de animais selvagens é extremamente difícil, tanto pela periculosidade de certas espécies quanto pelo alto potencial zoonótico, principalmente dos primatas não-humanos. A crescente preocupação com o bem-estar animal fez com que a odontologia veterinária fosse reconhecida como uma especialidade importante para este fim, já que os animais também sofrem distúrbios na cavidade oral e raramente os demonstram, o que torna ainda mais complicado o trabalho do clínico veterinário. Por esta razão, a utilização de sincrânios mantidos em coleções de mastozoologia mostrou-se bastante útil, afirmação esta já feita por Rossi Jr. (2007) e Elbroch (2006). As coleções do Museu Paraense Emílio Goeldi (MPEG), Museu Histórico Nacional da Universidade Federal do Rio de Janeiro (MHN-RJ) e Museu de Zoologia da Universidade de São Paulo (MZ-USP) mantinham sincrânios em bom estado de conservação e quase sempre possuíam informações referentes à coleta, sexo e espécie. A avaliação de espécimes mantidas em coleções de mastozoologia possibilitou que um grande número de indivíduos de vida livre fosse avaliado, uma vez que é muito custoso em termos financeiros e em tempo de amostragem de campo para se atingir um número grande de indivíduos do gênero pesquisado. Além disso, observaram-se lesões graves em alguns desses animais, mas que de alguma forma foram compensadas. Isto demonstra a grande habilidade de certas espécies conviverem com alterações aparentemente graves o suficiente para impossibilitarem a vida livre. Esse fato também chama a atenção para aqueles animais mantidos em cativeiro e que não demonstram qualquer sinal de doença da cavidade oral. É de suma importância que essas alterações sejam descobertas tão logo surjam. Sendo assim, os resultados presentes aqui corroboram a recomendação de Pachaly (2006) e Fagan (1983), que instituições mantenedoras de espécies selvagens instituam um programa de odontologia preventiva, a fim de evitar essas lesões ou, de que pelo menos, elas sejam descobertas precocemente. No estudo realizado por Degusta et al. (2003), todos os sincrânios eram de animais encontrados mortos por uma causa natural. Portanto, a forma dos dentes e a idade serviram como indicadores de seleção natural por meio da dentição. Como a maior parte dos sincrânios utilizados no presente estudo foi coletada da natureza ou foi proveniente de zoológicos, a mesma comparação não pode ser feita. Sendo assim, sincrânios com graves alterações odontológicas devem ser examinados para que o tempo decorrente desde a lesão até sua coleta 104 na natureza seja estabelecido. Esta avaliação permite estimar o quanto uma lesão na cavidade oral pode prejudicar a vida de um animal em seu habitat natural. Foram avaliados 253 sincrânios de seis espécies diferentes de Ateles sp. Quatro dessas espécies foram descritas por Bicca-Marques et al. (2006) como sendo brasileiras: A. chamek, A. marginatus, A. belzebuth e A. paniscus. Um único animal da espécie A. geoffroyi foi avaliado no MPEG, mas tratava-se de uma coleta feita no México. Quatro exemplares de A. variegatus foram encontrados na coleção do MPEG, mas esta espécie não foi mencionada em nenhum trabalho ou livro pesquisado. Takahashi (2008) relata que a taxonomia do gênero Ateles não foi totalmente esclarecida, o que pode explicar tanto a ocorrência de A. variegatus, quanto a citação de Ateles paniscus chamek no trabalho feito por White (1986). A faixa etária dos animais não pode ser determinada, já que este dado esteve ausente na maior parte das informações coletadas dos sincrânios. A metodologia proposta por Ravosa e Ross (1994), para a classificação etária de animais do gênero Alouatta, não pode ser adaptada para o gênero Ateles, mesmo tratando-se de animais taxonomicamente próximos. Concorda-se com Winkler (1991) e Anthony e Kay (1993) que a natureza espécie-específica da dieta, o crescimento crânio-facial, e os padrões diferentes de erupção dentária fazem com que a comparação entre táxons tenha um valor limitado. Portanto, a carência de pesquisas espécie-específicas sobre a sequência de erupção dentária em espécies de animais selvagens dificulta a classificação dos sincrânios. Rossi Jr. et al. (2007a) tiveram a mesma dificuldade, relatando que a falta de precisão na determinação da idade das onças-pintadas (Panthera onca) dificultou a correlação entre idade e achados clínicos em seu estudo sobre a doença periodontal. Algumas observações devem ser feitas na elaboração de uma metodologia para que um padrão de sequência de erupção dentária espécie-específica seja estabelecido. Winkler (1991) afirma que apesar da anatomia comparada esclarecer os mecanismos de desenvolvimento e de mudanças evolucionárias, estudos inter e intra-espécies necessitam de uma amostra de tamanho adequado que inclua neonatos e jovens. Além disso, Bowen e Koch (1970) afirmaram que a consistência física da dieta pode influenciar a erupção dentária, o que torna questionável a utilização de dados coletados de animais nascidos em cativeiro. Outras formas de determinação da idade foram propostas, porém nenhuma delas pode ser adaptada para os espécimes deste estudo. Primatas do gênero Ateles não manifestam alterações fenotípicas de pelagem entre indivíduos de diferentes faixas etárias, portanto o critério de Azarias et al. (2006) não pode ser utilizado. Concorda-se com Elbroch (2006) que as alterações ósseas nos sincrânios podem servir como ferramenta na determinação da faixa 105 etária. Entretanto, alguns animais adultos avaliados no presente estudo mantinham sínfises não fusionadas, o que tornou difícil a classificação por faixa etária. Este fato corrobora novamente as afirmações de Elbroch (2006), que relata que algumas espécies de mamíferos apresentam sínfises visíveis também quando adultos, o que as tornam difíceis de serem usadas como meio de estimar a idade. A separação dos sincrânios por sexo foi feita utilizando as informações cedidas pelos museus mantenedores das coleções. Alguns dos animais foram classificados como de sexo indeterminado, pela ausência dessa informação em suas fichas. Concorda-se com Swindler (2002) que pouca ou nenhuma característica significante do canino permite a diferenciação sexual em primatas do novo mundo. Este estudo também corrobora a pesquisa de Gingerich e Shoeninger, já que os animais com caninos mais longos não se trataram necessariamente de machos, havendo grande variação do tamanho deste dente, inclusive em fêmeas da mesma espécie. Por este motivo, a hipótese de Sá et al. (1993), de que a variação do canino pode ter influência geográfica também pode ser verdadeira para Ateles sp. A assimetria craniana foi observada em 36 sincrânios dos 245 avaliados, o que representa 14,7%. Essa mesma alteração foi menos prevalente (6,8%) em sincrânios de suçuarana (Puma concolor) avaliados por Rossi Jr. (2007). Os sincrânios assimétricos representaram 14% de Ateles sp. de vida livre e 10% de mantidos em cativeiro. A maloclusão esteve presente em 65 animais, o que corresponde a 26,5% do total de sincrânios de Ateles sp. avaliados, o que corrobora a grande variação da posição dos dentes desses animais já relatada por Colyer (1919). A diferença entre os resultados obtidos aqui e os relatados por Amand e Tinkelman (1985), de que em primatas essa alteração pode acometer até 40% dos animais, pode ser explicada pelo uso de padrões distintos de avaliação. Nos sincrânios de Ateles sp. de vida livre, as alterações oclusivas estiveram presentes em 22,8% do total avaliado. A ocorrência desta lesão em espécimes mantidos em cativeiro pode ser de duas a quatro vezes maior que nas de vida livre, conforme salientado por Amand e Tinkelman (1985). Em um estudo realizado por Rossi Jr et al. (2003), a prevalência de maloclusão em Panthera onca e Puma concolor mantidas em cativeiro foram respectivamente, 47,61% e 5,55%. Dessa forma, a maior ocorrência de maloclusão em Ateles sp. provenientes de cativeiro (55%) foi um achado esperado. Os resultados obtidos nesta pesquisa corroboram os achados de Wiggs e Hall (2003), já que a maior parte dos animais avaliados era isognata ou quase isognata. Entretanto, concorda-se também com Elbroch (2006) sobre a dificuldade do encontro de sincrânios sem qualquer alteração oclusiva e com perfeita simetria. Por este motivo, as alterações oclusivas e 106 de simetria deste estudo representaram apenas aqueles animais com alterações facilmente identificadas macroscopicamente. Conclui-se assim, que é importante que se estabeleça um critério para estas avaliações, com o intuito de padronizar a prevalência das lesões, tornando fidedigna a comparação entre diferentes pesquisas. Embora Gioso (1998) acredite que o acasalamento consanguíneo seja a principal etiologia da maloclusão, concorda-se com Rossi Jr et al. (2003) que estudos sobre a genealogia dos animais não foram realizados para que esta hipótese possa ser considerada nos sincrânios de Ateles sp. aqui avaliados. As alterações ósseas foram pouco observadas em sincrânios de Ateles sp., sendo as fêmeas as mais acometidas (6,8%). Três espécimes apresentaram mineralização incompleta (MPEG-5039, MPEG-1275, MHN-UFRJ-33606), cuja etiologia não foi estabelecida por não se tratar do objetivo deste trabalho. Em uma fêmea de vida livre da espécie A. belzebuth (MPEG-5048) foi observada a presença de proliferação óssea em abóbada craniana. Uma alteração óssea regenerativa similar e também de etiologia desconhecida, em região de dentes caninos e pré-molares de Puma concolor, foi relatada por Rossi Jr. (2007). Não houve diferença significativa na ocorrência dessas lesões entre animais de vida livre e de cativeiro. Concorda-se com Degusta e Milton (1998) que as fraturas anteriores a morte podem ser facilmente identificadas por alterações de posicionamento, formação de calo e remodelamento ósseos, já que as mesmas alterações foram vistas neste estudo. Dentre as alterações ósseas observadas, as fraturas foram as mais encontradas (2,4% do total avaliado), acometendo seis dos 13 animais com esse tipo de lesão. Apenas um espécime apresentava fratura em arco zigomático esquerdo (MPEG-1243). Esta mesma alteração é relatada em bugio (Alouatta palliata) por Degusta e Milton (1998). Esses autores relataram que a incidência deste tipo de fratura foi consideravelmente maior do lado esquerdo na espécie por eles estudada, levantando a hipótese de que haja lateralidade no comportamento de luta. Em cinco casos de fraturas mandibulares, todos os espécimes eram fêmeas. Este resultado difere do encontrado por Degusta e Milton (1998), na pesquisa sobre alterações ósseas em Alouatta palliata, onde 5,1% dos animais estudados manifestaram fraturas de crânio e mandíbula, número este representado apenas por machos desta espécie. As fraturas mandibulares de Ateles sp. corresponderam a 2% do total de sincrânios avaliados, sendo o ramo horizontal o local mais acometido. Este resultado difere dos encontrados em outras espécies animais. Em um estudo realizado com gatos asselvajados, fraturas mandibulares foram observadas em 3,7% dos espécimes avaliados, sendo as lesões 107 encontradas principalmente no corpo da mandíbula (VERSTRAETE et al., 1996b). Doerr e Dieterich (1979) avaliaram a ocorrência de lesões mandibulares em rena (Rangifer tarandus) provenientes de duas diferentes coleções, encontrando uma prevalência de 7% e 4,4%. Dentre os cinco animais com fraturas mandibulares deste estudo, quatro eram do lado esquerdo da mandíbula. Assim como Degusta e Milton (1998) acreditam que haja lateralidade nas fraturas de arco zigomático de A. palliata, o mesmo pode ocorrer também nas mandibulares de Ateles sp. A ocorrência de especialização cerebral hemisférica em primatas não-humanos é descrita por Fagot e Vauclair (1991) e sugere que, assim como em primatas humanos, haja uma maior prevalência de animais destros. Desta forma, durante os conflitos entre esses animais, o lado oposto pode ser o mais atingido pelos traumas. Uma fêmea jovem de cativeiro da espécie Ateles paniscus (MPEG-4069) apresentou uma fratura completa de mandíbula adjacente ao primeiro molar esquerdo. Uma alteração similar foi descrita por Miles e Grigson (2003) em um guepardo (Aciononyx jubatus). Neste animal, o fragmento posterior da mandíbula também foi deslocado para cima, houve grande formação de calo ósseo e a consolidação dos fragmentos não ocorreu de forma total. O osso alveolar adjacente à raiz mesial do primeiro molar, assim como no sincrânio de Ateles paniscus, foi totalmente reabsorvido. Em ambos os casos a oclusão normal foi mantida através do contato exercido pelos dentes caninos. Esta alteração, aparentemente séria, não parece ter sido a causa da morte deste guepardo, já que existiam sinais de remodelamento e consolidação óssea. Apesar de ser um animal de cativeiro, não há qualquer outra informação que elucide a causa desta lesão no sincrânio de Ateles paniscus. Como esses primatas têm hábitos arborícolas, uma hipótese é que esta fratura tenha ocorrido como resultado de uma queda. O fato deste animal viver em cativeiro pode ter minimizado as consequências desta alteração, porém não há comprovação de que mudanças dietéticas tenham sido realizadas com o intuito de auxiliar na recuperação deste indivíduo. Entretanto, as opções diversificadas de alimentos oferecidos em cativeiro podem ter contribuído para que esta fêmea tenha tido a chance de escolher aqueles mais macios e com alto valor energético. Infelizmente, tais opções nem sempre estão disponíveis para os animais de vida livre, o que pode fazer com que uma fratura deste grau leve à desnutrição e morte. Algumas espécies animais mostram-se plenamente capazes de conviver com graves fraturas de mandíbula, mesmo em vida livre. A grave lesão de MPEG-4069 corrobora os relatos de Wobeser (1992), Degusta e Milton (1998), Dyer (1981), Erb et al. (1996), Verstraete et al. (1996ab) e Rossi Jr. (2007) em lobos e coiotes, bugio, urso-negro, foca, gatos 108 asselvajados, onça-pintada e suçuarana. Em todos os casos, as graves fraturas exibiam modificações ósseas sugestivas de recuperação. Concorda-se com Kraus e Garrett (1968) que os escassos relatos sobre a prevalência de lábio leporino e fenda palatina em primatas não-humanos não sejam condizentes com a realidade, já que esta alteração esteve presente em três sincrânios de Ateles sp., correspondendo a 1,2% dos espécimes avaliados. Este estudo também difere do realizado por Loffredo et al. (1994) com humanos, que concluiu que esta alteração tem maior prevalência no sexo masculino, já que todos os animais aqui acometidos eram fêmeas de A. paniscus (MPEG-1245, MPEG 1267 e MPEG-6979). Não foram encontrados relatos da ocorrência de lábio leporino e fenda palatina em Ateles sp. Todas as etiologias propostas por Loffredo et al. (1994) para a espécie humana não são condizentes com a realidade da espécie aqui estudada, principalmente por se tratarem de animais de vida livre coletados na floresta amazônica há um século atrás. Além disso, a avaliação da procedência desses animais, coletados de três diferentes estados brasileiros (Amazonas, Amapá e Pará), torna quase impossível o parentesco entre estes indivíduos, fazendo com que a hipótese da hereditariedade sugerida por Gioso (2003) seja pouco provável. A ocorrência de três casos de lábio leporino e fenda palatina em Ateles paniscus sugere que esta alteração ocorra com uma frequência maior do que a esperada para esta espécie, corroborando relatos de Kraus e Garrett (1968). A falta de um critério de avaliação etária, assim como de um histórico clínico completo, impossibilitou estimar o quanto esta alteração é incompatível com a vida, além de se estabelecer um tempo médio de sobrevivência dos animais acometidos neste estudo. Assim como Wiggs e Bloom (2003), acredita-se que alterações nas coroas, raízes e no número de dentes sejam comuns em diversas espécies animais. As anomalias dentárias de conformação foram pouco frequentes em Ateles sp., acometendo apenas 2,6% do total avaliado, sendo todos os indivíduos de vida livre. Foram observados casos de terceiro molar com tamanho de coroa reduzida e em plano oclusivo inferior aos dentes adjacentes, assim como a presença de quarto molar supranumerário, com essas mesmas características. Esse achado corrobora a descrição de Shaw (1927) em babuínos, porém as etiologias por ele propostas necessitam de maiores estudos em Ateles sp. Degusta et al. (2003) correlacionam os molares reduzidos e a diminuição do escore corporal à seleção fenotípica do tamanho dos dentes molares. Entretanto, seu estudo foi realizado com animais folívoros da espécie Alouatta palliata, onde a diminuição dos molares 109 pode ter importante papel na adaptação destes indivíduos, influenciando na ingestão de alimentos. De forma contrária, terceiros molares de tamanho reduzido em espécies de hábito alimentar frugívoro como Ateles sp. podem trazer prejuízos no processamento dos alimentos ingeridos. A alteração do número típico de dentes é vista em algumas espécies de mamíferos (HALL, 1940), incluindo o gênero Ateles. Neste estudo, a agenesia dentária não pode ser diferenciada de dentição ainda não erupcionada pela ausência de exame radiográfico complementar, portanto um só grupo foi estabelecido para a inclusão dessas alterações. A ocorrência desta anomalia foi baixa (3%), considerando que alguns dos animais apresentavam molares ainda não erupcionados que não puderam ser vistos sem exame complementar. Este achado foi muito parecido aos 2,5% descritos por Miles e Grigson (2003) na avaliação de 651 sincrânios de Ateles sp. Resultado similar também foi descrito em lobo-guará (Chrysocyon brachyurus) por Lopes (2008), sendo a agenesia dentária comprovada em 3,8% dos espécimes por ela avaliados. Todos os casos de ausência dentária congênita ou de dentição não erupcionada observados neste estudo estavam relacionados ao terceiro molar. Há relatos da mesma ausência dentária em outras espécies de primatas, como Alouatta palliata (DEGUSTA e MILTON, 1998). Em gatos asselvajados esta anomalia foi diagnosticada em 16,6% dos animais estudados, principalmente acometendo o segundo pré-molar superior (Verstraete et al., 1996a). Concorda-se com Rossi Jr. (2002) e Miles e Grigson (2003) sobre a dificuldade do diagnóstico diferencial entre agenesia dentária e perda dentária antes da morte, quando esta tenha sofrido total remodelamento. Nesses casos concorda-se com Lopes (2008) na afirmação de que além do exame radiográfico, o posicionamento dos dentes adjacentes e a comparação com os dentes contralaterais podem contribuir para este diagnóstico. A permanência de dentes decíduos não foi observada em nenhum sincrânio deste estudo, mas esta alteração é descrita em primatas por Miles e Grigson (2003). Os dentes supranumerários foram vistos em 4,8% dos sincrânios aqui estudados. Concorda-se com Lopes (2008) que o diagnóstico desta alteração é muito mais fácil em contrapartida à agenesia. Além da presença do quarto molar já descrita anteriormente, todos os outros animais acometidos apresentaram dentes pré-molares superiores supranumerários. Em gatos asselvajados essa anomalia esteve presente em 3,7% dos animais, sendo os pré-molares também os mais acometidos (VERSTRAETE et al., 1996a). Estes achados divergem do relatado por Hillson (1996), que considera os incisivos superiores os mais prevalentes. 110 Degusta e Milton (1998) também encontraram dentes incisivos e pré-molares supranumerários em Alouatta palliata. A determinação do pré-molar supranumerário foi de difícil diagnóstico, o que já havia sido antes relatado por Wiggs e Lobprise (1997). Em quase todos os casos de pré-molares supranumerários observou-se apinhamento dentário consequente. A geminação dentária foi vista em uma fêmea de vida livre da espécie Ateles marginatus (MZ-USP-19315). Neste animal, observou-se a presença de dois elementos 204, sendo um supranumerário, além da geminação de ambos ao 205, este sem qualquer anomalia de conformação. A vista palatina do hemi-arco dentário deste animal difere totalmente da vestibular, sendo necessária a avaliação conjunta das imagens para um melhor entendimento. A vista vestibular confirma a geminação entre o elemento 204, seu correspondente supranumerário e o elemento 205. De forma contrária, a vista palatina parece demonstrar uma separação das raízes dos três elementos. Todavia, sem o exame radiográfico complementar, é impossível fazer qualquer afirmação sobre a anatomia radicular de qualquer um desses dentes. Concorda-se com Miles e Grigson (2003) que há poucas evidências que determinem a etiologia dos dentes fusionados. A perda dentária antes da morte representou 21,1% do número de animais aqui avaliados. Essas perdas possuíam a borda do osso alveolar remodelada ou completamente absorvida, o que está de acordo com Elbroch (2006), Verstraete et al. (1996b) e Dyer (1981). A comparação dos achados de perda dentária antes da morte não foi significativa entre as espécies avaliadas, já que o baixo número de sincrânios da espécie Ateles variegatus e de indivíduos indeterminados explica as diferenças observadas. Alguns espécimes aparentemente senis estavam quase desprovidos de dentes (MPEG-13243 e MHN-UFRJ-25717), o que corrobora os relatos de Elbroch (2006). A hipoplasia de esmalte não foi observada em nenhum dos sincrânios avaliados, o que está de acordo com Amand e Tinkelman (1985), que afirmaram que a ocorrência desta lesão é pequena em animais selvagens. As coroas dos dentes de grande parte dos animais aqui estudados (85,5%) apresentaram um pigmento escuro e extremamente aderido, o que segundo Miles e Grigson (2003) é comum em primatas e consistem de finas camadas de placas mineralizadas com pigmentos incorporados. Esta alteração foi vista com maior frequência em animais de vida livre. Portanto, concorda-se com Rossi Jr. (2002) que, este pigmento aderido ao esmalte dentário, pode ter sido consequência de impregnação de origem alimentar. As fraturas dentárias foram responsáveis pelo escurecimento dentário de 15 sincrânios de Ateles sp. avaliados neste estudo. Concorda-se com Gioso (2003), que afirma que a coloração 111 escurecida dos dentes é resultado da penetração de substâncias de degradação sanguínea através dos túbulos dentinários. A reação periostal e a reabsorção da crista alveolar, além da presença de cálculo dentário aderido ao dente, foram os principais achados que evidenciaram a doença periodontal nos sincrânios avaliados (MPEG-1571/4063 e MZ-USP-5606/19325). Entretanto, a prevalência dessas lesões não foi calculada pela imprecisão dos achados encontrados em sincrânios. A perda de depósitos calcificados normalmente associada à preparação química e física, conforme ressaltado por Wenker et al. (1999), dificultou a identificação e quantificação do cálculo dentário. Este estudo discorda das observações feitas por Miles e Grigson (2003), já que não foram observados dois tipos diferentes de cálculo dentário o que, segundo esses autores, seria feito facilmente. A metodologia de classificação adotada pelo AVDC (American Veterinary Dental College) baseia-se em animais vivos, o que impossibilita a determinação da doença periodontal em seu estágio inicial, corroborando a afirmação de Hillson (1996), que a gengivite não tem envolvimento do osso alveolar e não pode ser observada em sincrânios. Desta forma, buscou-se apenas relatar que a doença periodontal é, de fato, uma alteração frequente em Ateles sp., vista tanto em animais de vida livre quanto de cativeiro. Concorda-se com Verstraete et al. (1996a) que a hiperemia decorrente da inflamação é refletida no aumento das foraminas e pela textura áspera do osso alveolar. Miles e Grigson (2003) observaram em 1157 sincrânios de canídeos selvagens avaliados, que apenas 24 espécimes (2,1%) apresentavam reabsorção óssea alveolar decorrente de doença periodontal. Entretanto, Lopes (2008) encontrou uma prevalência de 37%, ou seja, bastante superior a descrita previamente para esse grupo de animais. Neste estudo com Ateles sp., a ocorrência de reabsorção óssea alveolar foi evidenciada em 27,8% de todos os sincrânios avaliados e não foram observadas diferenças significativas entre machos e fêmeas. A exposição de furca foi encontrada em sete animais (3,1% do total avaliado), todos eles com sinais ósseos de doença periodontal. A maior incidência em animais de cativeiro sugere que, assim como relatado por Hungerford et al. (1999), Miles e Grigson (2003) e Wiggs e Lobprise (1997), altos índices de alterações odontológicas em diversas espécies estão associados à dietas inadequadas. As lesões periapicais foram observadas principalmente associadas às fraturas dentárias, corroborando os achados de Verstraete et al. (1996a) em gatos asselvajados. Concorda-se com Miles e Grigson (2003) que esses defeitos ósseos ocorram principalmente na face vestibular do osso maxilar. A deiscência e a fenestração apresentaram ocorrências de 112 4,4% e 3%, respectivamente. Assim como Lopes (2008) e Kakehashi et al. (1963), acredita-se que a deiscência observada nos animais manifesta-se como uma confluência da fenestração e de reabsorção horizontal progressiva, e que o posicionamento dos dentes não parece estar envolvido na etiologia dessas lesões. Em Ateles sp., a deiscência e fenestração ósseas alveolares foram observadas em dentes de animais jovens, associadas ao processo de erupção e esfoliação dentária, o que corrobora observações feitas em gorilas por Kakehashi et al. (1963). Assim como descrito por Wiggs e Hall (2003), acredita-se que abscessos dentários possam surgir de forma intermitente, como resultado de dentes decíduos parcialmente reabsorvidos ou dentes fraturados. O apinhamento foi observado em 7,9% de Ateles sp. e a giroversão em 0,9%. Este resultado é condizente com relatos de Colyer (1919), de que este gênero é caracterizado por um alto grau de variação na posição dos dentes, principalmente pela presença de dentes supranumerários. Em animais de cativeiro, a ocorrência desta lesão foi mais que o dobro (18,6%) da encontrada em animais de vida livre (7%). Este resultado está de acordo com Amand e Tinkelman (1985), que relataram que as alterações oclusivas podem possuir o dobro ou triplo de prevalência em animais de cativeiro, o que segundo Wiggs e Lobprise (1997), ocorre devido ao estresse, ambiente, nutrição, textura da dieta, trauma, doença periodontal ou consequência de comportamento anormal durante a criação artificial. Em uma fêmea de Ateles paniscus de vida livre (MPEG-6992), foi observado apinhamento dentário de 101 e 201, o que segundo Miles e Grigson (2003) é um achado comum em primatas não-humanos. O desgaste dentário foi observado em 36,1% dos sincrânios de Ateles sp. avaliados. Essa alteração esteve presente em 40,2% dos animais de vida livre, o difere da ocorrência desta lesão em animais de cativeiro (6,2%). Neste estudo, o desgaste dentário em machos (43,1%) foi maior do que nas fêmeas (30,1%). Concorda-se com Martins et al. (2003), que a microestrutura e espessura do esmalte têm um importante papel nas adaptações dietéticas e, com isso, considera-se como hipótese para a maior prevalência deste tipo de lesão em animais de vida livre o tipo de dieta consumida. Entretanto, Rossi Jr. (2002) relata uma alta prevalência de desgaste dentário em felídeos selvagens de cativeiro (Panthera onca e Puma concolor) e nenhuma ocorrência nos animais de vida livre. Wiggs e Bloom (2003) relatam que a “Síndrome do Mordedor de Grades”, em espécies carnívoras é um importante causador de desgaste dentário. Muitos zoológicos têm como missão a educação e conservação das espécies e, segundo Hosey (2005), realmente buscam atingir essa meta. No zoológico da cidade de São Paulo, o gênero Ateles não é mantido em jaulas, mas sim em um local que mimetiza o seu habitat natural. Portanto, as 113 diferenças de prevalência de lesões odontológicas em animais de cativeiro e vida-livre, mesmo que da mesma espécie, dependem do entendimento de como o ambiente de cativeiro afeta o bem-estar animal. As fraturas dentárias foram observadas em 13,2% dos sincrânios avaliados, sendo o maior achado em machos e em animais de vida livre. Verstraete et al. (1996a) relataram uma incidência muito maior deste tipo de lesão em gatos asselvajados (54,8%), porém a prevalência das fraturas foi similar entre os sexos. Existe uma maior prevalência de fraturas em leoas, o que Valkenburgh (1988) atribui ao comportamento desta espécie, já que são elas as responsáveis pela caça da presa. Fedigan e Baxter (1984) observaram que os machos de Ateles geoffroyi são mais agressivos, interagem fisicamente mais frequentemente e atacam e perseguem principalmente fêmeas adultas. Esta diferença comportamental, assim como a descrita em outras espécies animais, pode ter sido o principal responsável pela maior incidência de fraturas dentárias em machos de Ateles sp. deste estudo. Foram encontrados 73 dentes fraturados em 30 sincrânios com algum tipo de fratura dentária. A maior ocorrência foi de lesões em dentes caninos, seguido pelos incisivos, prémolares e molares. Em gatos asselvajados, Verstraete et al. (1996a) descrevem este mesmo dente como o mais prevalente e acreditam que o mesmo ocorra por comportamentos de interação e agressão entre esses animais. Degusta e Milton (1998) acreditam que conflitos interespecíficos entre Alouatta palliata, Ateles geoffroyi e Cebus capucinus ocorram, podendo ser esta uma outra hipótese para este tipo de alteração. De acordo com a literatura pesquisada, o gênero Ateles consome basicamente frutas e, em estudo realizado por Kinzey e Norkonk (1990), esses animais manifestaram preferência por aquelas de mesocarpo macio, cuspindo também suas sementes. O relato de Kinzey e Norkonk corrobora o de Rosenberger (1992), já que esses indivíduos não possuem dentes especializados para o processamento de alimentos duros. Deste modo, considera-se improvável que fatores dietéticos sejam os principais causadores de fraturas dentárias em Ateles sp. de vida livre, principalmente em ecossistemas preservados onde não haja escassez de alimentos. A exposição de câmara pulpar foi observada em 15% dos sincrânios de Ateles sp. avaliados, sendo a fratura dentária a principal causadora desta lesão. Alguns animais apresentaram esta lesão associada às alterações sugestivas de cárie, como o espécime MPEG21796. O estudo da prevalência da cárie não foi um objetivo deste trabalho, já que a metodologia escolhida não incluía a utilização de exame radiográfico complementar. Embora muitas características do sincrânio citado como exemplo sejam idênticas às observadas na cárie, concorda-se com Hillson (1996) que a histologia das lesões suspeitas é muito 114 importante em sincrânios. Neste indivíduo pode-se observar desmineralização do esmalte e dentina, o que corrobora a descrição de Pachaly (2006), além de exposição da câmara pulpar, descrita tanto por Gioso (2003) quanto por Hillson (1996). Os achados deste estudo corroboram as afirmações de Pachaly (2006) e Wiggs e Lobprise (1997), já que os dentes molares e pré-molares foram os mais acometidos. 115 7 CONCLUSÕES Conclui-se com o presente trabalho que: - Os Ateles sp. possuem afecções em sincrânio, sendo as alterações oclusivas os achados mais significativos em animais de cativeiro (55%). - Foram encontrados animais de vida livre de regiões distintas com lesões características de lábio-leporino e fenda palatina, sendo este achado incomum para este gênero. - Os dois grupos de Ateles sp. possuem afecções dentárias relacionadas com anomalia dentária de conformação (2,6%), anomalia de número (28,6%), alterações amelo-cementárias (85,5%), apinhamento dentário (7,9%), deiscência óssea-alveolar (4,4%), fenestração ósseaalveolar (3%), desgaste dentário (36,1%), exposição de furca (3,1%), exposição de câmara pulpar (15%), fratura dentária (13,2%), giroversão dentária (0,9%) e reabsorção de crista alveolar (27,8%). 116 8 REFERÊNCIAS AGUIAR, M. S.; FERIGOLO, J.; ROSSI JR., J. L.; GIOSO, M. A. Atrição dental em Didelphis albiventris e D. marsupilis (Marsupialia, Didelphimorphia, Didelphidae) do Sul do Brasil. Ciência Rural, v. 34, n. 4, p. 1127-1132, 2004. AMAND, W. B.; TINKELMAN, C. L. Oral Disease in Captive Wild Animals. In: HARVEY, C. E. Veterinary Dentistry. Philadelphia: W. B. Saunders Company, 1985, p. 289-311. AMERICAN VETERINARY DENTAL COLLEGE. Veterinary Dental Nomenclature. Disponível em: <http://www.avdc.org/Nomenclature.pdf>. Acesso em: 4 jan. 2011. ANTHONY, M. R. L.; KAY, R. F. Tooth Form and Diet in Ateline and Alouattine Primates: Reflections on the Comparative Method. American Journal of Science, vol. 293-A, p. 356382, 1993. AZARIAS, R. E. R.; AMBRÓSIO, C. E.; MARTINS, D. S. dos; OLIVEIRA, de V. L.; BENETTI, E.; FERREIRA, J. R.; MIGLINO, M. A. Morfologia dos dentes do bicho-preguiça de coleira (Bradypus torquatus), Illiger, 1811. Revista Biotemas, v. 19, n. 4, p. 73-84, 2006. BADYAEV, A. V. Environmental Stress and Developmental Stability in Dentition of the Yellowstone Grizzle Bears. Behavioral Ecology, v. 9, n. 4, p. 339-344, 1998. BARDACH, J.; KELLY, K. M. Role of Animal Models in Experimental Studies of Craniofacial Growth Following Cleft Lip and Palate Repair. Cleft Palate Journal, v. 25, n. 2, p. 103-113, 1988. BASRANI, E. Fracturas Dentarias: Prevencion y Tratamiento de la Pulpa Vital y Mortificada. Buenos Aires: Inter-Médica Editorial, 1983, 114 p. BATESON, M. A. W. Materials for the Study of Variation Treated with Special Regard to Discontinuity in the Origin of Species. London: Macmillan and Co, 1894. p. 195-264. 117 BICCA-MARQUES, J. C.; SILVA, V. M.; GOMES, D. F. Ordem Primates. In: REIS, N. R.; PERACCHI, A. L.; PEDRO, W. A.; LIMA, I. P. Mamíferos do Brasil. Londrina: Biblioteca Central da Universidade Estadual de Londrina, 2006. p. 101-148. BOWEN, W. H.; KOCH, G. Determination of Age in Monkeys (Macaca irus) on the Basis of Dental Development. Laboratory Animals, n. 4, p. 113-123, 1970. CAMPBELL, C. J.; AURELI, F.; CHAPMAN, C. A.; RAMOS-FERNANDEZ, G.; MATTHEWS, K.; RUSSO, S. E.; SUAREZ, S.; VICK, L. Terrestrial Behavior of Ateles spp. International Journal of Primatology, v. 26, n. 5, p. 1055-1067, 2005. COLYER, J. F. Variations in Position of the Teeth in New World Monkeys. Proceedings of the Royal Society of Medicine, n. 12, p. 39-54, 1919. DAVIES, T. G. H.; PEDERSEN, P. O. The Degree of Attrition of Deciduous Teeth and First Permanent Molars of Primitive and Urbanized Greenland Natives. British Dental Journal, v. 99, n. 2, p. 35-43, 1955. DAYAN, T.; WOOL, D.; SIMBERLOFF, D. Variation and Covariation of Skulls and Teeth: Modern Carnivores and the Interpretation of Fossil Mammals. Paleobiology, v. 28, n. 4, p. 508-526, 2002. DEGUSTA, D.; EVERETT, M. A.; MILTON, K. Natural selection on molar size in a wild population of howler monkeys (Alouatta palliata). Proceedings of the Royal Society, n. 270, p. S15-S17, 2003. DEGUSTA, D.; MILTON, K. Skeletal Pathologies in a Population of Alouatta palliata: Behavioral, Ecological, and Evolutionary Implications. International Journal of Primatology, v. 19, n. 3, p. 615-650, 1998. DENNIS, J. C.; UNGAR, P. S.; TEAFORD, M. F.; GLANDER, K. E. Dental Topography and Molar Wear in Allouatta palliata from Costa Rica. American Journal of Physical Anthropology, n. 125, p. 152-161, 2004. 118 DOERR, J. G.; DIETERICH, R. A. Mandibular Lesions in the Western Arctic Caribou Herd of Alaska. Journal of Wildlife Diseases, v. 15, p. 309-318, 1979. DYER, D. L. An Analysis of Bony Changes Following Trauma to a Black Bear Mandible. Journal of Wildlife Diseases, v. 17, n. 1, 1981. ELBROCH, M. Animall Skulls: A Guide to North American Species. Mechanicsburg: Stackpole Books, 2006, 726p. ERB, E.; SHAUGHNESSY, P. D.; NORMAN, R. J. de B. Dental and Mandibular Injury in an Antarctic Fur Seal, Arctocephalus gazella, at Heard Island, Southern Ocean. Journal of Wildlife Diseases, v. 32, n. 2, p. 376-380, 1996. FAGAN, D. A. Nontraditional Dentistry: The Lion’s Share of Dental Misery. Dentistry, vol. 3, 1983. FAGOT, J.; VAUCLAIR, J. Manual Laterality in Nonhuman Primates: A Distinction Between Handedness and Manual Specialization. Psychological Bulletin, v. 109, n. 1, p. 7689, 1991. FECCHIO, R. S.; ROSSI JR., J. L.; FERRO, D. G.; GIOSO, M. A. Medicina Preventiva Aplicada à Odontologia Veterinária em Animais Selvagens. Revista Nosso Clínico, n. 12, p. 44-49, 2009. FECCHIO, R. S.; GOMES, M. S.; ROSSI JR., J. L.; GIOSO, M. A. Oral Diseases in Captive Capuchin Monkeys. Exotic DVM, v. 10, n. 2, p. 29-34, 2008. FEDI, P. F.; LAWRENCE, J. J. Diagnosis, Prognosis and Treatment Planning. In: FEDI, P. F., Jr.; VERMINO, A. A. The Periodontic by Syllabus. 3ed. Baltimore: Williams & Wilkins, 1995, p. 47. FEDIGAN, L. M.; BAXTER M. J. Sex Differences and Social Organization in Free-Ranging Spider Monkeys (Ateles geoffroyi). Primates, v. 25, n. 3, p. 279-294, 1984. 119 FITCH, H. M.; FAGAN, D. A. Focal Palatine Erosion Associated with Dental Malocclusion in Captive Cheetahs. Zoo Biology, n. 1, p. 295-310, 1982. GIOSO, M. A. Odontologia para o Clínico de Pequenos Animais. 5ed. Revisada. São Paulo: IEditora, 2003, 202p. GIOSO, M. A. Análise morfométrica óssea e dental e sua relação com características físicas do cão (Canis familiaris) como fator predisponente para a doença periodontal. 1998. Tese (Doutorado em Cirurgia) – Faculdade de Medicina Veterinária e Zootecnia, Universidade de São Paulo, São Paulo, 1998. GIOSO, M. A.; FECCHIO, R. S.; ROSSI JR., J. L., BIZAROLL, K. J.; SILVA, M. A. B. da. Necropulpectomia e pulpectomia total em dentes caninos de Tigre Siberiano (Panthera tigris altaica). Revista Nosso Clínico, n. 64, p. 22-36, 2008. GINGERICH, P. D.; SCHOENINGER, M. J. Patterns of Tooth Size Variability in the Dentition of Primates. American Journal of Physical Anthropology, n. 51, p. 457-466, 1979. GUATELLI-STEINBERG, D.; FERREL, R. J.; SPENCE, J., TALABERE, T.; HUBBARD, A.; SCHIMIDT, S. Sex Differences in Anthropoid Canine Lateral Enamel Formation. American Journal of Physical Anthropology, n. 140, p. 216-233, 2009. HALL, E. R. Supernumerary and Missing Teeth in Wild Mammals of the Orders Insectivora and Carnivora, With Some Notes on Disease. Journal of Dental Research, v. 19, n. 103, p103-143, 1940. HENDERSON, E. Platyrrhine Dental Eruption Sequences. American Journal of Physical Anthropology, n. 134, p. 226-239, 2007. HENDRICKX, A. G.; BINKERD, P.; ROWLAND, J. Developmental Toxity and Nonhuman Primates: Interspecies Comparisons. In: KALTER, H. Issues and Reviews in Teratology. New York: Plenum, 1983, p.149-180. 120 HILLSON, S. Teeth. London: University Press, 1996, p.1-36. 283-323. HORNBECK, P. V.; SWINDLER, D. R. Morphology of the Lower Fourth Premolar of Certain Cercopithecidae. Journal of Dental Research, v. 46, p. 979-983, 1967. HOSEY, G. R. How does the zoo environment affect the behaviour of captive primates? Applied Animal Behaviour Science, n. 90, p. 107-129, 2005. HUNGERFORD, L. L.; MITCHELL, M. A.; NIXON, C. M.; ESKER, T. E.; SULLIVAN, J. B.; KOERKENMEIER, R.; MARRETTA, S. M. Periodontal and Dental Lesions in Raccoons From a Farming and a Recreational Area in Illinois. Journal of Wildlife Diseases, v. 35, n. 4, p. 728-734, 1999. HYLANDER, W. L. Incisor Size and Diet in Anthropoids With Special Reference to Cercopithecidae. Science, n. 189, p. 1095-1098, 1975. IBAMA. INSTITUTO BRASILEIRO DO MEIO AMBIENTE E DOS RECURSOS NATURAIS RENOVÁVEIS. Lista Nacional das Espécies da Fauna Brasileira Ameaçadas de Extinção, Brasil, 2007. Disponível em: http://www.mma.gov.br/port/rbf/fauna/. Acesso em: 15 abr. 2010. IUCN. INTERNATIONAL UNION FOR CONSERVATION ON NATURE. IUCN Red List Categories and Criteria Version 3.1. Switzerland, 2001. Disponível em http://www.canids.org/cap/Appendix2.pdf/. Acesso em: 24 fev. 2011. JOHNSON-DELANEY, C. A. Nonhuman Primate Dental Care. Journal of Exotic Pet Medicine, v. 17, n. 2, p. 138-143, 2008. KAKEHASHI, S.; BAER, P. N.; WHITE, C. L. Comparative pathology of periodontal disease. I. Gorilla. Oral Surgery, Oral Medicine and Oral Pathology, v. 16, n. 4, p. 397406, 1963. 121 KANAZAWA, E.; ROSENBERGER, A. L. Interspecific Allometry of the Mandible, Dental Arch, and Molar Area in Anthropoid Primates: Functional Morphology of Masticatory Components. Primates, v. 30, n. 4, p. 543-560, 1989. KINZEY, W. G.; NORKONK, M. A. Hardness as a Basis of Fruit Choice in two Sympatric Primates. American Journal of Physical Anthropology, n. 81, p. 5-15, 1990. KOWALESKY, J. Anatomia Dental de Cães (Canis familiaris) e Gatos (Felis catus). Considerações Cirúrgicas. 2005. 183f. Dissertação (Mestrado em Cirurgia) Faculdade de Medicina Veterinária e Zootecnia. Universidade de São Paulo. São Paulo, 2005. KRAUS, B. S.; GARRETT, W. S. Cleft Palate in a Marmoset: Report of a Case. Cleft Palate Journal, n. 5, p. 340-343, 1968. LASKA, M.; SALAZAR, L. T. H.; LUNA, E. R. Food Preferences and Nutrient Composition in Captive Spider Monkeys, Ateles geoffroyi. International Journal of Primatology, v. 21, n. 4, p. 671-683, 2000. LEGENDRE, L. F. J. Oral disorders of exotic rodents. The Veterinary Clinics Exotic Animal Practice, n. 6, p. 601-628, 2003. LOFFREDO, L. C.; DE SOUZA, J. M. P.; YUNES, J.; FREITAS, J. R. S.; SPIRL, W. C. Fissura lábio-palatais: estudo caso-controle. Revista Saúde Pública, n. 28, v. 3, p. 213-217, 1994. LOPES, F. M. Avaliação do sistema estomatognático e de sincrânios de lobo-guará (Chrysocyon brachyurus) em vida livre e cativeiro. 2008, 151f. Dissertação (Mestrado em Cirurgia) Faculdade de Medicina Veterinária e Zootecnia. Universidade de São Paulo, 2008. MACCLURE, H. M.; WILK, A. L.; HORIGAN, E. A.; PRATT, R. M. Induction of Craniofacial Malformations in Rhesus Monkeys (Macaca mulatta) with Cyclophosphamide. Cleft Palate Journal, v. 16, n. 3, p. 248-256, 1979. 122 MARTINS, L. B.; OLEJNICZAK, A. J.; MAAS, M. C. Enamel thickness and microstructure in pitheciin primates, with coments on dietary adaptations of the middle Miocene hominoid Kenyapithecus. Journal of Human Evolution, n. 45, p. 351-367, 2003. MILES, A. E. W.; GRIGSON, C. Colyer’s Variations and Diseases of the Teeth of Animals. Cambridge: Cambridge University Press, 2003. 672 p. NEWMAN, M. G.; TAKEI, H. H.; CARRANZA, F. A. Carranza’s Clinical Periodontology. 9th ed. Philadelphia: W. B. Saunders Company, 2002. 1033 p. PACHALY, J. R. Odontoestomatologia. In: CUBAS, Z. S.; SILVA, J. C. R.; CATÃO-DIAS, J. L. Tratado de Animais Selvagens – Medicina Veterinária. São Paulo: Roca, 2006. p. 1068. PENZHORN, B. L. Dental Abnormalities in Free-Ranging Cape Mountain Zebras (Equus zebra zebra). Journal of Wildlife Diseases, v. 20, n. 2, p. 161-166, 1984. POPOWICS, T. E.; FORTELIUS, M. On the Cutting Edge: Tooth Blade Sharpness in Herbivorous and Faunivorous Mammals. Annales Zoologici Fennici, n. 34, p. 73-88, 1997. RAVOSA, M. J.; ROSS, C. F. Craniodental Allometry and Heterochrony in Two Howler Monkeys: Alouatta seniculus and A. palliata. American Journal of Primatology, n. 22, p. 277-299, 1994. REITER, A. M.; MENDOZA, K. A. Feline odontoclastic resorptive lesions: An unsolved enigma in veterinary dentistry. The Veterinary Clinics of North America: Small Animal Practice, v. 32, n. 4, p. 791-837, 2002. ROSENBERGER, A. L. Evolution of Feeding Niches in New World Monkeys. American Journal of Physical Anthropology, n. 88, p. 525-562, 1992. ROSENBERGER, A. L.; KINZEY, W. G. Functional Patterns of Molar Occlusion in Platyrrhine Primates. American Journal of Physical Anthropology, v. 45, n. 2, p 281-297, 1976. 123 ROSSI JR, J. L. Estudo comparativo entre os achados clínicos de lesões orais em onçapintada (Panthera onca) e suçuarana (Puma concolor) mantidas em cativeiro no Estado de São Paulo e indivíduos de vida livre no Pantanal Sul Mato-Grossense. 2002. 97f. Dissertação (Mestrado em Medicina Veterinária) Faculdade de Medicina Veterinária e Zootecnia. Universidade Federal de São Paulo, 2002. ROSSI JR., J. L.. Técnicas de Captura e Contenção Físico-Química. In: CUBAS, Z. S.; SILVA, J. C. R.; CATÃO-DIAS, J. L. Tratado de Animais Selvagens – Medicina Veterinária. São Paulo: Roca, 2006. p. 992-1039. ROSSI JR., J. L. Avaliação do sistema estomatognático e de sincrânios de onça-pintada (Panthera onca) e puma (Puma concolor) capturados ou coletados em natureza. 2007. 132 f. Tese (Doutorado em Medicina Veterinária) - Faculdade de Medicina Veterinária e Zootecnia. Universidade de São Paulo, São Paulo, 2007. ROSSI JR, J. L.; GIOSO, M. A.; DA SILVA, J. C. R.; MARVULO, M. F. V. Prevalência de maloclusão em Panthera onca e Puma concolor mantidas em cativeiro no Estado de São Paulo. Brazilian Journal of Veterinary Reasearch and Animal Science, v. 40, n. 2, 2003. ROSSI JR., J. L.; GIOSO, M. A.; DOMINGUES-FALQUEIRO, L. M. Estudo comparativo sobre prevalência de doença periodontal em Panthera onca mantida em cativeiro e em indivíduos de natureza. Pesquisa Veterinária Brasileira, v. 27, n. 5, p. 209-214, 2007a. ROSSI JR, J. L.; GIOSO, M. A.; TELES, M. Q.; DOMINGUES-FALQUEIRO, L. M. Acompanhamento do crescimento dental em Puma concolor mantido em cativeiro. Pesquisa Veterinária Brasileira, v. 25, n. 5, p. 205-208, 2007b. RUSSO, S. E.; CAMPBELL, C. J.; DEW, J. L.; STEVENSON, P. R.; SUAREZ, S. A. A multi-forest comparison of dietary preferences and seed dispersal by Ateles spp. International Journal of Primatology, v. 26, n. 5, p. 1017-1037, 2005. 124 SÁ DE, R. M. L.; POPE, T. R.; STRUHSAKER, T. T.; GLANDER, K. E. Sexual dimorphism in canine lengh of wolly spider monkeys (Brachyteles arachnoids, E. Geoffroy 1806). International Journal of Primatology, v. 14, n. 5, p. 755-763, 1993. SHAW, J. C. M. Four Cases of Fourth Molar Teeth in South African Baboons. Journal of Anatomy, v. 62, p. 79-85, 1927. SIBAL, L. R.; SAMSON, K. J. Nonhuman Primates: A Critical Role in Current Disease Research. Institute for Laboratory Animal Research Journal, v. 42, n. 2, p. 74-84, 2001. SIEGEL, M. I.; DOYLE, W. J.; GEST, T. R.; INGRAHAM, A. S. A Comparison of Craniofacial Growth in Normal and Cleft palate Rhesus Monkeys. Cleft Palate Journal, v. 22, n. 3, p. 192-196, 1985. SIMÕES-LOPES, P. C. Morfologia do sincrânio do boto-cinza, Sotalia guianensis (P. J. Bénéden) (Cetácea, Delphinidae). Revista Brasileira de Zoologia, v. 23, n. 3, p. 652-660, 2006. SKINNER, M. F.; NEWELL, E. A. Localized hypoplasia of the primary canine in Bonobos, Orangutans, and Gibbons. American Journal of Physical Anthropology, v. 120, n. 1, p. 6172, 2003. SWINDLER, D. R. Primate Dentition: An introduction to the Teeth of Nonhuman Primates. United Kingdom: University Press, Cambridge, 2002, p.12-20. TAKAHASHI, J. A Literature Review of The Spider Monkey, Ateles sp., With Special Focus on Risk for Extinction. 2008. 27f. Degree Project (Veterinary Medicine Graduation) Faculty of Veterinary Medicine and Animall Sciences. Swedish University of Agricultural Sciences, 2008. UNGAR, P.; WILLIAMSON, M. Exploring the Effects of Tooth Wear on Functional Morphology: A Preliminary Study Using Dental Topographic Analysis. Palaeontologia Electonica, v. 3, n. 1, p. 1-18, 2000. 125 VALENÇA-MONTENEGRO, M. M.; MONTEIRO-DA-CRUZ, M. A. O., NETO, J. E., EVÊNCIO, L. B. Afecções dentárias e periodontais em sagüis (Callithrix jacchus Linnaeus, 1758) de vida livre do campus da UFRPE, Recife – PE. Resumo do XI Congresso Brasileiro de Primatologia, Porto Alegre, 13-18 fev de 2005. PUCRS, Livro de Resumos, p.172, 2005. VALKENBURGH, B. V. Incidence of Tooth Breakage Among Large, Predatory Mammals. The American Naturalist, v. 131, n. 2, p. 291-302, 1988. VERONA, C. E. S.; PISSINATTI, A. Primates – Primatas do Novo Mundo (Sagui, Macacoprego, Macaco-aranha, Bugio). In: CUBAS, Z. S.; SILVA, J. C. R.; CATÃO-DIAS, J. L. Tratado de Animais Selvagens. São Paulo: Roca, 2006. p. 358-377. VERSTRAETE, F. J. M.; VAN AARDE, R. J.; NIEUWOUDT, B. A.; MAUER, E.; KASS, P. H. The Dental Pathology of Feral Cats on Marion Island, Part I: Congenital, Developmental and Traumatic Abnormalities. Journal of Comparative Pathology, v. 115, p. 265-282, 1996a. VERSTRAETE, F. J. M.; VAN AARDE, R. J.; NIEUWOUDT, B. A.; MAUER, E.; KASS, P. H. The Dental Pathology of Feral Cats on Marion Island, Part II: Periodontitis, External Odontoclastic Resorption Lesions and Mandibular Thickening. Journal of Comparative Pathology, v. 115, n. 3, p. 283-297, 1996b. WALL, CHRISTINE E. A model of Temporomandibular Joint Function in Anthropoid Primates Based on Condylar Movements During Mastication. American Journal of Physical Anthropology, n. 109, p. 67-88, 1999. WENKER, C. J.; STICK, H.; MULLER, M.; LUSSI, A. A retrospective study of dental conditions of captive brown bears (Ursus arctos spp.) compared with free-ranging Alaskan grizzlies (Ursus arctos horribilis). Journal of Zoo and Wildlife Medicine, v. 30, n. 2, p. 208-221, 1999. 126 WHITE, F. Census and preliminary observations on the ecology of the black-faced spider monkey (Ateles paniscus chamek) in Manu National Park, Peru. American Journal of Primatology, n. 11, p. 125-132, 1986. WIGGS, R. B.; BLOOM, B. C. Exotic Placental Carnivore Dentistry. Veterinary Clinics Exotic Animal, n. 6, p. 571-599, 2003. WIGGS, R. B.; HALL, B. Nonhuman Primate Dentistry. Veterinary Clinics Exotic Animal, n. 6, p. 661-687, 2003. WIGGS, R. B.; LOBPRISE, H. B. Veterinary Dentistry: Principles & Practice. Philadelphia: Lippincott-Raven, 1997. 748 p. WINKLER, L. A. Morphology and Variability of Masticatory structures in the Orangutan. International Journal of Primatology, v. 12, n. 1, p. 45-65, 1991. WOBESER, G. Traumatic, degenerative, and developmental lesions in wolves and coyotes from Saskatchewan. Journal of Wildlife Diseases, v. 25, n. 2, p. 268-275, 1992. WOOD, B. A.; LI, Y.; WILLOUGHBY, C. Intraspecific variation and sexual dimorphism in cranial and dental variables among higher primates and their bearing on the hominid fossil record. Journal of Anatomy, n. 174, p. 185-205, 1991. 127 APÊNDICE 128 Apêndice A Identificação dos sincrânios avaliados segundo instituição, ano e local de coleta (Continua) Identificação 18 39 505 506 507 508 509 516 693a 693b 697 711 865 996 997 1007 1093 1094 1156 1157 1158 1159 1160 1162 1165 1166 1210 1215 1229 1234 1236 1237 1238 1239 1240 1242 1243 1245 1267 1268 1269 1270 1272 1273 1274 Ano de Coleta 1931 1911 1908 1908 Indeterminado 1908 1908 1932 1901 1901 1901 1935 1936 1936 1936 1936 Indeterminado Indeterminado 1937 1937 1937 1937 1937 1937 Indeterminado 1937 1961 1937 Indeterminado 1934 1936 1936 1936 1937 1936 1937 1937 1937 Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Local de Coleta Rio Xingu – Altamira - PA Rio Branco - AC Rio Jaurú – MT Rio Jaurú – MT MT Indeterminado Rio Jaurú – MT Jardim Zoológico Rio Juruá – AM Rio Juruá – AM Rio Juruá – AM Jardim Zoológico Rio Nhamundá – PA/AM Rio Vila Nova – Mazagão – AP Rio Vila Nova – Mazagão – AP Rio Vila Nova – Mazagão – AP Indeterminado Indeterminado Cachoeira do Tronco – Rio Erepecurú – PA Cachoeira do Tronco – Rio Erepecurú – PA Cachoeira do Tronco – Rio Erepecurú – PA Cachoeira do Tronco – Rio Erepecurú - PA Cachoeira do Tronco – Rio Erepecurú - PA Cachoeira do Tronco – Rio Erepecurú – PA Cachoeira do Tronco – Rio Erepecurú – PA Cachoeira do Tronco – Rio Erepecurú – PA Rio Jarí – Estirão do Equador – AM Rio Erepecurú - PA Rio Jarí – Ac. Das Cachoeiras – AM/PA Rio Vila Nova – Mazagão –AP Rio Vila Nova – Mazagão – AP Rio Vila Nova – Mazagão – AP Rio Vila Nova – Mazagão – AP Rio Vila Nova – Mazagão – AP Rio Vila Nova – Mazagão – AP Cachoeira do Tronco – Rio Erepecurú – PA Cachoeira do Tronco – Rio Erepecurú – PA Cachoeira do Tronco – Rio Erepecurú – PA Mapari – Macapá – AP Mapari – Macapá – AP Araguari – Macapá – AP Matapi – Macapá – AP Araguari – Macapá – AP Matapi – Macapá – AP Araguari – Macapá – AP Instituição MPEGi MPEGi MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MPEGi MZ-USPiii MZ-USPiii MZ-USPiii MPEGi MPEGi MPEGi MPEGi MPEGi MHN-UFRJii MHN-UFRJii MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi 129 Identificação dos sincrânios avaliados segundo instituição e ano e local de coleta (Continua) Identificação 1275 1277 1278 1279 1280 1486 1534 1569 1570 1571 1657 1702 1707 2160 2300 2403 2456 2460 2475 2476 2492 2495 2496 2497 2499 2500 2712 2713 2715 2720 4062 4063 4064 4065 4066 4068 4069 4070 4071 4072 4073 4074 4075 4076 4077 5027 5028 5029 5030 5031 Ano de Coleta Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado 1959 1959 1959 Indeterminado 1927 Indeterminado 1936 1953 Indeterminado 1927 1914 1927 Indeterminado Indeterminado Indeterminado Indeterminado 1927 1927 1927 Indeterminado 1909 Indeterminado 1913 1939 1944 Indeterminado 1939 Indeterminado 1915 1934 1946 1933 1934 1940 1936 1940 1911 1939 1918 1934 1913 1926 1933 Local de Coleta Araguari – Macapá – AP Araguari – Macapá – AP Araguari – Macapá- AP Araguari – Macapá – AP Araguari – Macapá – AP Tapajós – PA Tapajós – PA Mazagão – AP Mazagão – AP Mazagão – AP Indeterminado Paraná do Manhana – AM Indeterminado Pará Rio Amaparí – Macapá – AP Tem. Vasconcelos Paraná do Manhana – AM Aripuanã - Jamari Paraná do Manhana – AM Tem. Vasconcelos Rio Catrimani - RR Rio Catrimani - RR Rio Catrimani - RR Paraná do Manhana – AM Paraná do Manhana – AM Paraná do Manhana – AM Lago do Mapixi – Rio Purus – AM Piroculuima – Alto Ji-Paraná – RD Tem. Vasconcelos Jardim Zoológico Jardim Zoológico Jardim Zoológico Indeterminado Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Jardim Zoológico Taperinha - Santarém - PA Missão Cururu – PA Taperinha – Santarém - PA Taperinha – Santarém – PA Taperinha – Santarém - PA Instituição MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MHN-UFRJii MHN-UFRJii MHN-UFRJii MPEGi MPEGi MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi 130 Identificação dos sincrânios avaliados segundo instituição e ano e local de coleta (Continua) Identificação 5032 5033 5034 5035 5036 5037 5038 5039 5040 5041 5042 5043 5044 5045 5046 5047 5048 5049 5050 5051 5143 5144 5145 5146 5147 5148 5149 5150 5274 5280 5281 5282 5283 5285 5286 5287 5288 5600 5601 5602 5605 5606 5607 5683 5686 5687 6035 6036 6037 6976 Ano de Coleta 1915 1916 Indeterminado 1918 1918 Indeterminado 1933 1933 1933 1931 1933 1918 Indeterminado 1917 1934 1919 1920 1921 1934 1933 1915 1921 1939 1937 1939 1918 1939 1942 1936 1936 1935 1936 1936 1935 1936 1936 1936 1936 1936 1936 1936 1936 1936 1942 1934 1934 1939 1939 1939 1961 Local de Coleta Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém - PA Rio Eiru – Santa Cruz – AM Eirunepé – AM Rio Tapajós - Caxiricatuba – PA Rio Tapajós - Caxiricatuba – PA Rio Eirú – Santa Cruz – AM Rio Tapajós - Caxiricatuba – PA Rio Tapajós – Piquiatuba – PA Rio Tapajós – Caxiricatuba – PA Foz do Curuá-Uma – PA Foz do Curuá-Uma – PA Rio Eirú – Santa Cruz - AM Rio Eirú – Santa Cruz – AM Rio Tapajós – Caxiricatuba – PA Piquiatuba – Rio Tapajós – PA Rio Tapajós – Piquiatuba – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Taperinha – Santarém – PA Igarapé-Quibá – AM Rio Amazonas – Norte Igarapé Iniba – AM Rio Amazonas – Norte Igarapé Iniba – AM Est. Manaus – Rio Branco – Manaus – AM Instituição MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MPEGi MPEGi MPEGi MHN-UFRJii MHN-UFRJii MHN-UFRJii MPEGi 131 Identificação dos sincrânios avaliados segundo instituição e ano e local de coleta (Continua) Identificação 6979 6980 6981 6982 6983 6984 6985 6986 6987 6988 6989 6990 6991 6992 6993 6995 6996 7218 7227 7252 7254 8070 8121 8471 8474 8496 8498 8855 11745 11751 13240 13241 13242 13243 13244 13245 18955 19313 19314 19315 19316 19317 19318 19319 19320 19321 19322 19323 19324 19325 Ano de Coleta 1967 1967 1966 1966 1966 1966 1966 1967 1966 1967 1966 1966 1977 1967 1966 1965 1966 1965 1963 Indeterminado 1958 1955 1973 1973 1973 1973 1973 1977 1913 Indeterminado 1975 1976 1976 1974 1975 1975 1984 1962 1962 1962 1962 1962 1962 1966 1966 1966 1966 1962 1962 1962 Local de Coleta Est. AM 1, Km 175 – Manaus – AM Est. AM 1 – Km 190 – Manaus – AM Est. AM 1 – Km 175 – Manaus – AM Est. AM 1 – Km 165 – Manaus – AM Est. AM 1 – Km 190 – Manaus – AM Est. AM 1 – Km 165 – Manaus – AM Est. AM 1 – Km 175 – Manaus – AM Est. AM 1 – Km 175 – Manaus – AM Est. AM 1 – Km 185 – Manaus – AM Est. AM 1 – Km 190 – Manaus – AM Est. AM 1 – Km 175 – Manaus – AM Est. AM 1 – Km 185 – Manaus – AM Jardim Zoológico Est. AM 1 – Km 190 – Manaus – AM Est. AM 1 – Km 175 – Manaus – AM Est. AM 1 – Km 200 – Manaus – AM Est. AM 1 – Km 190 – Manaus – AM Est. AM 1 – Km 200 – Manaus – AM Est. AM 1 – Km 200 – Itacoatiara INPA – PA Alto Rio Cururu (Tapajós) - PA Cachimbo – PA Est. Santarém-Cuiabá Km 212 – PA Est. Santarém-Cuiabá Km 262 - PA Est. Santarém-Cuiabá Km 262 - PA Est. Tranzamazônica Km 212 – Itaituba – PA Est. Santarém-Cuiabá Km 165 – PA Jardim Zoológico Jardim Zoológico Indeterminado Humboldt – Aripuanã – MT Cachoeira Porteira – Oriximiná – PA Cachoeira Porteira – Oriximiná – PA Humboldt – Aripuanã – PA Humboldt – Aripuanã – PA Humboldt – Aripuanã – PA Santa Cruz da Serra – RO Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Fordlândia – PA Instituição MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MZ-USPiii MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MHN-UFRJii MHN-UFRJii MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii 132 Identificação dos sincrânios avaliados segundo instituição e ano e local de coleta (Continua) Identificação 19326 19327 19328 19329 19330 19543 20401 21057 21058 21616 21617 21618 21619 21620 21621 21622 21623 21796 21797 21798 21799 21800 21835 21870 21871 21873 22052 22788 23207 23208 23209 23210 23722 23723 23725 23726 23727 23728 25717 31293 32701 33603 33606 33607 33608 33609 33611 33613 33614 33615 Ano de Coleta 1970 1960 1962 1966 1966 1962 Indeterminado 1948 Indeterminado 1975 1978 Indeterminado 1979 1978 1979 1978 1979 1987 1987 1987 1987 1987 1987 Indeterminado 1987 1987 1988 1948 Indeterminado Indeterminado Indeterminado Indeterminado 1957 1956 1956 1952 1952 1956 1950 Indeterminado 1950 Indeterminado 1957 1957 1957 Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Local de Coleta Rio Tapajós – Barreira – PA Fordlândia – PA Santarém – PA Fordlândia – PA Fordlândia – PA Rio Tapajós – Urucurituba – PA Tem. Vasconcelos Várgea Fonte Boa – AM Várgea Fonte Boa – AM Est. Tranzamazônica Km 5 – PA Cachoeira Porteira – Oriximiná – PA Indeterminado Cachoeira Porteira – Oriximiná – PA Cachoeira Porteira – Oriximiná – PA Cachoeira Porteira – Oriximiná – PA Cachoeira Porteira – Oriximiná – PA Cachoeira Porteira – Oriximiná – PA Rio Jaamari – UHE de Samuel – RO Rio Jaamari – UHE de Samuel – RO Rio Jaamari – UHE de Samuel – RO Rio Jaamari – UHE de Samuel – RO Rio Jaamari – UHE de Samuel – RO México Serrinha – Mucajaí – RR Serrinha – Mucajaí – RR Serrinha – Mucajaí – RR Cachoeira Porteira – Oriximiná – PA Várgea Fonte Boa – AM Indeterminado Indeterminado Indeterminado Indeterminado Alto Cururu – PA Rio Arraias – Alto Xingu – MT Alto Xingu – MT Rio Paru de Leste – Almeirim – PA Rio Paru de Leste – Almeirim – PA Rio Arraias – Alto Xingu – MT Rio Teles Pires – Alto Tapajós – MT Cáceres – MT Rio Teles Pires – Alto Tapajós – MT Indeterminado Caruru-Assú – PA Caruru-Assú – PA Alto Cururu - PA Indeterminado Indeterminado Cáceres – MT Cáceres – MT Cáceres – MT Instituição MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MZ-USPiii MHN-UFRJii MHN-UFRJii MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MPEGi MHN-UFRJii MPEGi MPEGi MPEGi MPEGi MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii MHN-UFRJii 133 Identificação dos sincrânios avaliados segundo instituição e ano e local de coleta (Conclusão) Identificação Ano de Coleta Local de Coleta Instituição 33616 Indeterminado Cáceres – MT MHN-UFRJii 33617 Indeterminado Cáceres – MT MHN-UFRJii 33618 Indeterminado Cáceres – MT MHN-UFRJii 33619 Indeterminado Cáceres – MT MHN-UFRJii 33620 Indeterminado Cáceres – MT MHN-UFRJii 33621 Indeterminado Cáceres – MT MHN-UFRJii 39490 1995 Rio Cristalino – Margem Esquerda – MT MPEGi 39492 1995 Rio Cristalino – Margem Esquerda – MT MPEGi i MPEG – Museu Paraense Emílio Goeldi ii MHN-UFRJ – Museu Histórico Nacional da Universidade Federal do Rio de Janeiro iii MZ-USP – Museu de Zoologia da Universidade de São Paulo 134 Apêndice B Identificação dos sincrânios avaliados segundo espécie, sexo e habitat (Continua) Número 18 39 505 506 507 508 509 516 693a 693b 697 711 865 996 997 1007 1093 1094 1156 1157 1158 1159 1160 1162 1165 1166 1210 1215 1229 1234 1236 1237 1238 1239 1240 1242 1243 1245 1267 1268 1269 1270 1272 1273 1274 1275 Espécie Ateles belzebuth Ateles belzebuth Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles variegatus Ateles chamek Ateles chamek Ateles chamek Indeterminado Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Indeterminado Indeterminado Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Sexo Macho Fêmea Fêmea Fêmea Fêmea Macho Fêmea Fêmea Fêmea Fêmea Macho Macho Macho Fêmea Fêmea Fêmea Indeterminado Indeterminado Macho Macho Macho Fêmea Fêmea Fêmea Fêmea Fêmea Macho Fêmea Fêmea Macho Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Macho Fêmea Fêmea Fêmea Fêmea Habitat Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Cativeiro Vida livre Vida livre Vida livre Cativeiro Vida livre Vida livre Vida livre Vida livre Indeterminado Indeterminado Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre 135 Identificação dos sincrânios avaliados segundo espécie, sexo e habitat (Continua) Número 1277 1278 1279 1280 1486 1534 1569 1570 1571 1657 1702 1707 2160 2300 2403 2456 2460 2475 2476 2492 2495 2496 2497 2499 2500 2712 2713 2715 2720 4062 4063 4064 4065 4066 4068 4069 4070 4071 4072 4073 4074 4075 4076 4077 5027 5028 5029 5030 5031 5032 5033 Espécie Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles belzebuth Ateles belzebuth Ateles paniscus Ateles paniscus Ateles paniscus Indeterminado Ateles chamek Indeterminado Ateles paniscus Ateles paniscus Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles marginatus Ateles paniscus Indeterminado Indeterminado Ateles marginatus Indeterminado Ateles paniscus Ateles paniscus Ateles paniscus Ateles variegatus Ateles variegatus Ateles marginatus Ateles paniscus Indeterminado Ateles paniscus Ateles variegatus Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Sexo Fêmea Fêmea Fêmea Fêmea Macho Macho Indeterminado Indeterminado Indeterminado Indeterminado Fêmea Indeterminado Macho Macho Indeterminado Macho Indeterminado Fêmea Indeterminado Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Macho Indeterminado Macho Fêmea Macho Macho Fêmea Fêmea Fêmea Fêmea Fêmea Macho Fêmea Fêmea Macho Fêmea Macho Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Habitat Vida livre Vida livre Vida livre Vida livre Vida Livre Vida livre Vida livre Vida livre Vida livre Indeterminado Vida livre Indeterminado Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Cativeiro Cativeiro Cativeiro Indeterminado Cativeiro Cativeiro Cativeiro Cativeiro Cativeiro Cativeiro Cativeiro Cativeiro Cativeiro Cativeiro Cativeiro Cativeiro Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre 136 Identificação dos sincrânios avaliados segundo espécie, sexo e habitat (Continua) Número 5034 5035 5036 5037 5038 5039 5040 5041 5042 5043 5044 5045 5046 5047 5048 5049 5050 5051 5143 5144 5145 5146 5147 5148 5149 5150 5274 5280 5281 5282 5283 5285 5286 5287 5288 5600 5601 5602 5605 5606 5607 5683 5686 5687 6035 6036 6037 6976 6979 6980 6981 Espécie Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles marginatus Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles marginatus Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles marginatus Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles chamek Ateles chamek Ateles marginatus Ateles marginatus Ateles chamek Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles chamek Ateles chamek Ateles marginatus Ateles marginatus Ateles marginatus Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles chamek Ateles chamek Ateles chamek Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Sexo Macho Fêmea Macho Macho Fêmea Fêmea Fêmea Fêmea Macho Fêmea Fêmea Fêmea Fêmea Macho Fêmea Indeterminado Fêmea Fêmea Fêmea Macho Macho Fêmea Macho Fêmea Fêmea Fêmea Fêmea Macho Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Macho Fêmea Macho Fêmea Fêmea Fêmea Macho Fêmea Fêmea Macho Macho Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Habitat Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre 137 Identificação dos sincrânios avaliados segundo espécie, sexo e habitat (Continua) Número 6982 6983 6984 6985 6986 6987 6988 6989 6990 6991 6992 6993 6995 6996 7218 7227 7252 7254 8070 8121 8471 8474 8496 8498 8855 11745 11751 13240 13241 13242 13243 13244 13245 18955 19313 19314 19315 19316 19317 19318 19319 19320 19321 19322 19323 19324 19325 19326 19327 19328 19329 Espécie Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Indeterminado Indeterminado Ateles belzebuth Ateles marginatus Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles paniscus Ateles belzebuth Ateles paniscus Ateles marginatus Indeterminado Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles marginatus Ateles chamek Ateles marginatus Ateles marginatus Ateles marginatus Sexo Fêmea Fêmea Macho Fêmea Fêmea Fêmea Fêmea Indeterminado Fêmea Macho Fêmea Indeterminado Fêmea Fêmea Indeterminado Indeterminado Indeterminado Fêmea Fêmea Macho Fêmea Fêmea Fêmea Macho Macho Macho Indeterminado Fêmea Fêmea Fêmea Macho Fêmea Fêmea Macho Macho Fêmea Fêmea Fêmea Macho Macho Macho Macho Macho Macho Fêmea Macho Fêmea Macho Macho Fêmea Fêmea Habitat Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Cativeiro Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Cativeiro Cativeiro Indeterminado Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre 138 Identificação dos sincrânios avaliados segundo espécie, sexo e habitat (Continua) Número 19330 19543 20401 21057 21058 21616 21617 21618 21619 21620 21621 21622 21623 21796 21797 21798 21799 21800 21835 21870 21871 21873 22052 22788 23207 23208 23209 23210 23722 23723 23725 23726 23727 23728 25717 31293 32701 33603 33606 33607 33608 33609 33611 33613 33614 33615 33616 33617 33618 33619 33620 Espécie Ateles marginatus Ateles marginatus Ateles chamek Ateles chamek Ateles chamek Ateles belzebuth Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles paniscus Ateles geoffroyi Ateles belzebuth Ateles belzebuth Ateles belzebuth Ateles paniscus Ateles chamek Indeterminado Indeterminado Indeterminado Indeterminado Ateles marginatus Ateles marginatus Ateles marginatus Ateles paniscus Ateles paniscus Ateles marginatus Ateles marginatus Ateles chamek Ateles marginatus Indeterminado Ateles marginatus Ateles marginatus Ateles marginatus Indeterminado Indeterminado Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles chamek Ateles chamek Sexo Macho Fêmea Indeterminado Macho Fêmea Macho Macho Fêmea Macho Fêmea Macho Fêmea Fêmea Macho Macho Macho Fêmea Macho Fêmea Fêmea Fêmea Fêmea Fêmea Fêmea Indeterminado Indeterminado Indeterminado Fêmea Macho Fêmea Macho Fêmea Fêmea Macho Fêmea Fêmea Macho Indeterminado Macho Macho Macho Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Indeterminado Habitat Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Indeterminado Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Indeterminado Indeterminado Indeterminado Indeterminado Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Indeterminado Vida livre Vida livre Vida livre Indeterminado Indeterminado Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre Vida livre 139 Identificação dos sincrânios avaliados segundo espécie, sexo e habitat (Conclusão) Número 33621 39490 39492 Espécie Ateles chamek Ateles marginatus Ateles marginatus Sexo Indeterminado Fêmea Macho Habitat Vida livre Vida livre Vida livre 140 ANEXOS 141 Anexo A - Ficha odontológica (odontograma) específica para primatas, desenvolvida pelo Laboratório de Odontologia Comparada (LOC), vinculado ao Departamento de Cirurgia da Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo (FMVZ-USP)
Download