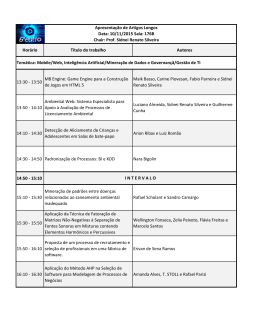
PROPRIEDADES COLIGATIVAS Prof. Sidnei PROPRIEDADES COLIGATIVAS Um “efeito coligativo” é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, a qual depende do número de partículas (moléculas ou íons) dissolvidas e da temperatura ! Prof. Sidnei pressão (atm) T temperatura(°C) Prof. Sidnei PROPRIEDADES COLIGATIVAS SOLUÇÕES IÔNICAS ÁCIDOS BASES SAIS Prof. Sidnei PROPRIEDADES COLIGATIVAS Exemplos: HCl H+ + ClH2SO4 2H+ + SO42NaOH Na+ + OHCa(OH)2 Ca2+ + 2OHNaCl Na+ + ClFeCl3 Fe3+ + 3 ClNaNO3 Na+ + NO3Na2CO3 2Na+ + CO32Al2(SO4)3 2Al3+ + 3SO42C6H12O6 C6H12O6 C12H22O11 C12H22O11 (2 partículas) (3 partículas) (2 partículas) (3 partículas) (2 partículas) (4 partículas) (2 partículas) (3 partículas) (5 partículas) (1 molécula) Prof. Sidnei (1 molécula) PRESSÃO DE VAPOR É PRESSÃO QUE OS VAPORES EXERCEM EM DETERMINADA TEMPERATURA Prof. Sidnei Prof. Sidnei VÁCUO ÁGUA 0 mmHg a 20°C TEMPO ÁGUA 17,5 mmHg a 20°C Temos um líquido que se encontra em um recipiente fechado e que o líquido a tampa do A pressão que entre o vapor exerceeno tem denomina-se vácuo equilíbriorecipiente líquido-vapor de PRESSÃO MÁXIMA DE VAPOR e, Inicialmente o líquido evapora rapidamente depois esta evaporação vai diminuindo, até ficar constante Prof. Sidnei FATORES QUE INFLUEM NA PRESSÃO MÁXIMA DE VAPOR ÁGUA 26 mmHg a 27°C ÁGUA 79 mmHg a 47°C TEMPERATURA EM QUE SE ENCONTRA O LÍQUIDO Prof. Sidnei FATORES QUE INFLUEM NA PRESSÃO MÁXIMA DE VAPOR ÁGUA 17,5 mmHg a 20°C ÉTER 442 mmHg a 20°C NATUREZA DO LÍQUIDO Líquidos MAIS VOLÁTEIS possuem MAIOR PRESSÃO MÁXIMA DE VAPOR Prof. Sidnei Efeito Tonoscópico ou TONOSCOPIA Consiste na DIMINUIÇÃO da PRESSÃO DE VAPOR do solvente quando adiciona-se um soluto não-volátil ! Prof. Sidnei EFEITO TONOSCÓPICO Prof. Sidnei Prof. Sidnei Prof. Sidnei A EBULIÇÃO DE UM LÍQUIDO Quando um líquido está sendo aquecido, algumas moléculas colidem violentamente entre si e tornam-se livres Estas bolhas não sobem à superfície Com isso, forma-se porções de imediatamente, isto só ocorre quando vapores no interior da massa líquida, a pressão dentro da bolha iguala-se à constituindo desta forma as bolhas pressão externa A esse fenômeno damos o nome de EBULIÇÃO Prof. Sidnei TEMPERATURA DE EBULIÇÃO PONTO DE EBULIÇÃO: P.V.líquido = Pressão atmosférica Prof. Sidnei Efeito Ebulioscópico ou EBULIOSCOPIA Consiste no AUMENTO da TEMPERATURA DE EBULIÇÃO do solvente quando adiciona-se um soluto não-volátil. Prof. Sidnei TEMPERATURA DE EBULIÇÃO PONTO DE EBULIÇÃO: P.V.líquido = Pressão atmosférica Prof. Sidnei EBULIOSCOPIA EBULIOSCOPIA CONCENTRAÇÃO P.M.V. P.E. Prof. Sidnei EFEITO CRIOSCÓPICO ou CRIOSCOPIA Consiste na DIMINUIÇÃO da TEMPERATURA DE CONGELAMENTO do solvente quando adicionase um soluto não-volátil. Prof. Sidnei CRIOSCOPIA CRIOSCOPIA Prof. Sidnei OSMOMETRIA ou OSMOSCOPIA Consiste no AUMENTO da PRESSÃO OSMÓTICA do solvente quando adiciona-se um soluto não-volátil. OSMOSE: passagem de solvente do meio menos para o mais concentrado através da M.S.P. PRESSÃO OSMÓTICA: é a pressão aplicada à solução mais concentrada para bloquear a entrada de solvente Prof. Sidnei É a pressão externa que deve ser aplicada a uma solução mais concentrada para evitar a sua diluição por meio de uma membrana semipermeável Prof. Sidnei OSMOSE • HIPOTÔNICO Meio de baixa concentração • HIPERTÔNICO Meio de alta concentração Prof. Sidnei • ISOTÔNICO Soluções de mesma concentração EFEITO TONOSCÓPICO - uma toalha úmida com água do mar demora mais para secar do que com água da torneira. O sal baixa a pressão de vapor e diminui a volatilidade. EFEITO EBULIOSCÓPICO - o “caldo da sopa” ferve a uma temperatura superior à da água da torneira. EFEITO CRIOSCÓPICO - a água do mar, nos pólos, não congela pela presença de elevada quantidade de sais dissolvidos. EFEITO OSMOSCÓPICO - adicionando açúcar à salada de frutas, aumenta o volume do caldo; - pobre lesma quando nela adicionamos sal !!! Prof. Sidnei CONCENTRAÇÃO PRESSÃO DE VAPOR (TONOSCOPIA) PONTO DE EBULIÇÃO (EBULIOSCOPIA) PONTO DE CONGELAMENTO (CRIOSCOPIA) PRESSÃO OSMÓTICA (OSMOSCOPIA) VOLATILIDADE Prof. Sidnei FORMULÁRIO TONOSCOPIA P/P1 = kt . W EBULIOSCOPIA Te = ke . W CRIOSCOPIA Tc = kc . W OSMOSCOPIA = M.R.T Fator de Van’t Hoff i = 1 + (q - 1) Prof. Sidnei (UECE) Seguindo os passos do químico francês François-Marie Raoult (1830-1901), pesquisando sobre o efeito ebuliométrico nas soluções, um estudante de química dissolveu 90 g de glicose (C6H12O6) em 400 g de água e aqueceu o conjunto. Sabendo que Ke da água = 0,52 ºC . kg/mol, depois de algum tempo, a temperatura inicial de ebulição por ele encontrada foi a) 99,85 ºC. b) 100,15 ºC. c) 100,50 ºC. d) 100,65 ºC. 1 mol --------- 180 g x ------------ 90 g x = 0,5 mol 0,26ºC --------- 0,4 kg z -------------- 1 kg z = 0,65ºC 0,52ºC --------- 1 mol y -------------- 0,5 mol y = 0,26ºC RESPOSTA: 100ºC + 0,65ºC = 100,65ºC Prof. Sidnei (UCS RS) O etilenoglicol, C2H4(OH)2, é colocado nos radiadores de carros, em países de clima muito frio, para evitar o congelamento da água, o que ocasionaria a ruptura do radiador quando a temperatura ficasse abaixo de 0 ºC. Determine a massa, em gramas, de etilenoglicol a ser adicionada, por quilograma de água, para que a solidificação só tenha início a –37,2 ºC, é de Dado: Constante criométrica da água = 1,86 ºC.kg/mol 1,86ºC --------- 1 mol 37,2ºC --------- x x = 20 mol 1 mol --------- 62 g 20 mols------- y y = 1240 g Prof. Sidnei (UFG GO) Dois frascos com água, com capacidade de 500 mL cada um foram colocados no congelador de um refrigerador doméstico. Em um, dissolveu-se 175,0 de sal de cozinha. Por falha na vedação térmica da porta, a temperatura mínima obtida no congelador é de –12ºC. Considerando que a constante do ponto de congelamento da água (Kc) é de 1,86ºC.kg.mol-1, pergunta-se: os líquidos dos dois frascos irão solidificar? Justifique. 1 mol --------- 58,5 g x ------------ 175 g x = 3 mols 5,58ºC --------- 0,5 kg z -------------- 1 kg z = 11,16ºC 1,86ºC --------- 1 mol y -------------- 3 mols y = 5,58ºC NaCl forma 2 partículas, logo 11,16ºC x 2 = 22,32ºC A solução de NaCl congela a - 22,32ºC Prof. Sidnei
Baixar