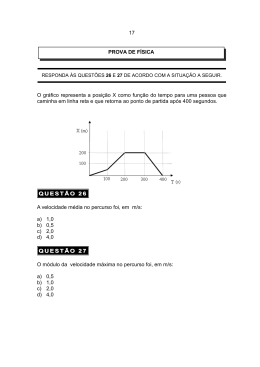
Trabalho de Expansão Vamos discutir a expressão matemática da quantidade de energia trocada entre um sistema e sua vizinhança quando o volume do sistema varia. Assim, vamos supor que o sistema tem uma pequena variação de volume ∆V, passando de V para V + ∆V sob o efeito de uma pressão externa Pe. Aqui devemos observar que se ∆V é positivo, o volume do sistema aumenta e se ∆V é negativo, o volume do sistema diminui. A cada elemento de superfície ∆S da fronteira do sistema associamos um vetor ∆A, de módulo igual à área do elemento de superfície, direção perpendicular a ele e sentido de dentro para fora (Fig.46(a)). A força externa que atua sobre um elemento de superfície da fronteira do sistema pode ser escrita: ∆Fe = − Pe ∆A O sinal negativo indica que esta força externa tem sentido contrário ao vetor ∆A (Fig.46(b)). Se esse elemento de superfície tem um deslocamento infinitesimal ∆d, a correspondente quantidade de energia trocada entre o sistema e a vizinhança, relativa ao trabalho associado a esta força externa, é: ∆W*e = ∆Fe ⋅ ∆d = − Pe ∆A ⋅ ∆d Quando levamos em conta todos os elementos de superfície da fronteira do sistema, a correspondente quantidade de energia trocada entre o sistema e a vizinhança, relativa ao trabalho associado às forças externas, é: ∆W e = Σ ∆W*e = − Pe ( Σ ∆A ) ⋅ ∆d = − Pe ( Σ ∆A ) ∆d = − Pe A∆d ou ∆W e = − Pe ∆V Grupo de Ensino de Física da Universidade Federal de Santa Maria em que Σ representa a soma sobre todos os elementos de superfície e A representa a área da fronteira do sistema. Nesse ponto, devemos observar o seguinte: • Quando ∆V > 0, o sistema se expande. Então, ∆W e < 0 e a energia flui do sistema para a vizinhança. • Quando ∆V < 0, o sistema se contrai. Então, ∆W e > 0 e a energia flui da vizinhança para o sistema. Até agora consideramos a variação de volume ∆V do sistema como sendo pequena. Assim, a quantidade de energia ∆W e trocada entre o sistema e a vizinhança também é pequena. Agora vamos considerar uma variação de volume de qualquer magnitude (finita). Qualquer variação finita de volume pode ser pensada como uma seqüência de pequenas variações de volume, de modo que a correspondente quantidade de energia trocada entre o sistema e a vizinhança, relativa ao trabalho associado às forças externas, é dado pela soma We = Σ ∆W e, ou seja: We = − Σ Pe ∆V Por outro lado, pela terceira lei de Newton, as forças do sistema sobre a vizinhança são iguais em módulo e direção, mas de sentido contrário, às forças externas que atuam sobre o sistema. Portanto, podemos representar a quantidade de energia trocada entre o sistema e a vizinhança relativamente ao trabalho associado às forças do sistema sobre a vizinhança pela expressão: W = Σ Pe ∆V Esta expressão é geral. Aqui é bom lembrar que Pe representa, ainda, a pressão externa (da vizinhança) sobre o sistema. Contudo, se o processo de variação do volume do sistema é reversível, tem sentido falar na pressão P do sistema e mais, em todos os estados pelos quais passa o sistema no processo de variação de volume, a pressão do sistema é igual à pressão externa. Portanto, se a variação de volume é pequena podemos escrever: ∆W = P∆V (processo reversível) Nesse ponto, devemos observar o seguinte: • Quando ∆V > 0, o sistema se expande. Então, ∆W > 0 e a energia flui do sistema para a vizinhança. • Quando ∆V < 0, o sistema se contrai. Então, ∆W < 0 e a energia flui da vizinhança para o sistema. Se a variação de volume do sistema tem magnitude (finita): W = Σ P∆V (processo reversível) A vantagem desta expressão sobre a expressão W = Σ Pe ∆V é que podemos calcular o somatório do lado direito se conhecemos a equação de estado do sistema, ou seja, se conhecemos a expressão matemática que relaciona a pressão e o volume. Grupo de Ensino de Física da Universidade Federal de Santa Maria Processo Isobárico Reversível Se o volume do sistema varia de V1 para V2 por um processo isobárico e reversível, com o sistema sendo mantido a uma pressão P0 (Fig.47), temos: W = Σ P∆V = P0 Σ ∆V = P0 ( V2 − V1 ) Esse resultado mostra que a quantidade de energia que o sistema troca com a vizinhança corresponde à área entre o gráfico do processo isobárico no plano PV e o eixo dos volumes entre V1 e V2. No caso particular em que o sistema é formado por uma amostra de gás ideal: W = PV2 − PV1 =nR ( T2 − T1 ) Processo Isotérmico Reversível A quantidade de energia trocada entre o sistema formado por uma amostra de gás ideal e a vizinhança, no caso em que o volume do sistema varia de V1 para V2 por um processo isotérmico reversível (Fig.48), é dada pela expressão: V W = nRT ln 2 V1 Grupo de Ensino de Física da Universidade Federal de Santa Maria Observação No caso do processo isobárico reversível, concluímos que a quantidade de energia que o sistema troca com a vizinhança, em correspondência ao trabalho associado às forças do sistema sobre a vizinhança, é dada pela área entre o gráfico do processo no plano PV e o eixo dos volumes entre V1 e V2. Essa conclusão é de caráter geral, isto é, vale para todos os processos reversíveis. A partir dessa interpretação, podemos entender que a quantidade de energia mencionada depende do processo que liga os estados inicial e final porque áreas diferentes estão associadas a processos diferentes. Exercício 1 Uma amostra de 1000 mol de gás ideal percorre reversivelmente, por 10 vezes, o ciclo mostrado na Fig.49. (a) Calcule a quantidade de energia trocada por trabalho entre a amostra de gás e a vizinhança. (b) Indique o sentido em que o ciclo deve ser percorrido para que a quantidade de energia associada ao trabalho da amostra sobre a vizinhança seja positiva. Exercício 2 Um mol de gás ideal, inicialmente à temperatura de 300 K, é submetido ao processo termodinâmico ABCD (Fig.50). Determine a quantidade de energia associada ao trabalho do gás sobre a vizinhança nesse processo. Grupo de Ensino de Física da Universidade Federal de Santa Maria Exercício 3 Uma amostra de gás ideal à temperatura TA e à pressão PA é comprimida reversivelmente até que seu volume fique reduzido à metade. A temperatura da amostra de gás é alterada no processo, mas a relação P = kV, em que k é constante, é satisfeita em todos os estados intermediários. (a) Represente o processo no diagrama PV. (b) Determine, em termos de n, R e TA, a quantidade de energia associada ao trabalho da amostra de gás sobre a vizinhança. Exercício 4 Uma amostra de dois mols de um gás ideal tem pressão P1 = 2 atm e volume V1 = 4 litros. Então, a temperatura da amostra é aumentada, a volume constante, até que a pressão fique duplicada. Depois, a amostra é expandida isotermicamente até que a pressão volte ao seu valor inicial. Finalmente, a amostra é comprimida, a pressão constante, até que o seu volume volte ao valor inicial. (a) Represente todo processo num diagrama PV. (b) Determine a quantidade de energia associada ao trabalho da amostra de gás sobre a vizinhança em cada etapa do processo. Grupo de Ensino de Física da Universidade Federal de Santa Maria
Download