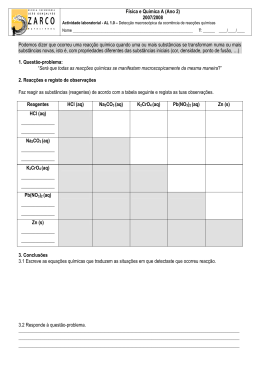
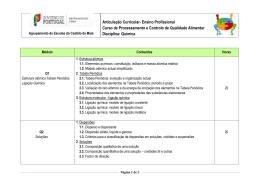
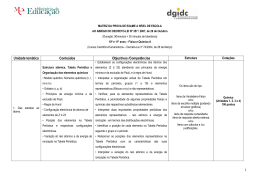
EXAME DE EQUIVALÊNCIA À FREQUÊNCIA Disciplina: Ciências Físico-Químicas Código: 382 MATRIZ Componente de Formação: Específica Tipo de prova: Escrita Duração da Prova: 90 min Objectivos Conteúdos Estrutura Tipo de item Cotação em pontos Física • • • • • • • Interpretar e aplicar as três leis de Newton. Enunciar e aplicar a lei da gravitação universal. Caracterizar e calcular deslocamento, espaço e aceleração. Definir movimentos rectilíneos uniformes e uniformemente variados e aplicar as equações correspondentes. Caracterizar o movimento de um projéctil lançado horizontalmente com efeito da resistência do ar desprezável explicando-o como a sobreposição de dois movimentos. Caracterizar o movimento de um satélite geoestacionário explicando-o como um movimento circular com velocidade de módulo constante. Caracterizar e relacionar as grandezas do movimento circular e uniforme. • Leis de Newton Lei da gravitação universal. • Movimentos próximos da superfície da Terra. • Questões do tipo: • Verdadeiro/falso; • Resposta curta; • Associação; • Resposta dirigida, envolvendo cálculos e / ou pedido de justificação. Interpretação de gráficos e tabelas. 100 Critérios de Classificação Nas correcções das provas devem ser tidos em conta os seguintes aspectos: 1. Coordenação lógica de ideias, clareza e precisão de vocabulário. 2. Desvalorização por falta ou incorrecção: • das unidades; • das equações de definições; • dos cálculos; • das justificações, quando pedida. Objectivos • • • • • • • • • Interpretar e traçar gráficos de movimentos uniformes, variados e compostos. Interpretar a propagação de um sinal por meio de um modelo ondulatório. Relacionar as grandezas associadas ao modelo ondulatório (amplitude, frequência, período e velocidade). Reconhecer e descrever um sinal harmónico simples através da função A sin ωt. Interpretar os mecanismos de propagação de um sinal sonoro. Relacionar as características do som (intensidade, altura e timbre) com as características das ondas. Identificar sons harmónicos e complexos. Conhecer, interpretar e aplicar os conceitos inerentes ao funcionamento de um altifalante e de um microfone (campo eléctrico, campo magnético, linhas de campo, indução electromagnética, fluxo magnético e força electromotriz). Conhecer e aplicar as leis da indução electromagnéticas. Distinguir sinal analógico de sinal digital. Distinguir um sinal modulado em amplitude, AM, de um de um sinal modelado em frequência; FM. • Conhecer e interpretar os fenómenos de reflexão, refracção e difracção. • Conhecer e aplicar as leis da refracção e da reflexão. • • Conteúdos Estrutura Tipo de item Cotação em pontos Critérios de Correcção 3. Em questões • Comunicação de informação a curtas distâncias: ∗ Transmissão de sinais; ∗ Som; ∗ Microfone e altifalante. • Comunicação a longas distâncias. ∗ A radiação electromagnética na comunicação; ∗ Propriedades das ondas: Reflexão; relacionadas, se o aluno se servir de dados incorrectos, obtidos em cálculos anteriores, deverá atribuir-se a cotação integral. Objectivos Conteúdos Refracção; Difracção. Química • • • • • • • • • • • • Reacções químicas e equações químicas. Quantidade em química. • Informação quantitativa de fórmulas químicas e de equações químicas. • Rendimento de uma reacção química. Identificar o azoto e o hidrogénio como matérias primas para a produção industrial do amoníaco. Compreender o significado de fórmulas químicas. Utilizar o conceito de mole e de volume molar de gases (PTN). Realizar cálculos sobre concentrações de soluções. Interpretar equações químicas e realizar cálculos estequiométricos, tendo em atenção o grau de pureza dos reagentes, o reagente limitante e o rendimento de uma reacção. • Classificar e interpretar as reacções químicas em função de energia envolvida na ruptura e formação de ligações químicas. Identificar equações químicas como um sistema de equilíbrio dinâmico. Escrever e aplicar as expressões matemáticas que traduzem a constante de equilíbrio. Relacionar a extensão de uma reacção com os valores de Kc dessa reacção. Relacionar os valores de Kc com a constante de equilíbrio da reacção inversa. Calcular o quociente da reacção, Q, e, com base no seu valor, prever o sentido da progressão da reacção relativamente a um estado de equilíbrio. Referir os factores que podem alterar o estado de • Aspectos energéticos das reacções químicas. • Equilíbrio químico. • Quociente de reacção. Estrutura Tipo de item Cotação em pontos Critérios de Correcção Objectivos • • • • • • • • • • • • equilíbrio de uma mistura reaccional. Identificar e aplicar a Lei de Le Chatelier. Interpretar o comportamento ácido - base em termos de transferência de iões H+ Caracterizar pares conjugados ácido - base. Efectuar cálculos de pH. Caracterizar o fenómeno de auto-ionização da água. Estabelecer as relações existentes entre a concentração do hidrogénio e a concentração do ião hidróxido, resultante da auto - ionização da água. Diferenciar reacções de ionização de “reacções” de dissociação. Comparar as constantes de acidez, Ka, e de basicidade, Kb, de um par ácido - base conjugados. Interpretar o comportamento ácido - base de soluções aquosas de sais. Interpretar curvas de titulação. Realizar cálculos inerentes à titulação ácido - base. Caracterizar, no ponto de equivalência, as soluções resultantes de uma volumetria ácido - base. Explicitar o significado da ligação iónica distinguindo-a da ligação covalente. • Classificar as ligações químicas com base nos valores de electronegatividades dos elementos. • Conteúdos • Alteração do estado de equilíbrio de um sistema. • Reacções ácido - base. • Ligações químicas nos sais. Estrutura Tipo de item Cotação em pontos 100 • • Identificar as reacções de oxidação - redução. Identificar espécies oxidantes e redutores. • Conceitos de reacção de oxidação - redução. Critérios de Correcção Objectivos Identificar, numa reacção de oxidação - redução os respectivos pares conjugados. • Prever a ocorrência ou não de uma reacção de oxidação - redução com base na série electroquímica. Conteúdos Estrutura Tipo de item Cotação em pontos Critérios de Correcção • Relacionar a concentração de soluções saturadas e não saturadas numa determinada substância com a solubilidade respectiva a uma determinada pressão e temperatura. • Relacionar a solubilidade, s, com a constante do produto de solubilidade, Ks. • Relacionar o quociente da reacção com a constante do produto de solubilidade. • Referir os factores que podem alterar a solubilidade de sais. Prever a solubilidade de um sal quando se verifica uma variação da temperatura ou da concentração. • • Força relativa de oxidantes e redutores. • Dissolução de sais. • Formação de precipitados. Variação da solubilidade de sais. • Solubilização de precipitados. • Material necessário: Material de escrita (tinta azul ou pre- Material não permitido: Lápis, corrector e Tabela Periódica. ta), régua e calculadora gráfica.
Baixar