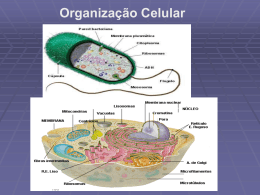
Universidade do Vale do Paraíba Instituto de Pesquisa e Desenvolvimento " AVALIAÇÃO DO PROCESSO DE MORTE CELULAR APÓS TERAPIA FOTODINÂMICA" Nilcenéia Soares Martines Dissertação de Mestrado apresentada no Programa Engenharia de Pós-Graduação Biomédica, em como complementação dos créditos necessários para obtenção do título de Mestre em Engenharia Biomédica. São José dos Campos, SP 2003 Universidade do Vale do Paraíba Instituto de Pesquisa e Desenvolvimento " AVALIAÇÃO DO PROCESSO DE MORTE CELULAR APÓS TERAPIA FOTODINÂMICA" Nilcenéia Soares Martines Dissertação de Mestrado apresentada no Programa Engenharia de Pós-Graduação Biomédica, em como complementação dos créditos necessários para obtenção do título de Mestre em Engenharia Biomédica. Orientadora: Profª. Drª. Cristina Pacheco Soares São José dos Campos, SP 2003 M336a Martines, Nilcenéia Soares Avaliação do Processo de Morte Celular Após a Terapia Fotodinâmica / Nilcenéia Soares Martines. São José dos Campos: Univap, 2003. 85p. il.; 31cm. Dissertação de Mestrado apresentada ao Programa de Pós Graduação Engenharia Biomédica do Instituto de Pesquisa e Desenvolvimento da Universidade do Vale do Paraíba, 2003. 1.Terapia Fotodinâmica 2. Zinco ftalocianina 3. Lasers 4. Fotossensibilizantes I. Soares, Cristina Pacheco, Orient. II. Título CDU:615.831 Autorizo, exclusivamente para fins acadêmicos e científicos, a reprodução total ou parcial desta dissertação, por processo fotocopiador ou transmissão eletrônica. Assinatura do aluno: Data: “AVALIAÇÃO DA MORTE CELULAR APÓS A TERAPIA FOTODINÂMICA” Nilcenéia Soares Martines Banca Examinadora: Prof. Dr. Egberto Munin, Presidente (UNIVAP)________________________________ Profª. Drª. Cristina Pacheco Soares, Orientadora (UNIVAP)______________________ Profª. Drª. Claudia Barbosa Ladeira de Campos (UNICAMP)_____________________ Prof. Dr. Marcos Tadeu Tavares Pacheco Diretor do IP&D - UNIVAP São José dos Campos, 10 de junho de 2003. DEDICATÓRIA À Deus força divina que nos mantém vivos, fonte de toda sabedoria. Aos meus pais; Avelino Rufo Padim Martines e Olga Soares Martines, fonte eterna de amor e de luz, os quais me deram a própria vida, o próprio nome, a própria honra. Ao meu namorado Alessandro Adriano pela ajuda, amor e companheirismo que soube compreender minha ausência acreditando sempre nesta realização pessoal, encorajando-me a superar os momentos de dificuldades na vida e na elaboração deste trabalho. A Nivaldo e Luciana Martines pelo suporte fundamental, carinhoso e sólido que estiveram sempre presentes. À toda minha família irmãos, irmã, cunhadas, cunhado e sobrinhos, pelas palavras e gestos de encorajamento e confiança em todos meus passos. AGRADECIMENTOS À Profª . Drª . Cristina Pacheco Soares pela oportunidade em tê-la como orientadora, por sua competência e amor à pesquisa, paciência e dedicação nos ensinamentos e por suas palavras sempre carinhosas em todos os momentos. “Os Mestres ideais são os que se fazem de pontes e convidam os alunos a atravess-las, então, tendo facilitado a travessia desmoronam-se com prazer, encorajando-os a criarem as suas próprias pontes” Ao Profº Dr. Newton Soares pela valorosa colaboração e apoio durante o processamento e análise dos espécimes ao Microscópio Eletrônico além do auxílio dado durante a elaboração desta tese. Às amigas de mestrado, em especial Lilian Nunes de Oliveira, Ritchelle Ricci e Karina D. Figueiredo pela preciosa amizade construída ao longo do curso dividindo os momentos difíceis e alegres. Às funcionárias do IP&D e UNIVAP Rebeca, Rosângela, Rúbia, Claúdia, D. Ivone pelo carinho e atenção durante a realização deste trabalho. Às colegas de laboratório Graziela, Zélia, Marta, Paula e Bianca que de uma maneira direta ou indireta participaram desta fase tornando possível a elaboração desta pesquisa. À CAPES, pelo suporte disponibilizado em forma de bolsa auxílio, e à FAPESP pelo apoio financeiro. "... Há duas formas para viver sua vida: Uma é acreditar que não existe milagre. A outra é acreditar que todas as coisas são um milagre." Albert Einstein (1879-1955) RESUMO A Terapia Fotodinâmica (TFD) é uma promissora modalidade de tratamento do câncer, que envolve a administração de um agente fotossensibilizante que se localiza preferencialmente em células tumorais. Esta terapia desencadeia uma série de processos fotoquímicos e fotobiológicos, cujo resultado envolve múltiplas vias durante morte celular. Um conhecimento completo dos mecanismos envolvidos na TFD pode conduzir a uma melhor eficácia terapêutica. Tanto estudos in vitro quanto in vivo mostraram o envolvimento de um processo apoptótico durante a morte celular mediada pela TFD. Para analise do processo de morte celular em células Hep-2, após TFD, utilizamos Zinco Ftalocianina (9 µM), e laser diodo com comprimento de onda 670 nm, densidade de energia de 4,5 J/cm2. Nossos resultados indicaram que as células Hep-2 submetidas a terapia, foram alteradas ultraestruturalmente ocorrendo comprometimento de mitocôndrias, do núcleo e membrana nuclear, gerando morte celular pelo processo de apoptose. Palavras-chave: Terapia Fotodinâmica, Zinco ftalocianina, Apoptose, Microscopia Eletrônica, Microscopia de Fluorescência, Cultura Celular ABSTRACT Photodinamic therapy (PDT) is a promissing modality of cancer treatment, which involves the administration of a photosensitizer, which is preferentialy located in tumors. This therapy triggers a series of photochemical and photobiological processes, whose result involves multiple ways during cell death. A complete knowledge of the mechanisms involved in PDT may lead to a better therapeutical effectiveness. Both studies in vitro and in vivo have shown the envolvement of an apoptotic process during celular death mediated by PDT. For analysis of the process of celular death in Hep-2 cells, after PDT, we used Zinc Phthalocyanine (9 µM), and a diode laser at 670 nm wavelenght, energy density of 4,5 J/cm2. Our results indicated that the Hep-2 cells submitted to the therapy, were modifed ultrastructurally, with the commitment of mitochondria, nucleus and cellular membrane, generating cellular death by apoptosis. Key-words: Phothodynamic Therapy, Zinc Phthalocyanine, Apoptosis, Electronic Microscopy, Fluorecence Microscopy, Cell culture. SUMÁRIO 1. INTRODUÇÃO.........................................................................................................1 1.1. Objetivos .......................................................................................................1 2. TERAPIA FOTODINÂMICA...................................................................................2 2.1 Fotossensibilização .......................................................................................4 2.2 Morte Celular ................................................................................................6 2.3 Limitações da Terapia Fotodinâmica ............................................................9 2.4 Terapia Fotodinâmica na Morte Celular .....................................................10 2.5 Fotossensibilizantes.....................................................................................12 2.6 Zinco Ftalocianina ......................................................................................14 2.7 Laser.............................................................................................................15 3. MITOCÔNDRIA ....................................................................................................17 4. NÚCLEO ................................................................................................................18 5. MICROSCOPIA DE FLUORESCÊNCIA............................................................19 5.1. Marcadores Fluorescentes ............................................................................19 5.1.1 JC-1 .................................................................................................19 5.1.2 DAPI.................................................................................................20 6. MATERIAL E MÉTODOS....................................................................................21 6.1 Cultura de Células..........................................................................................21 6.1.1 Linhagem Celular .............................................................................21 6.1.2 Manutenção da Cultura Celular.........................................................21 6.1.3 Reagentes, Soluções e Tampões Necessários para Cultura Celular................................................................................................23 6.2 Incubação e Irradiação.................................................................................23 6.3 Teste de Citotoxicidade ...............................................................................25 6.4 6.3.1 Teste de MTT......................................................................................25 6.3.2 Teste de Exclusão com Azul de Tripan - Após Doses de Energia.....27 6.3.3 Exclusão com Azul de Tripan - Após a Terapia Fotodinâmica..........28 Microscopia de Fluorescência.....................................................................29 6.4.1 JC-1 - Marcação para Mitocôndria....................................................29 6.4.2 DAPI - Marcação para Núcleo..........................................................30 6.5 Microscopia Eletrônica .............................................................................30 7. RESULTADOS........................................................................................................35 7.1 Relação entre Número de Fótons/Moléculas e Células....................................35 7.2 Absorbância da ZnPc.........................................................................................36 7.3 Teste de Citotoxicidade.....................................................................................37 7.3.1 Para Padronização Concentração do Fotossensibilizador Zinco Ftalocianina ......................................................................................................37 7.3.2 Citotoxicidade para Concentrações do DMSO.................................38 7.4 Teste de Viabilidade Celular ............................................................................39 7.4.1 Para Padronização da Dose de Energia..............................................39 7.4.2 Viabilidade Celular após a Terapia Fotodinâmica............................40 7.5 Microscopia de Fluorescência..........................................................................41 7.5.1 Microscopia de Fluorescência - Marcação Mitocôndria....................41 7.5.2 Microscopia de Fluorescência - Marcação Núcleo.............................50 7.6 Microscopia Eletrônica.....................................................................................59 8. DISCUSSÃO............................................................................................................66 9. CONCLUSÃO..........................................................................................................72 10. BIBLIOGRAFIA...................................................................................................73 LISTA DE FIGURAS Figura 2.1: Diagrama de Jablonski simplificado para o processo de fotossensibilização ................................................................................................... 5 Figura 6.1. (A) Placa de 96 poços, (B) placa de 24 poços, (C) garrafa de cultura onde eram mantidas as células Hep-2 e (D) placa de Petri utilizadas em microscopia eletrônica.............................................................................................. 22 Figura 6.2: Laser Thera Lase - DMC, utilizado nas irradiações das células........... 24 Figura 7.1: Espectro de absorção da ZnPc filtrada na concentração de 9µM em DMSO....................................................................................................................... 36 Figura 7.2: Atividade mitocondrial em células não irradiadas. (A) Células Hep-2 marcadas com JC-1, (B) após incubação com ZnPc as células Hep-2.................... 42 Figura 7.3: (A) Células Hep-2 incubadas 24 horas após tratamento somente laser, (B) células incubadas 30 minutos após o tratamento TFD marcadas com JC-1...... 44 Figura 7.4: (A/B) Células Hep2 incubadas 12 horas com após o tratamento TFD........................................................................................................................... Figura 7.5: Célula Hep-2, incubada após 12 horas com após o tratamento 46 TFD........................................................................................................................... 48 Figura 7.6: (A) Grupo de células Hep-2 controle, sem tratamento, e (B) tratadas somente com laser marcadas com DAPI................................................................... 51 Figura 7.7: Célula Hep-2 marcadas com DAPI, (A) controle tratadas somente com ZnPc, (B) após o tratamento TFD incubadas 30 minutos com meio MEM..... 53 Figura 7.8: Células Hep-2 marcadas com DAPI, após 30 minutos e 1 hora da TFD........................................................................................................................... 55 Figura 7.9: (A/B)Células Hep-2 marcadas com DAPI 1 e 12 horas após tratamento TFD........................................................................................................................... 57 Figura 7.10: Células Hep-2 Microscopia Eletrônica, (A) controle: sem tratamento e (B) tratamento somente fotossensibilizador ZnPc. 3.270x.................................... 60 Figura 7.11: (A/B) Células Hep-2 30 minutos após tratamento com TFD. 3.270 e 3.810x........................................................................................................................ 62 Figura 7.12: (A/B) Células Hep-2 24 horas após tratamento com TFD. 2030 e 1.450x........................................................................................................................ 64 LISTA DE GRÁFICOS Gráfico 7.1: Viabilidade de Células Hep-2 após 24h do tratamento com fotossensibilizador Zinco ftalocianina (ZnPc), média e desvio padrão de 6 experimentos.................................................................................................................... Gráfico 7.2: Viabilidade de Células Hep-2 após 24h de incubação com DMSO variando as concentrações média e desvio padrão de 6 experimentos............................. Gráfico 7.3: 37 38 Viabilidade Celular linhagem Hep-2 irradiadas sem corante, variando densidade de Energia entre 0,5 a 4,5 J/cm2. Usando o método de Azul de Trypan após 24 h da irradiação............................................................................................................. Gráfico 7.4: 39 Viabilidade de células Hep-2 sob tratamento PDT, frente a administração do corante ZnPc nas concentrações 4,5 e 9 ìM, analisados em 24 e 48 horas após o tratamento.................................................................................................... 40 LISTA DE TABELAS Tabela 6. 1. Parâmetros utilizados para irradiação em placas de Petri e placas de 24 poços.................................................................................................................... 25 Tabela 6. 2. Concentrações e volumes utilizados de ZnPc e DMSO........................ 26 ABREVIATURAS AIF : Fator indutor apoptose ALA : 5'- ácido aminolevulínico AlPc : Alumínio ftalocianina AlPcS4 : Alumínio ftalocianina tetrasulfonada AsGa : Arseneto de gálio ATP : Adenosina trifosfato Ca2+ : Íon cálcio CO2 : Dióxido de carbono CsA : Ciclosporina A D.E. : Densidade de energia DMSO : Dimetilsulfóxido DNA : Ácido desoxirribonucleico DAPI : 4', 6' - diamidino, 2' phenylindole- 5 ìM EDTA : Ácido etilenodiaminotetraacético sal dissódico EROs : Espécies reativas de oxigênio FADD : Fas associado com domínio da morte H2O2 : Peróxido de hidrogênio Hp : Hematoporfirina Hep - 2 : Linhagem celular de carcinoma de laringe humana HpD : Derivado de hematoporfirina HeLa : Linhagem celular de carcinoma de cérvix humana Hz: Hertz InGaAlP : Fosfeto de índio-gálio-alumínio J : Joules JC-1 : (5,5’,6,6’,-tetrachloro-1,1’3,3’, tetraethylbenzimidazolcarbocyanine iodide) K+ : Íon potássio MEM : Meio de cultura meio Mínimo Essencial MCP : Morte celular programada µl : Microlitro µm : Micrômetro µM : Micromolar ml : Mililitro mW : Miliwatts M : Molar µs : Microsegundo mM : Milimolar MTT : 3-(4,5-dimethylthiazolone-2-yl)-2,5-diphenyl tetrazolium bromide N : Número de fótons NaCl : Cloreto de sódio NaH2PO4.H2O : Bifosfato de sódio monohidratado Na2HPO4.7H2O : Fosfato de sódio heptahidratado NaHPO4.12H2O : Fosfato de sódio dodechidratado nm : Nanômetro O*- : Íon superóxido 1 O2 : Oxigênio singleto *OH : Hidroxil OsO4 : Tetróxido de ósmio PBS : Salina tampão fosfato Pc : ftalocianinas Pc4 : ftalocianina 4 pH : Potencial de hidrogênio PP : Protoporfirina PPS4 : Meso tetrafenilporfirinasulfonada PTPC : Complexo de Poro de Transição de Permeabilidade S0 : Estado de energia singlete fundamental S1 : Primeiro estado singlete excitado SMAC : Ativador secundário de caspases derivado da mitocôndria SFB : Soro Fetal Bovino T1 : Estado tripleto TFD : Terapia fotodinâmica tTGase : Transglutaminase tecidual T TRP : µ-[meso-5,10,15,20,-tetra(piridil)porfirina]te-trakis-bis(bipiridina)(cloro) rutênio(II)] UV : Ultravioleta UVA : Ultravioleta A UVB : Ultravioleta B VIS : Visível W : Watt ZnPc : Zinco ftalocianina λ : Comprimento de onda c : Velocidade da luz no vácuo h : Constante de Planck ν : Frequência 1. INTRODUÇÃO _____________________________________________________________________________________ A Terapia Fotodinâmica (TFD) se estabeleceu em todo mundo como um processo seletivo, no qual as células displásicas são retiradas do organismo com um traumatismo mínimo para as células normais. O fundamento da Terapia Fotodinâmica baseia-se na irradiação de células tumorais que absorveram fotossensibilizantes, que se acumulam preferencialmente em células neoplásicas. Esta característica permite que a radiação atue somente na região neoplásica, elevando a possibilidade de sobrevida dos pacientes para mais de 95%. Esta terapia desencadeia uma série de processos fotoquímicos e fotobiológicos, cujo resultado é um dano irreversível do tecido tumoral (DOUGHERTY et al.,1998; BELMONT et al.,1999; LIPSON; BALDES, 1960). O fotossensibilizador ao receber radiação eletromagnética com comprimento de onda específico, na presença de oxigênio do meio, induz vários processos fotoquímicos envolvendo a produção de espécies reativas de oxigênio – EROs (1O2, O2*-, *OH, H2O2) os quais atacam centros dos sistemas celulares, desencadeando a morte dos tecidos tumorais ou apoptose celular (TAKEMURA et al., 1995; JACQUES, 1992) 1.1 OBJETIVOS _____________________________________________________________________________________ Desta forma objetivando uma melhor avaliação do processo de morte celular, ocasionado pela TFD e a participação de fotossensibilizante e laser, analisamos: Ø Alterações morfofisiológicas das células neoplásicas submetidas a TFD, avaliando ultraestruturalmente os danos acarretados. Ø A ação do agente fotossensibilizante ZnPc e seus efeitos fisiológicos em culturas de células Hep-2, e os eventos celulares desencadeados por esse processo. Ø A participação das mitocôndrias e núcleo no processo de morte celular. 2. TERAPIA FOTODINÂMICA ______________________________________________________________________ O tratamento de neoplasias pode ser realizado por cirurgia, radioterapia e quimioterapia. Alguns tratamentos alternativos como a Terapia Fotodinâmica (TFD) têm surgido visando otimizar o tratamento das neoplasias (SIBATA et al., 2000). A TFD envolve a administração de sistemas de liberação contendo fármacos fotossensibilizantes que direcionam a liberação para o tecido neoplásico seguido pela exposição de luz. O fotossensibilizante é ativado pela luz e em presença de oxigênio molecular produz espécies reativas de oxigênio. Como o oxigênio singleto é citotóxico, oxida e lesa componentes vitais das células neoplásicas levando-as a apoptose (SIBATA et al., 2000, REDDI et al., 1987). O desenvolvimento histórico da TFD foi detalhado por Daniell e Hill em 1993. As reações fotodinâmicas foram estudadas sistematicamente no começo do século passado por um estudante de medicina alemão, Raab, em 1900 usando culturas de paramécios e acridina. Raab notou que os paramécios expostos à acridina e em seguida a luz, morriam. Von Tappeiner em 1903, professor de Raab demonstrou a dependência deste fenômeno à presenç a de oxigênio e relatou o uso clínico da eosina como um fotossensibilizador para tratamento de câncer de pele, candyloma lata e cutaneous lupus. O termo ação fotoquímica foi subseqüentemente utilizado por Von Tappeiner, para caracterizar a necessidade de oxigênio na fotossensibilização. Foi Meyer-Betz em 1913, que desenvolveu testes cutâneos de fototoxicidade (injetando hematoporfirina em si mesmo), demonstrando o efeito fotossensibilizante em humanos. A autofluorescência tumoral, devido ao acúmulo de porfirina endógena em tumores experimentais, foi demostrado por Policard em 1942, usando uma lâmpada de Wood. Entretanto Auler e Banzer, 1942, usaram a hematoporfirina para destruição seletiva de tumores em animais. O derivado da hematoporfirina (HpD) foi desenvolvido por Schwartz, ao reagir ácido acético glacial e ácido sulfúrico com hematoporfirina e posterior solubilização em álcali diluído. O HpD, para a localização tumoral, apresentou melhores propriedades que a hematoporfirina e foi utilizado com sucesso por Lipson em 1961. Dougherty em 1975 usou o termo terapia fotorradiação para descrever o tratamento de tumores de animais, usando luz visível filtrada e HpD. A primeira grande série de pacientes que passaram pela TFD utilizando HpD foram também reportados por Dougherty em 1977, que notou que 111 dos 113 casos de tumores malígnos em 25 pacientes sofreram redução volumétrica parcial ou completa. (DANIELL;HILL, 1993 apud FURUZAWA, 1997) Aronoff (1997), fez uma revisão sobre a evolução do laser e suas aplicações terapêuticas, descrevendo a TFD como um procedimento fotoquímico envolvendo droga fotossensibilizante que, quando ativada por luz com comprimento de onda adequado, transfere energia ao oxigênio molecular, gerando oxigênio singleto com destruição de células tumorais. Além disso, o efeito tumoricida seria devido à necrose e oclusão vascular, parcialmente mediada por tromboxana A2. Um dos grandes interesses de estudo na área de TFD ocorre em relação aqueles associados à administração e biodistribuição de corantes fotossensibilizantes nos diferentes sistemas biológicos (HENDERSON ; DOUGHERTY, 1992; DOUGHERTY ; POTTER, 1991). Estudos utilizando sensibilizadores marcados têm demonstrado que tanto tecidos normais quanto tecidos neoplásicos apresentam capacidade de reter os corantes (HENDERSON ; DOUGHERTY, 1992). Tal fato justifica o grande número de estudos a fim de desenvolver compostos mais específicos na retenção e distribuição nos tecidos neoplásicos. O ácido 5-aminolevulínico (ALA) tem se tornado um promissor agente para TFD uma vez que ele pode ser administrado tópica e oralmente, causando uma fotossensibilidade somente por curto período de tempo (CHARLESWORTH; TRUSCOTT, 1993; MIKVY et al, 1995). O ALA é um precursor na biossíntese de pigmentos heme, citocromo, clorofila, bile e outras porfirinas. Ele é convertido intracelularmente a uma protoporfirina IX monomérica que apresenta uma alta fluorescência e forte capacidade fotossensibilizante (SCHNECKENBURGER et al., 1993). Estudos in vitro utilizando culturas de células (CPAE e PTK2) e células miocárdicas têm demonstrado que nas duas primeiras ocorre uma concentração seletiva de protoporfirina IX na região perinuclear do citoplasma, enquanto na terceira o sensibilizador encontra-se ligado seletivamente à mitocôndria (LIANG et al, 1998). Entretanto alguma fluorescência difusa em outras regiões do citoplasma e outras organelas, ou ligações não específicas não devem ser excluídas. Um dos critérios básicos na escolha de um agente a ser utilizado em TFD, é que o mesmo apresente uma absorção espectral acima de 600 nm, a chamada janela óptica onde os componentes endógenos do tecido biológico são transparentes à radiação incidente (RICCHELLI et al, 1991a; BIOLO et al, 1994; GROSS et al., 1993), além do que tais agentes deverão apresentar retenção seletiva aos tecidos neoplásicos em relação aos tecidos sadios. 2.1 FOTOSSENSIBILIZAÇÃO ______________________________________________________________________ A Terapia Fotodinâmica envolve a ativação de uma droga fotossensibilizadora por meio de luz com comprimento de onda específico com a absorção espectral do fotossensibilizador. Na presença de oxigênio no tecido a TFD causa geração de espécies reativas de oxigênio, os quais exercem efeitos citotóxicos nas organelas celulares e membranas resultando em morte (VISONA et al., 2000). A luz interagindo com o corante, torna-o excitado passando de seu estado fundamental (S0) ao estado tripleto (T1). Neste segundo estado, sua meia vida é de poucos milionésimos de segundos, durante o qual é capaz de rápida energização do oxigênio dissolvido, que é ativado para seu primeiro estado eletrônico excitado. Este estado energético (1O2) também é de vida curta, porém muito reativo. Típicas moléculas orgânicas sensibilizadoras são convertidas a estado singleto (S1) de vida curta na absorção do fóton. O estado excitado singleto (S1) de bons fotossensibilizadores, passa eficientemente pelo cruzamento inter-sistema para atingir o estado tripleto (T1), como mostrado na figura 2.1 A maioria das reações fotossensibilizadas nos sistemas biológicos, é mediada por este estado (T1) do fotossensibilizador devido ao seu tempo de vida prolongado. O fotossensibilizador no seu estado tripleto pode interagir com outras moléculas por 2 modos principais, as chamadas reações Tipo I e Tipo II. O processo Tipo I, envolve a transferência de um átomo de hidrogênio ou de um elétron entre o fotossensibilizador e alguma outra molécula, enquanto a reação Tipo II envolve a transferência de energia do fotossensibilizador para o oxigênio no estado fundamental (T1). As reações do Tipo I, são favorecidas por alta concentração de substrato e baixa concentração de oxigênio, enquanto as reações do Tipo II são engrandecidas pela situação reversa. Nas células, a ligação dos fotossensibilizadores às estruturas celulares fotossensitivas podem aumentar os processos do Tipo I. Sn λ1 + R*,X*,R * Φic S1 Tn λ1 λ2 kf Φic Fotossensibilização Celular T1 Φisc λ1 + R*,X*,R * kp S0 O2 1 O2 EROs Figura 2.1. Diagrama de Jablonski simplificado para o processo de fotossensibilização. O corante no estado fundamental (S0) é excitado ao primeiro estado singleto (S1), podendo fluorescer e retornar ao estado fundamental, ou realizar um cruzamento intersistemas para o estado tripleto de mais baixa energia. A reação deste com o oxigênio molecular, inicia o processo de produção dos EROs. Esse processo Tipo I, mais comum nos tecidos biológicos, envolve o seqüestro de um elétron de um substrato redutor, resultando na forma semi-oxidada do substrato e forma semi-reduzida do fotossensibilizador. Freqüentemente, o radical do substrato resultante pode reagir com o oxigênio, formando produtos oxidados; em alguns casos esses são peróxidos, os quais podem iniciar processos em cadeia. Alguns sensibilizadores semi-reduzidos reagem com o oxigênio no estado fundamental para regenerar o sensibilizador para o estado fundamental e produzir superóxido. Corantes semi-reduzidos podem também interagir para retornar ao estado fundamental e produzir peróxido de hidrogênio (PAZOS, 2001). 2.2 MORTE CELULAR ______________________________________________________________________ O termo apoptose foi criado para descrever somente as mudanças estruturais e morfológicas que ocorrem durante a morte celular. Durante a apoptose as células são encolhidas drasticamente, a membrana plasmática e o retículo endoplasmático formam vacúolos, a cromatina é condensada ao longo da membrana nuclear, depois formando esferas em formas crescentes. No final do estágio, o núcleo e os fragmentos formam unidades compactas chamadas de corpos apoptóticos, que são primariamente removidos por células específicas, os macrófagos. Porém se estes não forem removidos, podem iniciar uma necrose secundária. Como já descrito, a célula em apoptose encolhe drasticamente, característica esta que pode ser usada para apontar uma porcentagem quantitativa. Isto pode ser conseguido através de vários métodos de microscopia ou citometria de fluxo, baseados nas diferenças de tamanho e granulosidade. Durante apoptose ocorre diminuição do potencial transmembrana mitocondrial imediatamente ou em 2 horas e pode ser medido usando um corante fluorescente específico tal como JC-1 (5,5’,6,6’,-tetrachloro-1,1’3,3’, tetraethylbenzimidazolcarbocyanine iodide) por citometria de fluxo. As caspases são ativadas durante este processo e podem ser monitoradas durante alguns dos mecanismos de apoptose, considerando a liberação de alguns dos “ativadores” das caspases. Como um processo estritamente organizado, elas destroem e modificam componentes celulares vitais, tal como Bcl-2, proteína associada ao retinoblastoma (Rb), lâmina nuclear, U1 70-kDa proteína quinase ribonuclear (envolvido no RNA) de adesão focal, quinase 2 ativada p-21, proteína quinase C[gama], proteína fosfatase 2A, poli ADP-ribose polimerase (PARP) e muitos outros, sendo sua ativação ou destruição documentada pela técnica Western Blots (GODAR, 1999). Godar (1999), citou em seus trabalhos três termos referentes a apoptose: imediata, intermediária e tardia, junto, aos diferentes mecanismos cinéticos pré-MCP (morte celular programada) e MCP. A apoptose imediata é provocada em menos de meia hora e é um mecanismo pré- MCP, isto é, não requer síntese de proteínas pósexcitadas, por exemplo após TFD (GODAR, 1996). Apoptose intermediária ocorre dentro de quatro horas, mas requer mais que meia hora para iniciar (WANG et al.,1997) e é um mecanismo pré-MCP. Entres os agentes que excitam a ativação da apoptose intermediária podemos citar: altas doses de qualquer radiação UVB (ultravioleta B) ou UVC (ultravioleta C) e qualquer agente que ative um receptor na membrana contendo um domínio da morte celular, tal como Fas/CD95/APO-1(ASHKENAZI ; DIXIT, 1998; GODAR, 1999b). Uma vez ocorrendo ligação cruzada, estes receptores ligados à membrana, traduzem um sinal para a mitocôndria através da ação proteolítica das caspases. Apoptose tardia ocorre após 4 horas (podendo levar dias) e é um mecanismo MCP, dependendo de síntese de proteína. Exemplos de agentes que induzem primariamente apoptose tardia são radiações UVB, UVC (GODAR, 1996 ;GODAR et al., 1994), PUVA (MARKS ; FOX, 1991; VOWELS et al., 1996; YOO et al., 1996), raio X (OLIVE ; DURAND, 1997; GODAR, 1999a) e qualquer outro agente que cause danos significativos ao DNA. Danos no DNA levam a regulação de certos produtos gênicos, alguns dos quais são conhecidos como participantes do mecanismo de morte celular por apoptose; a morte ligada ao receptor Fas, a proteína Bax, que forma poros mitocondriais e retração relativa. Qualquer dano no DNA ativa o fator de transcrição AP-1, aumentando a expressão de receptor Fas ou ativando a transcrição do fator p53, aumentando a expressão da proteína Bax que forma o poro mitocondrial. As radiações UVA e TFD primeiramente mediado pela produção de oxigênio singleto provocam apoptose imediata pré-MCP, com despolarização do potencial transmembrana mitocondrial. Um megaporo se abre no local "S", sulfidrila sensível, liberando FAI (fator que induz apoptose) a menos que a Ciclosporina A (CsA) esteja presente. A apoptose imediata também pode ser ativada no local "P", pirimidina nucleotídeo sensível, por altos níveis de ânions superóxidos (por exemplo 1mM vitamina K3), porém este mecanismo envolve a liberação de citocromo c, o qual não é inibido pela CsA. TFD e radiação UVA-1 provocam apoptose imediata pré- MCP e pode ser inibida ou atrasada por uma grande concentração de BcL-2, uma proteína antioxidante; embora antioxidantes apenas retardem o processo de apoptose, pois muito pouco das células realmente sobrevivem (GODAR, 1999). Apoptose intermediária pré-MCP é normalmente iniciada pela ligação cruzada do receptor que pode ser ativado usando altas doses de radiação UVB e UVC, que tem um perfil cinético, partido de apoptose iniciada por anti-Fas. Altas doses de radiação UV iniciam uma ligação cruzada com Faspor mecanismos ainda não conhecidos, mas este é um processo que pode envolver radicais livres, ânions superóxido e radicais hidroxila (GORMAN et al., 1997). É conhecido, entretanto, que FasL não é controlado pela FasR porque a apoptose não é inibida por um anticorpo bloqueador, como ZB4. Além disso, a microscopia confocal associada a imunoprecipitação e coimunoprecipitação com FADD (Fas associado com domínio da morte), confirmou que a ligação cruzada FasR está diretamente ligada a ação da radiação UV. Depois do FasR estar ligado, FADD recruta pró caspase 8 que torna caspase 8 ativa, uma ativadora de caspase pré-mitocondrial. A caspase 8 através da Bid pode formar poros na membrana mitocondrial (LI et al., 1998), ou pode ser inibida diretamente pela clivagem da pró caspase 3 (STENNICKE et al., 1998). Outros receptores de domínio da morte, como fator de necrose tumoral (TNF) também podem iniciar a apoptose intermediária (ASHKENAZI; DIXIT.1998), aparentemente atua em algum mecanismo de apoptose iniciada por fóton (SCHWARZ et al., 1995; SHEIKH et al., 1998.) Apoptose tardia MCP é iniciada por danos no DNA que podem ser provocados por luz visível, UVA, UVB, UVC ou raio-X (LEY; APPLEGATE, 1985; JONES et al, 1987; PEAK; PEAK, 1991; GODAR; LUCAS, 1995; GODAR, 1999a). Além de danos na membrana da mitocôndria, radiação UVA também causa apoptose tardia (GODAR ; LUCAS, 1995). Altas doses de radiação UV afetam não somente alvos celulares como também membrana plasmática e o citoplasma (SCHWARZ, 1995), resultando em apoptose intermediária, provocando danos no DNA que levam à uma apoptose tardia (GODAR, 1999a). Um mecanismo de apoptose tardia induzida por danos no DNA envolve transcrição do fator AP-1, considerando outros fatores, envolvendo a transcrição do p53. Ellerby (1997), propôs três mecanismos para a iniciação de apoptose: Indutores Pré-Mitocondriais, como por exemplo, tamoxifen podem iniciar uma cascata de transdução de sinal resultando em liberação de fatores mitocondriais que iniciam apoptose. Esta classe de agentes inclui a maioria dos agentes de anti-tumor comuns e talvez radiação ionizante; Indutores Mitocondriais, por exemplo, atractilosideo embora não permeável, pode agir diretamente na mitocôndria isolada resultando em fatores indutores de apoptose; Indutores Pós-Mitocondriais, representado por citocromo c, considerando perturbações mitocondriais suficientes para causar uma liberação de citocromo c, a mitocôndria tem sido proposta como um alvo potencial para TFD (DECAUDIN et al., 1998) que fornece um estímulo direto a morte de célula por apoptose. Células tratadas com altas doses de fotossensibilizador podem morrer sem apresentar as características normais de apoptose e são geralmente consideradas necrosadas. Além disso, células que sofrem apoptose tardia podem eventualmente perder a integridade de suas membranas sendo então impossível o teste de exclusão de corantes vitais, como Azul de Tripan, consideradas então como células em necrose. (OLEINICK, 2002). 2.3 LIMITAÇÕES DA TERAPIA FOTODINÂMICA ______________________________________________________________________ A TFD é um caso particular da aplicabilidade da Óptica na Medicina, destacando-se não só pela possibilidade de caracterização como também pela possibilidade de tratamento através da absorção óptica (REIS et al.,2002). Entretanto a TFD ainda apresenta algumas limitações como: Ø Pelo excesso da energia, os estados excitados dos fotossensibilizadores possuem curto tempo de vida (< 10-3s). Isso diminui a probabilidade da transferência de energia do fotossensibilizante para o oxigênio. Ø A concentração de oxigênio dentro dos tecidos tumorais é baixa. Isso diminui também a probabilidade da formação de oxigênio singleto. Ø O tempo de vida do oxigênio singleto também é muito curto (nas soluções aquosas < 10-5s), reduzindo a probabilidade das reações entre o oxigênio singleto e as estruturas celulares. Ø Os fotossensibilizadores utilizados atualmente em TFD possuem baixa absorção óptica na região da janela terapêutica (λ > 600 nm). Ø A maioria dos fotossensibilizantes orgânicos possui alta afinidade para formação dos agregados, que diminui sua eficácia em TFD. Estes fatores estimulam a busca de novos tipos de fotossensibilizadores mais efetivos para TFD (BORISSEVITCH, 2002) e um maior conhecimento dos corantes já existentes. A compreensão do efeito da TFD no metabolismo celular e as organelas afetadas por este tipo de terapia, são necessários para um melhor conhecimento e aprimoramento de drogas cada vez mais específicas para células tumorais. A análise das alterações causadas pelo fotossensibilizante ZnPc, bem como sua interação com células neoplásicas, se faz necessária para compreensão do papel biológico deste corante, assim tornando-o mais eficaz . 2.4 TFD NA MORTE CELULAR ______________________________________________________________________ Um conhecimento completo dos mecanismos envolvidos na TFD pode conduzir a uma melhor eficácia terapêutica. Tanto estudos in vitro quanto in vivo mostraram o envolvimento de um processo apoptótico durante a morte celular mediada pela TFD. Não são conhecidas as vias pelas quais a terapia fotodinâmica causa este processo. Várias técnicas existentes têm sido utilizadas, tais como: liberação do citocromo c e fosfotirosina, alteração no potencial de membrana, ensaio de atividade de caspases, identificação de núcleo apoptótico, detecção por sondas fluorescentes, Western Blots, microscopia eletrônica e outras. Estudos realizados por DAHLE et al., 1999 mostraram diferenças significativas no tipo de morte celular, isto é, necrose/apoptose, em relação a diferentes densidades celulares tratadas com moderadas doses de TFD. Foi verificada, quatro horas depois da exposição a TFD, uma maior fração de células em apoptose em cultura em monocamadas (alta densidade celular) que em microcolônias (baixa densidade celular), matando menos que 55% das células. STRAUSS et al., 1995 também fizeram esta observação em suas investigações quando Meso Tetrafenilporfirinasulfonada (TPPS4) foi localizada em lisossomos e citoplasma em células do epitélio mas não em camadas confluentes, causando apoptose. Estudos de Dahle (1999) mostraram ainda que células distribuídas em monocamada confluente apresentam quase três vezes mais sensibilidade para TFD que as células em microcolônias, conseqüentemente levando então uma fração maior de células à apoptose em culturas em monocamada que em microcolônias. Isto é causado em parte pelo fato das células em única camada terem apresentado uma maior concentração intracelular de TPPS4 (MOAN et al., 1992). Em altos níveis de morte, o modo de morte foi similar em microcolônias e em monocamadas. Para ambas densidades, houve uma alta fração de morte celular por necrose. Uma explicação para alta taxa de necrose em ambas densidades celulares pode ser dada pelos grandes danos intra celulares que podem impedir as células de metabolizarem a energia necessária para iniciar e regular os eventos apoptóticos dependentes de energia (LEIST et al., 1997). Um importante evento que leva à morte celular é a liberação de citocromo c da mitocôndria para o citosol, provocando assim, a ativação de caspase-3 e iniciação da resposta apoptótica em um estágio relativamente tardio (KLUCK et al., 1997a; Yang et al. 1997). O tipo de morte celular, apoptose ou necrose, parece ser dependente do agente fotossensibilizador, da linhagem celular e do protocolo (HE et al., 1994, DELLINGER.,1996, OLEINICK et al., 1993). Uma dose supra letal de TFD pode causar necrose, confirmada por fragmentação de DNA em gel de agarose (LUO et al., 1997). Como resultado seguinte pode ocorrer fotodano de membrana, levando à liberação de componentes do citosol, liberação de citocromo c, ativação das caspases, e outros componentes da resposta apoptótica. Kessel et al.,1999 trabalhando com linhagem celular de leucemia mostrou que fotodano causado por TFD leva à perda de potencial de membrana mitocondrial, liberação de citocromo c no citosol, fragmentação celular e aparecimento de núcleos apoptóticos. Neste estudo foi verificado também que a perda imediata do potencial de membrana é conseqüência direta do fotodano mitocondrial. Estes resultados caracterizam a mitocôndria como uma fonte de fatores que iniciam a resposta apoptótica mediada por TFD (KLUCK et al., 1997a, LIU et al., 1996, KLUCK et al 1997b, SUSIN et al.,1997). Embora haja relatos que TFD possa iniciar outros eventos de transdução de sinal (OLEINICK et al., 1993). Kessel et al. (1999), propuseram que a liberação de citocromo c sozinho é suficiente para iniciar uma resposta apoptótica. A liberação do citocromo c imediatamente após a irradiação de células fotossensilizadas no citosol, foi demonstrada pela técnica de Western Blot. Essa liberação teve um crescente aumento com incubação à 37ºC, aumentando ainda mais na presença de staurosporina, inibidor de proteína quinases, um agente que potencializa a apoptose. Hsieh et al. 2003, apontaram membrana plasmática e complexo de Golgi como os principais alvos para Fotofrin levando a formação instantânea de EROS e subseqüentemente ativação de vários eventos que levariam a apoptose, mas as características típicas de apoptose (fragmentação de DNA e externalização fosfatidilserina) não foram encontradas, concluindo que os danos causados na membrana plasmática resultaram em morte celular por necrose. 2.5 FOTOSSENSIBILIZANTES ______________________________________________________________________ Terapia Fotodinâmica tem mostrado excelentes resultados em clínicas experimentais com porfirinas, particularmente com Fotofrin. Como este composto está longe de ser ideal, pesquisas estão desenvolvendo novos fotossensibilizadores melhorando suas características, como uma alternativa para Fotofrin. Uma variedade de porfirinas sintetizadas, benzoporfirinas, clorinas, e ftalocianinas têm sido propostas como segunda geração de fotossensibilizadores (ROSENTHAL, 1991, JORI, 1996). As ftalocianinas constituem uma larga classe de componentes com alto coeficiente de excitação em uma região espectral do vermelho (630-800 nm), apresentando grande eficiência e excelentes propriedades para localização de tumor (BEN-HUR, 1992). A Zinco ftalocianina (ZnPc) é um potente sensibilizador de segunda geração que tem sido muito utilizada para tratamento in vivo de tumores de rato (MILANESI et al., 1990, ZHOU et al.,1996) e para indução de efeitos de citotoxicidade em várias linhagens celulares (RODAL et al., 1998; VALDUGA et al., 1998.). A morte celular tende a ser proporcional a quantidade de fotossensibilizador captado pela célula, então a quantidade de células mortas causada por TFD é dependente da concentração de fotossensibilizador existente no interior da célula (WOOD et al., 1997). A eficiência do fotossensibilizador em sensibilizar as células para a fotoativação depende da habilidade da célula em captá-lo e das suas propriedades fotoquímicas. A captação celular da droga é altamente dependente da propriedade lipofílica, embora existam outros fatores que também influenciem, por exemplo, a captação das ftalocianinas é maior que aquelas das porfirinas com similar lipofilicidade (RODAL et al., 1998). TEITEN, et al. 2003, relatam que a localização intracelular do fotossensibilizador (intracelular) influencia significativamente os mecanismos de resposta a TFD, desde a primeira localização bem como a distribuição específica do fotossensibilizador. Estudos realizados por Villanueva et al., (1999), descreveram os efeitos fotodinâmicos da ZnPc na linhagem celular HeLa, de carcinoma humano, na qual a droga mostrou alta eficiência para induzir morte celular, por mecanismos de apoptose e necrose, em tratamentos fotodinâmicos letais e subletais, respectivamente, inativando o carcinoma. Uma discussão recente feita por Juarranz et al., (2001) sobre efeitos do fotossensibilizador ZnPc nos componentes do citoesqueleto de células HeLa, comenta a implicação destes elementos frente à morte da célula usando doses subletal e l etal. Muitas destas células mostraram formação de vacúolos no citoplasma, fragmentação de cromatina, perda de sua adesão pelo substrato, sendo estes resultados típicos de morte celular causada por apoptose (MILANESI et al., 1990; VILLANUEVA et al., 1999, VERHAEGEN 1998). A implicação de microtúbulos em apoptose tem sido descrita por vários autores, em células HeLa sendo proposto que haja um bloqueio mitótico, com inibição da proliferação celular pelo bloqueio da transição anáfase-telófase, induzindo apoptose (JORDAN et al.,1996). Apoptose pela desestabilização de microtúbulos tem sido vista também em culturas de células leucemicas (MARTIN; COTTER, 1990). Células em apoptose, danificadas pela fotossensibilização, perdem a aderência com outras células e com o substrato, indicando que ambos actina e α-actina foram também alterados pela TFD. Neste sentido a actina tem sido descrita como participante na formação de corpos apoptóticos (COTTER et al., 1992). É bem conhecido que as reações de fotossensibilização são dependentes da localização subcelular do fotossensibilizador (BERG ; MOAN, 1997). Neste sentido, que a localização do fotosessibilizador influencia significativamente no mecanismo de resposta para TFD, diferentes localizações subcelulares têm sido descritas para ZnPc, dependentes da linhagem celular e protocolo de incubação: distribuída difusamente no citoplasma de células epiteliais RR 1012 (RÜCK et al., 1996), localizada na membrana plasmática de fibroblasto de embrião de rato, ou em complexo de Golgi ou mitocôndria em células NHIK 3025 (RODAL et al., 1998). É notado que o tempo de vida do 1O2 é muito curto (< 0.04µs), então a reação de oxidação inicial ocorre em organelas nas quais os sensibilizadores estão localizados e secundariamente em outras estruturas celulares. Assim os fotodanos observados em elementos do citoesqueleto poderiam ser induzidos por ambos: direta, pela ligação do sensibilizador as proteínas do citoesqueleto ou indiretamente, pelas espécies reativas de oxigênio depois da exposição à luz (MOAN; BERG, 1991). Rück et al., (1996) citaram em seus trabalhos que a fluorescência da ZnPc é distribuída difusamente a nível subcelular no citoplasma após 24h de incubação e que acontece um decaimento dessa fluorescência à medida em que aumenta a exposição à luz. Decaimento, que é a fotodegradação do corante, observado em corantes hidrofóbicos. Este fenômeno, que também foi observado in vivo neste mesmo trabalho, confirma o comportamento de fotodegradação de outros corantes hidrofóbicos, indicando assim a ligação do corante com membranas de outras estruturas. 2.6 ZINCO FTALOCIANINA ______________________________________________________________________ As ftalocianinas (Pc) são agentes fotossensibilizantes de segunda geração e apresentam elevada absorbância molar na região do espectro eletromagnético correspondente a cor vermelha, sendo esta, a região que apresenta a máxima transmissão de luz através dos tecidos, portanto, a de maior uso no tratamento de tumores. Essa característica resulta em elevada resposta fototerápica. As Pc são potentes fotossensibilizantes e são capazes de eliminar células neoplásicas in vivo e in vitro após irradiação de luz. Esses compostos produzem estados tripletos de meia vida longa na ordem de µs e são eficientes produtores de oxigênio singleto. A ZnPc é um dos agentes mais utilizados em TFD porque tem caráter lipofílico e capacidade de atravessar a membrana plasmática, sendo acumulando no tecido alvo (SIBATA et al., 2000). Devido à estrutura hidrofóbica, as ftalocianinas se localizam em uma ou mais membranas celulares. Usuda (2003) relatou que a ftalocianina 4 (Pc4) liga-se preferencialmente à membrana mitocondrial, ao retículo endoplasmático e ao complexo de Golgi em células tumorais. Zinco ftalocianina (ZnPc) é um promissor fotossensibilizante de segunda geração para uso em Terapia Fotodinâmica devido a sua alta seletividade para tecidos tumorais (REDDI et al., 1987 e 1990) e alta eficiência de fotogeração de oxigênio singleto citotóxico (VALDUGA et al., 1988) além de seu caráter altamente hidrofóbico (BEN HUR et al.,1985). A ZnPc tem apresentado excelentes resultados fototerapêuticos quando testada como agente da TFD em uma grande variedade de modelos de tumores de rato (SCHIEWECK et al.,1993). Martinez et al., (2002) avaliou duas porfirinas TRP (µ-[meso-5,10,15,20,tetra(piridil)porfirina]te-trakis-bis(bipiridina)(cloro) rutênio(II)] ) e seu complexo de Zn2+ ZnTRP onde determinou-se o rendimento quântico de produção de 1O2. Os resultados indicaram que essas porfirinas possuem um alto rendimento de produção de 1 O2, além disso, o valor maior é para ZnTRP, indicando que a presença de zinco aumenta a habilidade de fotossensibilização e a capacidade de gerar 1O2. As propriedades farmacológicas da ZnPc e a necessidade de baixas doses para obter uma redução satisfatória do tumor após tratamento de TFD fizeram desta droga um promissor candidato a TFD (SCHIEWECK et al., 1993). A localização do corante na célula determina a extensão da atividade fotodinâmica. A distribuição do corante certamente é determinada pelo mecanismo de captação, o qual é principalmente influenciado pelos sistemas carreadores (RÜCK et al., 1996). A maioria dos corantes hidrofílicos são captados por pinocitose e acumulados em grânulos extracelulares, como observados por alumínio ftalocianina sulfonada (PENG. et al., 1991). 2.7 LASER ______________________________________________________________________ A luz laser é uma radiação eletromagnética, sendo um tipo de fonte luminosa com características bastante distintas daquelas de uma luz fluorescente ou de uma lâmpada comum; apresenta monocromaticidade, coerência e colimação. A radiação laser é monocromática porque emite radiações em um único comprimento de onda (λ). A monocromaticidade é obtida devido aos fótons que compõem a luz laser estarem todos com o mesmo comprimento de onda. É, portanto, uma luz pura. Essa característica é importante devido à absorção seletiva do tecido humano. A coerência é uma propriedade obtida devido à emissão estimulada que gera fótons, cujas energias se somam e viajam na mesma direção, movendo-se em fases no tempo e no espaço, ou seja as cristas e as cavidades das ondas coincidem. A colimação é a unidirecionalidade do feixe de fótons, paralelo ao eixo do tubo que o produz, apresentando uma divergência angular muito pequena. De um ponto de vista prático, um laser pode ser considerado como a fonte de um estreito feixe de ondas eletromagnéticas monocromáticas e coerentes nas regiões do visível, infravermelho ou ultravioleta do espectro eletromagnético. O fato da luz laser estar contida em um feixe, serve para concentrar a potência de saída em uma pequena área. Assim, um laser de potência modesta, pode produzir uma alta intensidade na pequena área do feixe do laser, concentrando a energia somente onde é focado. Similarmente, o feixe de um laser cirúrgico pode ser focado em um pequeno ponto sem danificar o tecido adjacente (HECTH, 1992). A radiação pode ser refletida, absorvida ou espalhada pelo tecido. O fenômeno de espalhamento é bastante relevante na interação laser tecido-biológico, fazendo com que a radiação perca sua coerência logo após penetrar no tecido, porém ele não é responsável pela transferência de energia ao tecido. A ação do laser sobre o tecido biológico se dá pela absorção seletiva de cromóforos por um determinado comprimento de onda. Para alguns materiais biológicos o comprimento de onda é fator determinante na interação laser-tecido, correspondendo a distância percorrida pela onda em uma oscilação completa, sendo medida em nanômetros (nm) e a freqüência de suas oscilações em Hertz (Hz). O comprimento de onda típico dos lasers comerciais situamse entre infravermelho e ultravioleta e depende fundamentalmente do meio ativo. É o meio ativo, em geral, que dá o nome ao laser, determinando sua pureza espectral (BORTOLETO, 2000). 3. MITOCÔNDRIA ______________________________________________________________________ A mitocôndria realiza a maior parte das oxidações celulares e produz a massa de ATP (adenosina trifosfato) das células animais. Geralmente são descritas como cilindros rígidos e alongados, com um diâmetro de 0,5 a 1µm, assemelhando-se a bactéria. Microfilmagens em intervalos de tempos de células vivas mostraram que as mitocôndrias são organelas notavelmente móveis e plásticas, mudando constantemente as suas formas e mesmo fundindo-se umas com as outras e separando-se novamente. A mitocôndria é limitada por duas membranas altamente especializadas com funções vitais para atividade mitocondrial. Juntas elas definem dois compartimentos mitocondriais distintos: o interno da matriz e o espaço intermembranas, bem mais estreito. A matriz contém uma mistura altamente concentrada de centenas de enzimas, incluindo aquelas necessárias à oxidaç ão do piruvato e ácidos graxos e para o ciclo do ácido cítrico. A matriz contém também várias cópias idênticas do DNA genômico mitocondrial, ribossomos mitocondriais especiais, tRNAs, e várias enzimas requeridas para expressão dos genes mitocondriais. A membrana interna é dobrada em numerosas cristas que aumentam grandemente a sua área superficial total. Ela contém proteínas com três tipos de funções: (1) aquelas que conduzem as reações de oxidação de cadeia respiratória, (2) um complexo enzimático ATP sintase, que produz ATP na matriz, (3) proteínas transportadoras específicas, que regulam a passagem de metabólitos para dentro e para fora da matriz. Membrana externa, devido ao fato de conter uma grande proteína formadora de canais (porina), é permeável a todas as moléculas 5.000 daltons ou menos. Outras proteínas existentes nessa membrana incluem as enzimas que convertem substratos lipídicos em formas que possam ser subseqüentemente metabolizadas na matriz. (ALBERTS et al., 1997) 4. NÚCLEO ______________________________________________________________________ O núcleo quando observado na intérfase da divisão celular apresenta uma membrana envoltória denominada de envoltório nuclear, o qual abriga um conjunto heterogêneo de fibrilas e de áreas densas, formadas pela cromatina (cromossomos num estado relativamente desespiralizados) e o nucléolo. A cromatina, que abriga o material genético (DNA), apresenta duas regiões, que podem ser caracterizadas pelo grau de espiralização: a eucromatina (desespiralização máxima) e a heterocromatina (regiões do DNA que estão espiralizadas). Poros nucleares foram observados ao longo da membrana nuclear. Tais estruturas, de forma poliédrica, surgem pela junção da superfície interna e externa do envoltório nuclear. Os poros medem cerca de 50 a 80 nanômetros de diâmetro, ocupando de 10 a 30% da superfície da membrana. É através dos poros que ocorrem a passagem de substâncias entre o citoplasma e o interior do núcleo. Grânulos, provavelmente RNA, já foram vistos dentro dos poros, o que pode indicar que estariam de passagem em direção ao seu destino, o citoplasma. Outra estrutura que encontramos no núcleo é o nucléolo, de forma esférica, formado principalmente por RNA ribossômico enovelado, mais proteínas, fosfolipídeos e algum DNA. Os nucléolos há muito foram associados a produção de RNA. O envoltório nuclear, um saco achatado que envolve o núcleo, é de muita importância para as interações que ocorrem entre o núcleo e o citoplasma. Ao microscópio eletrônico, tal estrutura parece ser muito semelhante ao retículo endoplasmático, o que é confirmado pelos resultados de estudos citoquímicos, os quais também revelaram uma semelhança enzimática e bioquímica com aquela organela. A superfície externa da membrana nuclear (voltada para o citoplasma) apresenta grânulos de ribonucleoproteínas ligadas a ela; tais grânulos são provavelmente ribossomos (BIOTEMAS, 2003) 5. MICROSCOPIA DE FLUORESCÊNCIA ______________________________________________________________________ O surgimento dessa técnica de microscopia e seu uso na biologia devem-se ao conhecimento dos princípios básicos de fluorescência. Esse fenômeno pode ser descrito, de maneira genérica, como um tipo de luminescência (emissão de luz) em que um corpo absorve luz e logo depois a emite, durante curto intervalo de tempo. Há vários tipos de luminescência, conforme a fonte de energia, como eletroluminescência, adioluminescência, quimioluminescência e fotoluminescência. A última é a forma de luminescência que ocorre quando a fonte da energia absorvida são os fótons (radiação luminosa, inclusive a ultravioleta). Esse princípio é a base da microscopia de fluorescência, na qual compostos químicos denominados fluoróforos são usados para produzir fluorescência no material em estudo (células), ajudando a visualizar com maior nitidez estruturas ou processos em curso nesse material. Na biologia, os fluoróforos usados em microscopia são projetados para localizar uma área específica da amostra a ser observada ou para responder a um estímulo específico. Tais compostos permitem que os pesquisadores detectem componentes particulares do complexo biomolecular, inclusive de células vivas. Este processo apresenta três estágios: excitação, tempo de vida do estado de excitação e emissão de luz. (MICROSCOPIA, 2003) 5.1 MARCADORES FLUORESCENTES ______________________________________________________________________ 5.1.1 JC-1 Para detectar variações no potencial de membrana de células isoladas uma nova técnica de citofluorimetria usando JC-1 (1 - 5,5’,6,6’,-tetrachloro1,1’3,3’,tetraethylbenzimidazol carbocyanine iodide) tem sido utilizada. O JC-1 (marcador específico de mitocôndria) é capacitado a entrada seletiva na mitocôndria, já que fluoresce na de cor (verde) devido ao potencial de membrana. A vantagem do JC-1 é que ele pode ser qualitativo, considerando a emissão de fluorescência de verde para laranja e quantitativo, considerando a intensidade de fluorescência pura (REERS et al., 1991). 5.1.2 DAPI O DAPI é marcador fluorescente específico para ácido nucleico, parece estar associado com o complexo Adenina Timina. A ligação DAPI e DNA aumenta sua fluorescência em aproximadamente 20 vezes, aparentemente devido a deslocamento de moléculas de água do DAPI (MOLECULAR PROBES, 2003). 11.MATERIAL E MÉTODOS _____________________________________________________________________________________ 6. 1 CULTURA DE CÉLULAS 11.1.1 Linhagem Celular A linhagem celular utilizada neste trabalho foi Hep-2, carcinoma de laringe humana. Foram cultivadas em meio de cultura meio Mínimo Essencial - MEM (Gibco) suplementado com 10% de Soro Fetal Bovino - SFB, 1% de antibiótico Antibiotic Antimycotic (Gibco) e incubadas em atmosfera de 5% de CO2 a 37°C (estufa de CO2 marca Forma Scientific), em garrafas plásticas Nunc de 25cm2. As células foram adquiridas da Associação Técnico Científica Paul Ehrlich - URFJ - RJ. O estudo em cultura de células têm relevância especial para o melhor entendimento de problemas e aplicações da TFD. 11.1.2 Manutenção da Cultura Celular O estoque celular foi mantido em nitrogênio líquido. Partindo deste, foi preparado uma garrafa de cultura de 25cm2, contendo 1 ml de cultura de células (~106células/ml), adicionado-se 2 ml de meio de cultura MEM, enriquecido com 10% SFB. As células foram mantidas na estufa com controle automático de temperatura 37°C e pressão de CO2. O crescimento celular foi acompanhado por meio da observação em microscópio invertido Olympus CK40. Estas células foram subcultivadas após tripsinização, quando a densidade celular formava uma monocamada confluente. Após o período de 3 minutos com 2 ml de tripsina retirou-se a mesma, adicionando-se 3 ml de meio de cultura MEM suplementado com 10% de SFB. Para liberação das células da parede da garrafa, usouse jatos fortes com o auxílio de pipetador automático. Deste volume foram retirados alíquotas de 1 ml e passados para novas garrafas, adicionando-se mais 2 ml de meio MEM e incubadas em atmosfera de 5% de CO2 a 37°C. Para manter o estoque foi realizado o congelamento das células durante a utilização das mesmas. As células foram removidas das garrafas com auxílio da tripsina e centrifugadas por 8 minutos a 12000 rotações por minuto. Desprezou-se o sobrenadante e ressuspendeu-se o sedimento em meio de congelamento contendo 60% de meio MEM, 30% de SFB e 10% DMSO. Transferiu-se este material para criotubos e estocou-se em nitrogênio líquido. A C B D Figura 6.1. (A) Placa de 96 poços, (B) placa de 24 poços, (C) garrafa de cultura onde foram mantidas as células Hep-2 e (D) placa de Petri utilizadas em microscopia eletrônica. A 6.1.3 Reagentes, Soluções e Tampões Necessários Para Cultura Celular Meio de Cultura MEM - Minimum Essencial Medium - (Gibco) Soro Fetal Bovino - (Cultilab) Antibiótico Antimicótico (Gibco) Tripsina - (GibcoBRL- USA) Tampão fosfato - PBS - Preparado a partir de 50 ml de tampão Fosfato, 950 ml água destilada e 9 g NaCl (Merck) Tampão PHEM - (Sigma) Dimetil Sulfóxido DMSO - (Synth) 6.2 INCUBAÇÃO E IRRADIAÇÃO Preparação do Fotossensibilizador - A ZnPc sendo um fotossensibilizante hidrofóbico, exige um solvente para sua diluição, então foi empregado o Dimetil Sulfóxido (DMSO) como citado em outros trabalhos (KILANKZYC et al., 2002, WRÓBEL et al., 2001, SCHEMPP et al.,2001, FRACKOWIAK et al., 2001). Diluiu-se em tubo se microcentrífuga 0,57mg em 1 ml de DMSO formando então a solução estoque 1mM. O fotossensibilizador após o seu preparo, foi filtrado e mantido em estufa a 37°C por 24 horas para sua completa dissolução, posteriormente conservado em temperatura -28°C. Incubação - Células Hep-2 plaqueadas em placas de 24 poços (1x105 células/ml) foram incubadas com o fotossensibilizante ZnPc em uma concentração 4,5µM e 9µM por 60 minutos a 37°C. Ao término deste tempo lavou-se as células com PBS. Irradiação - As células em PBS foram irradiadas no escuro, utilizando um aparelho clínico portátil diodo laser 670 nm semicondutor Thera Lase - DMC, com meio ativo de fosfeto de índio-gálio-alumínio (InGaAlP). A irradiação foi utilizada em dois protocolos diferentes, no primeiro as células foram plaqueadas em placas de 24 poços destinadas a: doses variadas de energia, viabilidade celular após TFD e microscopia de fluorescência, enquanto que no segundo protocolo, as células foram plaqueadas em placas de Petri e foram destinadas ao tratamento para Microscopia Eletrônica. Ambos os protocolos mantiveram as doses de energia e potência iguais. Incubou-se as células após a irradiação com meio de cultura MEM suplementado com 10% de soro fetal bovino, por períodos de: 30 minutos, 1, 4, 12 e 24 horas. Figura 6.2. Laser Thera Lase - DMC, utilizado nas irradiações das células. Parâmetros Comprimento de onda (λ) Aparelho Valores para placa de Valores para placa de 24 Petri Poços 670 nm 670 nm Thera Lase - DMC Thera Lase - DMC Dose de Energia (E) 4,5 J/cm2 4,5 J/cm2 Densidade de Potência (P) 0,025 W 0,025 W Área 9,6 cm2 0,8 cm2 28 minutos e 8 segundos 144 segundos 20 cm 7 cm 3,48 cm 1 cm Tempo Distância da fibra a placa Diâmetro do feixe Tabela 6. 1. Parâmetros utilizados para irradiação em placas de Petri e placas de 24 poços. 6.3 TESTE DE CITOTOXICIDADE 6.3.1 Teste de MTT. Reagentes Necessários para MTT MTT(3-(4,5-dimethylthiazolone-2-yl)-2,5-diphenyl tetrazolium bromide) - (Sigma) Dimetil Sulfóxido DMSO - (Synth) Tampão fosfato PBS - Preparado a partir de 50 ml de tampão Fosfato, 950 ml água Destilada e 9 g NaCl (Merck). A técnica de MTT é um ensaio quantitativo para determinar a interrupção de uma função bioquímica crítica. Este ensaio quantifica atividade mitocondrial medindo- se a formação de cristais de formazana, produto formado pela redução de tetrazoliuo MTT. A redução do MTT ocorre principalmente na mitocôndria através da ação da succinato desidrogenase fornecendo então uma medida da função mitocondrial. (LOBNER, 2000). Plaqueamento - As células Hep-2 foram plaqueadas (5x104 células/mL) em microplacas de 96 poços, com meio de cultura MEM suplementado com 10% de soro fetal bovino (SFB) para adesão das células em estufa de CO2 5% e temperatura 37 ºC incubadas overnight. No dia seguinte foi retirado o meio de cultura, lavadas as células três vezes com PBS para que fosse removido totalmente o meio com SFB pois a presença de elementos do soro poderiam modificar a interação das células com a droga in vitro (RICHTHER et al., 1990), e acrescentado as concentrações de ZnPc e DMSO (1, 2, 4, 9, 11 e 22 µl de ZnPc e as porcentagens de DMSO que corresponderam a este volume de droga: (0,1; 0,2; 0,4; 0,9; 1,8; 2,2; e 4,4 %) em seus respectivos poços para o teste. ZnPc (µM) % DMSO ZnPc retirado PBS (µl) do estoque (µl) Volume Total (µl) 1 0,1 0,2 199,8 200 2 0,2 0,4 199,6 200 4 0,4 0,8 199,2 200 9 0,9 1,8 198,2 200 11 1,1 2,2 197,8 200 22 2,2 4,4 195,4 200 Tabela 6. 2. Concentrações e volumes utilizados de ZnPc e DMSO. O tempo de incubação das células com o corante foi de 1 hora a 37ºC em uma atmosfera de 5% de CO2. Após este período foi retirado o corante, as células foram lavadas com PBS 3x e novamente incubadas com meio de cultura MEM contendo 10% de SFB. Após a incubação por 24h na mesma atmosfera, foi realizado o teste de MTT. Incubação com MTT submetidas ao tratamento - Após o período de incubação as células foram de MTT(3-(4,5-dimethylthiazolone-2-yl)-2,5-diphenyl tetrazom bromide) onde adicionou-se 10µL, uma concentração final de 0,5 mg/ml de MTT-formazana deixando-as incubadas por 4h a 37°C em atmosfera de 5% de CO2. Adição do Solvente - Sobre os precipitados de formazana adicionou-se o solvente orgânico DMSO (200µL) em cada poço. Processo de solubilização - A placa foi mantida sob agitação para a solubilização dos cristais de formazana por 10 minutos. Leitura - A leitura da absorbância, 570 nm, foi realizada no leitor de ELISA Spectra Count. Os dados obtidos foram tratados de acordo com a fórmula: % Viabilidade = (Absorbância de Células Tratadas - Absorbância do Branco) x 100 (Absorbância de Células Controle - Absorbância do Branco) Onde o branco é representado pela absorbância do poço vazio. Após este tratamento os resultados foram plotados no programa GraphPad Prism com média e desvio padrão de 6 amostras em triplicata. 6.3.2 Teste de exclusão com Azul de Tripan - após doses de Energia Esta técnica é utilizada para análise da integridade da membrana celular. Uma definição comum para morte celular é baseada em mudanças na permeabilidade membrana celular. A técnica Azul de Tripan define a morte da célula como uma mudança nas propriedades da membrana tal que em uma célula morta, este corante se difunde rapidamente para dentro do citoplasma, enquanto que em uma célula viva, sua membrana plasmática não permite a penetração do corante. Conservado em câmara fria entre 2 a 8 °C. (SPIKES, 1998). Plaqueamento - As células foram plaqueadas em uma densidade de 1x105 células/ml em poços alternados em placas de 24 poços. Depois da adesão das células por 24 h estas foram incubadas com o fotossensibilizador ZnPc por uma hora a 37ºC em atmosfera de 5% de CO2. Após lavadas com PBS foram novamente incubadas com PBS para a irradiação. Irradiação - Para irradiação foi utilizado laser Thera Lase (DMC), um semicondutor, com uma potência de 25mW e comprimento de onda (λ) de 670 nm. O tempo foi variado de acordo com as diferentes doses de energia: 0,5; 1,5; 2,5; 3,5 e 4,5 J/cm2. A irradiação foi realizada no escuro e em seguida o PBS foi removido e adicionado meio de cultura e incubou-se por 24 e 48 horas a 37ºC em atmosfera de 5% de CO2. Contagem Celular - Após 24h de incubação realizou-se a contagem de células vivas e mortas por exclusão do Azul de Tripan. Os valores foram obtidos por contagem em microscópio invertido de fase. Adicionou-se 5 µL de Azul de Tripan 0,4% no poço contendo 195µL de PBS, incubou-se por 5 minutos a 37ºC em atmosfera de 5% de CO2 e realizou-se a contagem. 6.3.3 Exclusão com Azul de Tripan - após a Terapia Fotodinâmica. Plaqueamento - As células Hep-2 foram plaqueadas (1x105 células/ml) após sua adesão em 24 h, foram submetidas a incubação com fotossensibilizador (ZnPc) por 1 h em uma concentração 4,5 µM e 9 µM a 37°C. Após este período as células foram lavadas 2x com PBS e mantidas novamente com PBS para irradiação. Irradiação - A irradiação foi realizada por 144s. Foi utilizado o diodo laser 670 nm, a dose de luz foi de 4,5 J/cm2, potência de 0,025W, com uma distância de 7cm da saída do laser até os poços, realizada no escuro. Em seguida foi retirado o PBS, incubadas novamente na estufa a 37ºC em atmosfera de 5% de CO2 com meio cultura MEM suplementado com 10% de soro fetal bovino. Foram incubadas de acordo com o protocolo já definido nos tempos de 30 minutos, 1, 4, 12 e 24 horas. Contagem Celular - Obteve-se a viabilidade através do teste de Azul de Tripan, ao final de cada tempo de incubação descritos acima. Os resultados de viabilidade celular após a Terapia Fotodinâmica foram plotados em histograma no programa de computador GraphPad Prism. 6.4 MICROSCOPIA DE FLUORESCÊNCIA Reagentes Necessários para Microscopia de Fluorescência Tampão PHEM - (Sigma) Tampão Fosfato 0,1M (pH 7,2) Glutaraldeído (Fluka - Biochemica) Paraformaldeído 4% (Sigma) Marcador para núcleo DAPI - 4', 6' - diamidino, 2' phenylindole- 5 µM - (Molecular Probes) Marcador para mitocôndria JC-1 - 5,5’,6,6’,-tetrachloro-1,1’3,3’,tetraethylbenzimidazol carbocyanine iodide - (Molecular Probes Inc. USA) 6.4.1 JC-1 - Marcação para Mitocôndria A fluorescência verde de JC-1 ocorre quando este encontra-se como monômero em baixas concentrações ou em baixo potencial de membrana. Em altas concentrações (soluções aquosas acima de 0,1 µM) ou altos potenciais, o marcador JC-1 forma agregados com fluorescência verde alaranjado, que exibe um espectro em aproximadamente em 590 nm. Na verdade a emissão deste marcador pode ser utilizada como estimativa do potencial elétrico da membrana mitocondrial. Marcação - As células submetidas a TFD, assim como os controles sem tratamento, foram marcadas com 0,13µl de JC-1 (5,5’,6,6’,-tetrachloro- 1,1’3,3’,tetraethylbenzimidazol carbocyanine iodide - Molecular Probes Inc. USA), diluídos em 100µl de PBS em uma concentração final de 10 µM, incubou-se por15 minutos e lavou-se com PBS. Realizou-se a marcação com JC-1 fixou-se as células com 4% de paraformaoldeído em 0,1M de tampão fosfato (pH 7,2) por 10 minutos e lavouse com PBS. A seguir as lamínulas foram montadas sobre lâminas contendo N-propil galato, vedadas com esmalte na periferia da lamínula. Realizou-se toda manipulação do material ao abrigo de luz. As lâminas foram analisadas em Microscópio de Fluorescência Leica DMLB utilizando o filtro de excitação e emissão aproximadamente de 530 e 590 nm, respectivamente. 6.4.2 DAPI - Marcação para Núcleo Fixação – As células submetidas a TFD, assim como os controles sem tratamento, foram fixadas com 4% de paraformaoldeído em 0,1M de tampão fosfato (pH 7,2) por 10 minutos e foram lavadas com PBS. Adicionou-se 0,06µl de DAPI, diluídos em 200µl de PBS a uma concentração final de 0,03 µM, incubou-se por10 minutos e lavou-se com PBS. A seguir as lamínulas foram montadas sobre lâminas contendo N-propil galato, vedadas com esmalte na periferia da lamínula. Realizou-se toda manipulação do material ao abrigo de luz. As lâminas foram analisadas em Microscópio de Fluorescência Leica DMLB utilizando aproximadamente de 358 nm e emissão de 461 nm. 6.5 MICROSCOPIA ELETRÔNICA Reagentes Utilizados : Tetróxido de Ósmio 1% (Fluka - Biochemica) Tampão Fosfato 0,1M (pH 7,2) o filtro de excitação em Glutaraldeído (Fluka - Biochemica) Paraformaldeído 4% (Sigma) Acetona 50, 70, 90 e 100% (Carlo Erba Reagenti) Ferricianeto de Potássio (Carlo Erba Reagenti) Acetato de Uranila 5% (Sigma) Citrato de Chumbo (Polysciences, Inc.) Plaqueamento - As células foram plaqueadas em placas de Petri de 35x10 mm em uma densidade celular de 1,5x 106 cels/ml e deixadas 24h para adesão celular em estufa a 37ºC em atmosfera de 5% de CO2 com meio cultura MEM suplementado com 10% de soro fetal bovino. Para Microscopia Eletrônica foram utilizados quatro grupos experimentais: grupo controle, controle somente droga, grupo controle somente laser e grupo tratado pela TFD. Incubação com o fotossensibilizante - As células foram lavadas 2x com PBS e incubou-se com o fotossensibilzador por 1 hora no escuro. Para o grupo controle-droga depois deste período as células foram lavadas com PBS e incubadas com meio MEM suplementado com 10% de SFB em 37ºC em atmosfera de 5% de CO2. Já o grupo de TFD após a incubação com a droga foi lavado com PBS e mantido em PBS novamente para seguir a irradiação. Irradiação - As células foram irradiadas com laser Thera Lase (DMC), um semicondutor com comprimento de onda (λ) de 670 nm por 28 minutos e 8 segundos, onde a dose de energia foi 4,5 J/cm2 e potência de 0,025 w, respeitando uma distância de 24cm da ponteira do laser até a placa de Petri, para que se formasse um feixe com uma área de 9,6cm2 cobrindo a placa. Toda a irradiação foi mantida no escuro. No momento seguinte as células foram incubadas com meio de cultura MEM suplementado com 10% de soro fetal bovino, por um períodos de 30 minutos, 1, 4, 12 e 24 horas na estufa a 37ºC em atmosfera de 5% de CO2. Após estes períodos retirou-se o meio, as células foram lavadas com PBS e adicionou-se fixador. Fixação – A suspensão celular foi centrifugada (10 minutos/3000 rotações por minuto), desprezou-se o sobrenadante e ressuspendeu-se as células em 300µl de fixador. Transferiu-se este para a placa de Petri com as células e completou-se com fixador para 600µl, onde foram deixadas por 2 horas em temperatura ambiente. Fixador: tampão Fosfato 0,1M (pH 7,2).............2,50ml Glutaraldeído 2,5%...............................0,50ml paraformoldeído 4% .............................2,0ml 5,0ml Esta etapa visa matar rapidamente as células preservando sua estrutura e permeabilizando-as, a fim de permitir a penetração do próprio fixador e de outras substâncias. Na microscopia eletrônica os fixadores mais utilizados são os formaldeídos, o glutaraldeído e tetróxido de ósmio. O glutaraldeído forma ligações cruzadas entre as proteínas por possuir dois grupamentos aldeído em sua molécula. Geralmente é utilizado numa concentração de 2,5% em tampão. O formaldeído não forma ligações cruzadas, sendo muito empregado para preservar a integridade bioquímica e antigênica das células. Após fixação as células foram removidas e centrifugadas (3000 rotações por minuto por 10 minutos) em microcentrífuga lavandoas por 3 vezes. Pós-fixação - Adicionou-se 200µl de Tetróxido de Ósmio (OsO4) da solução estoque a 2% (diluído em tampão fosfato 1:1) e deixados por exatos 30 minutos. Passado este tempo lavou-se 3 vezes com PBS. O OsO4 é utilizado na segunda fixação e é um excelente fixador de lipídios. Sendo o tetróxido de ósmio um metal pesado, também confere certo contraste às membranas. Por outro lado, o poder de penetração do ósmio é reduzido (1mm/h), requerendo que as amostras sejam bem pequenas e finas (1 a 2 mm). O tetróxido de ósmio também se reduz em presença de luz, é volátil e extremamente tóxico. Por estes motivos sua manipulação deve ser feita sob exaustores especiais (capela) e no escuro. Desidratação - A desidratação consiste na passagem das amostras por uma série de concentrações crescentes de acetona ou etanol até atingir 100% Incubou-se as amostras nas diferentes concentrações de acetona: Acetona 50% incubada por 10 minutos Acetona 70% incubada por 10 minutos Acetona 90% incubada por 10 minutos Acetona 100% incubada 3 vezes por 10 minutos. Uma vez que a coluna dos microscópios eletrônicos permanece constantemente em vácuo, a observação de células hidratadas levaria a vários problemas como evaporação desta água no interior da coluna, interferindo na trajetória de feixe e levando à queima do filamento. Além disso, as células se romperiam e se deformariam profundamente. A etapa da desidratação tem por objetivo a substituição subseqüente destes solventes orgânicos por resinas epoxi ou acrílicas que geralmente não são miscíveis em água. Entretanto estas resinas só são utilizadas no caso do processamento para microscopia eletrônica. Infiltração - Preparou-se em um tubo de microcentrífuga uma mistura acetona epon 1:1, transferiu-se a mistura para o sedimento. Deixou-se overnight, no dia seguinte retirou-se a mistura e adicionou epon puro na mesma quantidade. As resinas utilizadas em microscopia eletrônica são inicialmente líquidas, infiltrando-se lentamente em todos os espaços intra e extracelulares, substituindo a acetona utilizada na desidratação. Inclusão - No final do dia seguinte removeu-se o material para a fôrma e epon puro foi adicionado. Permaneceu na estufa por 48 horas para polimerização da resina e a formação do bloco. Ultramicrotomia - O bloco com material foi cortado em cortes ultrafinos (60 e 70 nm) em um ultramicrótomo (Ultracut UCT, Leica) e coletados em grades (300 mesh, Leica). Contrastação - Deixou-se as grades contendo os cortes sobrepostas gotas de acetato de uranila 5% por exatos 30 minutos. Em seguida, lavou-se suavemente 10 vezes em água destilada e secou-se em papel de filtro. Incubou-se por 5 minutos os cortes em citrato de chumbo, e lavou-se suavemente em água destilada 3 vezes. Análise - As grades foram analisadas em Microscópio Eletrônico de Transmissão marca ZEISS modelo EM10, no laboratório de Microscopia Eletrônica da Faculdade de Odontologia de Piracicaba - Universidade Estadual de Campinas Campus Piracicaba. 7. RESULTADOS ____________________________________________________________ 7.1 Relação entre Número de Fótons/Moléculas e Células Para que a TFD tenha um resultado satisfatório é necessário que o protocolo aplicado obedeça uma norma onde o número de fótons tem que ser muito maior que o número de moléculas e o de moléculas muito maior que de células. ü Número de moléculas: Partindo da concentração utilizada no protocolo temos 9 ìM de fotossensibilizador ZnPc ou 9x10-6 moles/litro, sendo M = mol/l = 6,02 x 1023 moléculas/litro temos: 9x10-6 mol ----- 1 litro X ----------------- 1x10-3 X = 9x10-9 mol/ml 6,02 x 1023 moléculas 1 mol --------- 9x10-9 mol ----------- x X = 5,4 X 1015 moléculas/ml ü Cálculo do número de Fótons: ν = freqüência c = velocidade da luz do vácuo λ = comprimento de onda N = número de fótons D. E. = dose de energia h = constante de Planck ν= c λ N = D.E = 3. 108 m/s = 4,45 . 1014 Hz 675. 10-9 = N= 4,5 J/cm2 = 1,6 x 1019 fótons/cm2 h.ν 6,626 x 10-34 4,45 . 1014 Hz ü Número de células utilizadas 1x105 células/ml. De acordo com os cálculos acima foi estabelecido o protocolo respeitando o número de fótons muito maior que moléculas, aumentando assim a probabilidade das moléculas serem ativadas pelos fótons. Permanecendo a mesma relação entre moléculas, tendo seu número muito maior que o número de células. Relação entre do número de fótons/moléculas e células: 1,6 x 1019 (fótons/cm2) >> 5,4 X 1015 (moléculas/ml) >> 1x105 (células/ml). 7.2 Absorbância da ZnPc Figura 7.1: Espectro de absorção da ZnPc filtrada na concentração de 9µM em DMSO. Pico de absorção em 675 nm. 7. 3 Teste De Citotoxicidade 7.3.1 Para Padronização da Concentração do fotossensibilizador Zinco Ftalocianina O teste de MTT foi aplicado para analisar a citotoxicidade do fotossensibilizador ZnPc nas diferentes concentrações (1; 2; 4,5; 9; 11 e 22 µM) frente a linhagem Hep-2. Objetivando ainda encontrar a máxima concentração de ZnPc na qual a linhagem Hep-2 demonstrasse uma alta percentagem de sobrevivência celular na ausência de luz. Os resultados demonstraram uma queda na percentagem de sobrevivência em aproximadamente 95 e 80%, somente nas maiores concentrações 11 e 22 µM respectivamente (gráfico 7.1). Afirmando assim que ZnPc apresenta baixa toxicidade, característica esta necessária para os fotossensibilizadores. Com estes dados determinamos as condições de tratamento para TFD utilizando as concentrações de 4,5 % Viabilidade Celular e 9µM. ZnPc Controle 100 80 60 40 20 0 c 1 2 4,5 9 11 22 Concentração µM de ZnPc Gráfico 7.1. Viabilidade de Células Hep-2 após 24h do tratamento com fotossensibilizador Zinco ftalocianina (ZnPc), média e desvio padrão de 6 experimentos. 7.3.2 Citotoxicidade para concentrações do DMSO Baseado no mesmo objetivo que a citotoxicidade da ZnPc, este teste foi aplicado também ao seu veículo DMSO procurando encontrar a máxima concentração para o qual a linhagem Hep-2, demonstrasse uma alta percentagem de sobrevivência celular na ausência de luz. A incubação foi realizada por 60 minutos. Para as células tratadas somente com o DMSO, observou-se uma queda em 1,1% e 2,2%, mantendo a porcentagem de células vivas na faixa de 93% e 92% respectivamente (gráfico 7.2). O veículo DMSO não se mostrou tóxico nas Viabilidade Celular % concentrações utilizadas permanecendo o número de células vivas acima de 90%. 110 100 90 80 70 60 50 40 30 20 10 0 * c 0,1 0,2 0,4 0,9 1,1 Controle DMSO 2,2 Concentrações DMSO % Gráfico 7.2. Viabilidade de Células Hep-2 após 24h de incubação com DMSO variando as concentrações média e desvio padrão de 6 experimentos. Asterisco indica diferença significativa do tratamento em relação ao controle como determinado pelo programa ANOVA seguido pelo teste Dunnett (P< 0,05). 7.4 Teste de Viabilidade Celular 7.4.1 Para Padronização da Dose de Energia A viabilidade celular no tratamento variando as doses de energia empregadas sob as células Hep-2, teve como objetivo definir a maior dose de energia que pudesse ser utilizada mas com uma alta percentagem de sobrevivência celular. As doses de energia utilizadas foram 0,5; 1,5; 2,5; 3,5 e 4,5 J/cm2. A irradiação foi realizada no escuro e a contagem celular foi realizada após 24 horas. Os resultados demonstraram (gráfico 7.3) em todas as doses de energia uma alta viabilidade celular, dentre estas optamos para o tratamento de TFD a dose maior de 4,5 J/cm2, apresentando 95% de viabilidade. Este resultado confirma também que o tratamento somente com a luz assim como o fotossensibilizador sozinhos (gráfico 7.1) Viabilidade Celular % não apresentam morte para as células neoplásicas, ou alterações fisiológicas. 100 90 80 70 60 50 40 30 20 10 0 Controle Irradiadas C 0,5 1,5 2,5 3,5 4,5 Densidade de energia J/cm2 Gráfico 7.3. Viabilidade Celular linhagem Hep-2 irradiadas sem corante, variando dose de Energia entre 0,5 a 4,5Jcm2. Usando o método de Azul de Tripan após 24 h da irradiação. Média e desvio padrão de 6 amostras. Não houve diferença significativa do controle em relação às irradiadas como determinado pelo programa ANOVA seguido pelo teste Dunnett (P< 0,05). 7.4.2 Viabilidade Celular Após a Terapia Fotodinâmica Os resultados anteriores de citotoxicidade da ZnPc (gráfico 7.1) e viabilidade celular com as doses de energia (gráfico 7.2), foram utilizados para determinar as condições de tratamento para a TFD utilizando 4,5 e 9 ìM de ZnPc e 4,5 J/cm2. Após incubação de 1 hora, as células foram contadas em microscópio invertido de fase pelo método de exclusão de Azul de Tripan. Média e desvio padrão foram obtidos de 3 experimentos em duplicata e permitiram a elaboração dos gráficos pelo programa Graph Pad Prism. O protocolo aplicado neste tratamento em células Hep-2 com o fotossensibilizador ZnPc apresentou viabilidade celular de 11,5 e 4% (gráfico 7.4.) Viabilidade Celular % confirmando resultado esperado na Terapia Fotodinâmica com baixa viabilidade. 100 90 80 70 60 50 40 30 20 10 0 TFD 24h TFD 48h * * * * c 4,5 9 Concentração µ M Gráfico 7.4 - Viabilidade de células Hep-2 sob tratamento TFD, frente a administração do corante ZnPc nas concentrações 4,5 e 9 ìM, analisados em 24 e 48 horas após o tratamento. Nota-se uma viabilidade de aproximadamente 4% na concentração 9 ìM 24 horas após o tratamento. Asterisco indica diferença significativa do controle em relação a TFD como determinado pelo programa ANOVA seguido pelo teste Dunnett (P< 0,05). 7.5 Microscopia De Fluorescência 7.5.1 Microscopia de Fluorescência - Marcação Mitocôndria A atividade e potencial de membrana mitocondrial após a TFD foram avaliados com auxílio da microscopia de fluorescência, através da marcação com o marcador JC1, especifico para mitocôndria. As células foram incubadas com o marcador após o tratamento de TFD, bem como aquelas tratadas com laser e ZnPc (respeitando o protocolo com todos os tempos: 30 minutos, 1, 4, 12 e 24 horas). As células controle (sem tratamento e tratamento somente ZnPc) apresentaram morfologia normal com distribuição de mitocôndria por todo citoplasma e aspecto filamentoso (morfologia observada em todos os tempos do protocolo), figura 7.2. A microscopia de fluorescência nos revelou um alto potencial de membrana no tratamento somente laser, observa-se um intenso agrupamento de mitocôndria distribuída no citoplasma, enquanto a periferia apresenta um número reduzido (figura 7.3A). A análise das células marcadas com JC-1 30 minutos após a TFD, revelou a presença de mitocôndrias com aspecto granular, distribuídas no citoplasma (figura 7.3B), porém em número reduzido quando comparado aos grupos controles (figura 7.2A/B). Doze horas após a TFD, observou-se prolongamentos da membrana citoplasmática, sugerindo inicio da formação de corpos apoptóticos, fato confirmado com as células 24 horas após o tratamento, com o comprometimento total do núcleo e membrana plasmática com formação de corpos apoptóticos (figura 7.4B e 7.5 respectivamente). Observou-se baixo potencial de membrana com concentração de mitocôndrias ao redor do núcleo, apresentando-se escassas na região periférica do citoplasma e evidente retração celular, doze horas após TFD (figura 7.4A). Figura 7.2: Atividade mitocondrial em células não irradiadas. (A) Células Hep-2 marcadas com JC-1, nota-se mitocôndrias distribuídas em todo citoplasma apresentando baixo potencial de membrana e aspecto filamentoso. (B) Após incubação com ZnPc as células Hep-2 foram marcadas com JC-1. Nota-se mitocôndrias com a mesma distribuição e aspecto das células controle. 2500x. Figura 7.3: (A) Células Hep-2 marcadas com JC-1 incubadas 24 horas após tratamento somente laser, é evidente intenso agrupamento de mitocôndria na região perinuclear, enquanto na periferia este número diminuiu. (B) Células incubadas 30 minutos após o tratamento TFD, nota-se mitocôndrias com baixo potencial de membrana, pequenas concentrações granulares sendo bem clara a redução deste potencial em relação aos controles. 2500x. Figura 7.4: (A/B) Células Hep-2 marcadas com JC-1 12 horas após tratamento TFD. (A) As mitocôndrias apresentam baixo potencial e localizam-se na região perinuclear (seta), enquanto a periferia do citoplasma encontra-se escassa ( ), é bastante clara a retração celular (cabeça de seta). (B) Observa-se prolongamento, bolhas, na membrana plasmática sugerindo início de formação corpos apoptóticos. 2500x. Figura 7.5: Célula Hep-2 marcadas com JC-1 12 horas após o tratamento TFD. As células apresentam comprometimento total de núcleo e membrana plasmática com formação de corpos apoptóticos. 2500x. 7.5.2 - Microscopia de Fluorescência - Marcação Núcleo A visualização das células com o marcador DAPI núcleo, nos forneceu informações sobre o núcleo e membrana nuclear, permitindo assim apontar as alterações após os tratamentos: somente laser, somente fotossensibilizador e terapia fotodinâmica. O grupo controle (sem tratamento), bem como os controles tratamento somente laser e somente droga aplicados as células, não apresentaram alterações na estrutura nuclear (observada na figura 7.6A/B controle 1 hora e 12 horas após laser). Esta observação é válida para todos os tempos do controle (30 minutos, 1, 4, 12 e 24 horas) somente laser bem como para controle somente droga. Observa-se membrana nuclear íntegra e bem delineada no grupo de células tratadas somente com droga , não sendo notado alterações no núcleo (figura 7.7A). Enquanto a luz laser aplicada após a sensibilização com a ZnPc, em 30 minutos provocou comprometimento da membrana nuclear com clara fragmentação do núcleo (figura 7.7B e 7.8A). Constatou-se retração celular devido diminuição da adesão 1 hora após o tratamento da TFD e comprometimento da membrana nuclear com a formação de prolongamentos ao longo da mesma (figura 7.8B). A formação de bolhas ao longo da membrana plasmática foi bastante constante após tratamentos TFD (figura 7.9 A/B). Figura 7.6: (A) Grupo de células Hep-2 controle, sem tratamento, (B) tratadas somente com laser marcadas com DAPI. Observa-se núcleo preservado, cromatina e membrana nuclear intactas. 2.500x. Figura 7.7: Célula Hep-2 marcadas com DAPI, (A) controle tratadas somente com ZnPc o núcleo permanece normal. (B) Após o tratamento TFD incubadas 30 minutos com meio MEM a membrana apresenta alterações morfológicas com perda da integridade nuclear (cabeça de seta) 2.500x. Figura 7.8: Células Hep-2 marcadas com DAPI. (A) Nota-se fragmentação nuclear e comprometimento da membrana (30 minutos após TFD). (B) Após 1 hora de tratamento TFD é possível observar retração celular e formações de prolongamentos nucleares (cabeça de seta ). 2500x. Figura 7.9: (A/B) Células Hep-2 marcadas com DAPI. É possível observar e comprometimento da membrana plasmática com formação de bolhas, após 1 e 12 horas (respectivamente) de tratamento. 2500x. 7.6 Microscopia Eletrônica A microscopia eletrônica nos permitiu analisar ultraestruturalmente as alterações ocasionadas às células Hep -2, devido o tratamento de TFD, assim como compará-las aos controles em sua morfologia natural. As células controles apresentaram a morfologia normal em todos os tempos com mitocôndria e membrana plasmática intactas (figura 7.10A), cromatina homogeneamente distribuída e membrana nuclear preservada, sendo possível ainda identificar as cristas mitocondriais. O grupo controle de células tratadas somente com fotossensibilizador ZnPc não apresentou alterações morfológicas, como esperado. Observa-se a integridade das organelas no citoplasma como complexo de Golgi, mitocôndrias (figura 7.10B) em todos os tempos. Após 30 minutos da TFD (figura 7.11A/B) notam-se alterações morfológicas como cromatina condensada na periferia, um afastamento da membrana nuclear em relação ao citoplasma, em conseqüência da perda de adesão da membrana nuclear. Tais características não são observadas no controle. É bastante evidente a invaginação da membrana nuclear, sugerindo futura formação de corpos apoptóticos e presença de vacúolos (figura 7.11A/B). Observa-se nítidas invaginações da membrana nuclear, cromatina condensada, após 24 do tratamento. É interessante notar que a grande maioria do conteúdo citoplasmático está envolvido por membrana citoplasmática de forma organizada (figura 7.12A/B) Figura 7.10: (A) Células Hep-2 (Controle: sem tratamento). Microscopia Eletrônica apresentando mitocôndrias (M), membrana plasmática (MP) e nuclear preservadas e núcleo intacto (N). (B) Células Hep-2 Controle: tratamento somente fotossensibilizador ZnPc após 30 minutos de incubação. Nota-se a integridade das organelas no citoplasma complexo de Golgi (G) mitocôndrias e núcleo (N). 3.270x MP N M G N Figura 7.11: (A/B) Células Hep-2 30 minutos após tratamento com TFD. Observa-se cromatina condensada na periferia (cabeça de seta grande) e um afastamento da membrana nuclear em relação ao citoplasma (cabeça de seta pequena). Nota-se um início de invaginação da membrana nuclear (seta) e presença de vacúolos (V). (A) 3.270 e (B) 3.810x. V Figura 7.12: (A/B) Células Hep-2 24 horas após tratamento com TFD. Observa-se (duas) nítidas invaginações da membrana nuclear ( ), cromatina condensada (c), extensa tumefação das organelas, conteúdo do citoplasma envolvido por membrana citoplasmática de forma organizada (cabeça de seta). (A) 2.030 e (B) 1.450x. C 8. DISCUSSÃO _____________________________________________________________________________________ Devido a estrutura hidrofóbica, as ftalocianinas localizam-se em uma ou mais membranas celulares. Usuda (2003) relatou que a ftalocianina 4 (Pc4) interage com células tumorais preferencialmente na membrana mitocondrial, no retículo endoplasmático e no complexo de Golgi. Segundo Juarranz et al., (2001), é bem conhecido que a reação de fotossensibilização é dependente da localização do fotossensibilizador. Neste sentido diferentes localizações subcelulares têm sido descritas para ZnPc, dependendo da linhagem celular tais como: distribuição difusa no citoplasma de células epiteliais RR 1012 (RÜCK et al., 1996), localização na membrana plasmática de fibroblasto de embrião de rato, em Complexo de Golgi ou mitocôndria em células NHIK 3025 (RODAL et al., 1998). Além disso, é conhecido que o 1O2 tem um curto tempo de vida, portanto inicialmente as reações de oxidação ocorrem em organelas nas quais os fotossensibilizadores se ligam e secundariamente em outras estruturas celulares. Os resultados no teste de citotoxicidade demonstraram uma queda na percentagem de sobrevivência de aproximadamente 95 e 80%, somente nas maiores concentrações, 11ìM ZnPc apresenta e 22 ìM respectivamente (gráfico 7.1). Afirmando assim que baixa toxicidade, característica esta necessária para os fotossensibilizadores. O fato do fotossensibilizador não ser tóxico no escuro, reflete como vantagem na aplicação clínica, pois não há necessidade de se preocupar com a toxicidade em órgãos como fígado, rins, baço e medula óssea, uma vez que estes órgãos encontram-se ao abrigo de luz em humanos (MOAN et al., 1992). As ftalocianinas são acumuladas em larga quantidade no fígado, como é típico da maioria dos fotossensibilizadores hidrofóbicos, os quais são predominantemente eliminados do organismo pelas vias intestinais e biliar. A ZnPc apresenta máxima concentração no fígado de 3,27 + 0,62 nmol/g em 24 horas. (JORI; FABRIS, 1998). Estudos recentes sugerem que a estrutura química pode fortemente influenciar a localização das ftalocianinas em células tumorais, e o início da resposta apoptótica é modulada pelo tipo de interação do fotossensibilizador adjacentes (JORI; FABRIS. 1998). com a organela alvo e É necessário notar que as células tratadas somente com luz e as células tratadas somente com a ZnPc não apresentam mudanças morfológicas no núcleo. Afirmação que pode ser constatada pela microscopia de fluorescência, com marcador DAPI (núcleo), observa-se distribuição normal da cromatina e membrana nuclear intacta após incubação com fotossensibilizador e após tratamento com laser. A análise ultraestrutural pela microscopia eletrônica confirma estes resultados; reforçando ainda os resultados de viabilidade celular com dose de energia variada, os quais demonstraram alta viabilidade. Notamos em nosso trabalho que as células controle tratadas somente com irradiação, exibiram fluorescência mais intensa indicando um alto potencial de membrana, uma vez que a utilização do marcador JC-1 permite visualizar as alterações na morfologia, funcionamento e alterações destas organelas. Resultado previsto, uma vez que o laser utilizado diodo, é um Laser de Baixa Potência (dose de energia utilizada 4,5 J/cm2) ocorrendo efeito de bioestimulação. Para se obter o efeito bioestimulador é necessário que se administre doses baixas (dose de energia de 2 a 4 J/cm2) do laser operando na região do vermelho e infravermelho, sendo que sob doses altas de energia as células são destruídas (CARNEVALLI, 2001; LUBART et al, 1992; KARU et al, 1995; RIGAU, 1996). Yu et al. (1997) e Karu, (1999), demonstraram através de estudos que a irradiação de células cultivadas in vitro com laser de baixa potência, aumenta a síntese de ATP, certificada através da intensa fluorescência de JC-1. Deformações na membrana plasmática, como bolhas, têm sido observadas imediatamente após a TFD com culturas celulares com vários sensibilizadores, e são considerados como uma manifestação morfológica da membrana danificada relacionada com alterações no citoesqueleto (JUARRANZ, et al., 2001). Esta protuberância na membrana plasmática deve-se a um aumento da fluidez da mesma pelo possível comprometimento dos componentes do citoesqueleto em contato com a superfície celular, uma vez que os filamentos do citoesqueleto servem de âncora que conectam a membrana plasmática ao interior da célula (MARTINKOVICS, 2002). É possível observar 12 horas após TFD, prolongamentos da membrana plasmática, protuberâncias (figuras 7.4B, 7.9B e 7.9A), que confirmamos com a microscopia eletrônica em células submetidas a TFD, após 30 minutos; observa-se cromatina condensada e perda da adesão nuclear, características também descritas por Zhou et al, (1996). Estas protuberâncias evidentes na superfície das células sugerem início de formação de corpos apoptóticos, o que é confirmado com o tratamento observado 24 horas após TFD (figura 7.5), com formação de corpos apoptóticos. Células que sofrem apoptose apresentam mudanças morfológicas típicas incluindo deformação do núcleo, condensação da cromatina, formação de protuberância na membrana plasmática e fragmentação de DNA (ZHOU et al, 1996). Várias destas mudanças foram constatadas repetidamente neste estudo com ZnPc em diferentes tempos após a TFD, observadas em microscopia eletrônica e microscopia de fluorescência; portanto é consistente a hipótese de que linhagem celular Hep-2 sensibilizadas com a ZnPc após a TFD sofre morte celular por apoptose. Células em apoptose, danificadas pela fotossensibilização, perdem a aderência com outras células e com o substrato, indicando que ambas as estruturas do citoesqueleto a actina e α-actina foram também alteradas pela TFD. Neste sentido a actina tem sido descrita como participante na formação de corpos apoptóticos (COTTER et al., 1992.). Nas figuras 7.4A e 7.8B, representadas por células após o tratamento fotodinâmico, nota-se uma acentuada retração celular em conseqüência da perda da adesão celular. O tempo necessário para iniciação da apoptose é bem variável. A maior parte das células em resposta a agentes indutores, experimenta um período de latência, cuja duração é indeterminada a priori, resultando usualmente a morte de mais de 80% da população celular em intervalo de tempo compreendido entre 1 e 3 dias (KESSEL; LUO, 1998, 1999). Godar, 1999 citou em seus trabalhos três termos referentes a apoptose: imediata, intermediária e tardia, junto, aos diferentes mecanismos cinéticos pré-MCP (morte celular programada). A apoptose imediata é provocada em menos de meia hora e é um mecanismo pré- MCP (morte celular programada), isto é, não requer síntese de proteínas pós-excitadas, por exemplo após TFD (GODAR, 1996). As radiações UVA e TFD primeiramente mediado pela produção de oxigênio singleto provocam apoptose imediata pré-MCP, pela despolarização do potencial transmembrana mitocondrial. Um megaporo se abre no local “S” (sulfidrila sensível) liberando AIF (fator indutor de apoptose) a menos que a CsA (Ciclosporina A) esteja presente. A apoptose imediata também pode ser ativada no local “P” (pirimidina nucleotídeo sensível) por altos níveis de ânions superóxidos (e.g. 1mM vitamina K3), porém este mecanismo envolve a liberação de citocromo c, porque não é inibido pela CsA. Em nosso trabalho constatou-se morte celular em 30 minutos após a TFD, onde foi possível observar em microscopia de fluorescência a cromatina nuclear desorganizada (figuras 7.7B, 7.8A). O aspecto morfológico ultraestrutural reforça este resultado uma vez que observou-se a cromatina condensada na periferia do núcleo, um afastamento da membrana nuclear em relação ao citoplasma, indicando perda da adesão desta membrana e início de invaginação da membrana nuclear sugerindo provável formação futura de corpos apoptóticos (figuras 7.11A/B e 7.12A/B). É notado, no entanto, que de acordo com GODAR, 1999, o tratamento de células Hep-2 com ZnPc obedecendo os parâmetros aplicados a TFD resultou em morte celular por “apoptose imediata”. Luo et al, (1996) sugerem que fotossensibilizadores que dividem para loci da membrana e fazem a mediação da fotodestruição da membrana, podem evocar uma resposta necrótica ao invés de uma resposta apoptótica. Já os sensibilizadores que se localizam em mitocôndrias como Fotofrin, mais provavelmente induzem à apoptose durante exposição à luz. Kessel; Luo (1999) constataram que a perda imediata do potencial de membrana é interpretado como um reflexo direto da conseqüência do fotodano mitocondrial. Estes resultados são consistentes com os relatos que implicam a mitocôndria como uma fonte de fatores os quais iniciam resposta apoptótica. Grebenova, et al. (2003) em estudos com ALA em linhagem promielocítica de leucemia humana (HL60) observaram alteração no potencial de membrana paralelo ao aumento dos níveis de ATP, e liberação do citocromo c, sugerindo ativação da apoptose via mitocôndria. Entretanto concluem que o tratamento inicia vários processos que levam rápida ativação de apoptose seguida de uma lenta necrose. A maioria dos corantes estudados em tratamentos clínicos e pré-clínicos de TFD é localizado ou tem maior influência sob as mitocôndrias. A mitocôndria tem surgido como a organela central promotora na maioria das vias apoptóticas. Os sinais dos receptores da morte na superfície celular ou dos locais danificados, convergem para mitocôndria, levando a permeabilização de ambas as membranas mitocondriais, dissipação do potencial elétrico da membrana interna mitocondrial, e liberação de proteínas associadas a apoptose, tais como citicromo c, fatores indutores de apoptose (FIA), ativador secundário de caspases derivado da mitocôndria (SMAC), e certas prócaspases do espaço intermembranas (OLEINICK, 2002). Embora estas mudanças nas mitocôndrias impliquem na maioria dos caminhos apoptóticos sua ordem permanece em disputa (KROEMER; REED, 2000, REED 2000, COSTANTINI et al., 2000). Estudos recentes sugerem que a liberação de fatores mitocondriais associados a apoptose e colapso do potencial transmembrana mitocondrial resultem na formação de canal conhecido como Complexo de Poro de Transição de Permeabilidade (PTPC), o qual permite com a passagem de componentes das membranas mitocondriais interna e externa para citosol (COSTANTINI et al., 2000, GOTTLIEB, 2000). Rodal et al., 1998 trabalhando com as células NHIK 3025 de carcinoma de cérvix humano incubadas com ZnPc, relatou uma redução de 60% na atividade enzimática de UPD galactosil tranferase associada com complexo de Golgi. Enquanto a atividade mitocondrial analisada através do citocromo c oxidase (marcador de enzima para a mitocôndria) apresentou uma redução de 40%. O retículo endoplasmático apresentou uma perda insignificante na atividade enzimática após tratamento com a ZnPc indicando menor localização deste fotossensibilizador no retículo. Estes resultados, medidos por microscopia de fluorescência, indicaram que a ZnPc se localiza principalmente no complexo de Golgi e mitocôndria nas células NHIK 3025 e que estas organelas são alvos importantes para a TFD. Valduga et al., 1998, sugeriram a mitocôndria e membrana plasmática como sendo os principais alvos para o tratamento TFD com a ZnPc em acordo com o trabalho de Rodal et al.,1998. Em análise ultraestrutural foi constatado danos na mitocôndria e membrana citoplasmática de células tumorais in vivo após tratamento com ZnPc e luz (MILANESI et al., 1990). Kessel; Luo, (1999), estudaram uma série de fotossensibilizadores em células de leucemia (L1210) e em outras células demonstrando que os fotossensibilizadores que se ligam à mitocôndria após a TFD induzem morte celular por apoptose, enquanto aqueles que se ligam à lisossomo ou membrana plasmática resultam em morte por mecanismos não apoptóticos. Este fato contribui como uma evidência em nossos resultados, os quais também apontam para morte celular por apoptose uma vez que observou-se potencial de atividade mitocondrial atenuado após a TFD. A emissão de fluorescência do marcador JC-1 pesquisada em nossos trabalhos, pode ser utilizada para uma medida sensível do potencial de membrana mitocondrial, esta nos confirmou uma atividade mitocondrial comprometida tendo uma diminuição do potencial de membrana, indicada pela baixa fluorescência após a TFD (figura 7.3B). Estes resultados corroboram também com as conclusões de Rodal et al. (1998), que relataram a queda de 40% da atividade mitocondrial (citado acima) após tratamento de células NHIK 3025 de carcinoma de cérvix humano incubadas com ZnPc. In vivo células em apoptose são reorganizadas e engolfadas pelos fagócitos, prevenindo assim a resposta inflamatória que é permitida pela necrose, entretanto in vitro a ruptura da membrana plasmática ocorre na apoptose somente nos estágios tardios desta (EDWARDS et al., 1999). 9. CONCLUSÃO _________________________________________________________________________________ Ø As células neoplásicas Hep-2 submetidas a TFD, mostraram-se fotodanificadas ultraestruturalmente, com alterações no núcleo e membrana nuclear gerando morte celular. Ø A Terapia Fotodinâmica utilizando 9µM do fotossensibilizante zinco ftalocianina (ZnPc), irradiada com luz de comprimento de onda 670 nm e dose de energia de 4,5 J/cm2, causou danos celulares irreversíveis. Ø A mitocôndria e o núcleo foram alterados morfologicamente pelo tratamento com ZnPc e luz. Ø A Zinco Ftalocianina aplicada a TFD sobre as células Hep-2 induziu a “Morte Celular por Apoptose Imediata”, visto que se observou a alterações em 30 minutos após o tratamento. 10. BIBLIOGRAFIA ________________________________________________________________ ______ ALBERTS, B., et al. Biologia Molecular da célula. 3 ed. Porto Alegre: Artmed, 1997. 552/1294. ARONOFF, B.L. Lasers: reflections on their evolution. J. Surg. Oncol..v. 64 p. 8492. 1997. ASHKENAZI, A.; DIXIT, M. Death receptors: signaling and modulation. Science.v.281, p.1305-1308. 1998. BELMONT, M. J. et al. Effect of photodynamic therapy on the critical primary ischemia time of fasciocutaneous flaps. Laryngoscope. v. 109. p. 886-990. 1999. BEN HUR, E., et al. The phthalocyanines: a new class of mammalian cells photosensitizers with a potential for cancer phototherapy. Int. of Radiat. Biol., v. 47, p. 145-147. 1985. BEN-HUR, E. Basic photobioly and mechanism of action of phthalocyanines. In HENDERSON, B.W.; DOUGHERT, T. J., ed. Photodynamic therapy. Marcel Dekker, New York. 1992. p. 63-77 BERG, K.; MOAN, J. Lysosomes and microtubules as targets for photochemotherapy of cancer. Photochem. Photobiol. v. 65 p. 403-409. 1997. BIOLO, R., et al. Photodynamic therapy of B16 pigmented melanoma with liposome-delivered Si(IV)-naphthalocyanine. Photochem. Photobiol. v.59, p. 362365, 1994. BIOTEMAS Disponível Acesso em 24 fev. de 2003. em http://intermega.com.br/biotemas/glossario1.htm. BORISSEVITCH, I. fototoxicidade. In E. : Fotoquimioterapia: ENCONTRO FOTOATIVAS E SUAS APLICAÇÕES mecanismos NACIONAL EM alternativos da MOLÉCULAS EM TERAPIA FOTODINÂMICA, 1., 2002, São Pedro SP: Anais... São Pedro 2002, p.33-34. BORTOLETO, R. Efeito da radiação laser de baixa potência no potencial de membrana de mitocôndrias em células "in vitro". 2000. 35f. Dissertação (Mestrado em Engenharia Biomédica) – Instituto de Pesquisa e Desenvolvimento, Universidade do Vale do Paraíba CARNEVALLI, C. M. M. Efeito da radiação laser do (ë830 nm) em cultura de célula fibroblastos CHO-K1. 2001. 37f. Dissertação (Mestrado em Engenharia Biomédica) - Instituto de Pesquisa e Desenvolvimento, Universidade do Paraíba. CHARLESWORTH, P. ; TRUSCOTT, T. G. The use of 5-aminolaevulinic acid (ALA) in photodynamic therapy (PDT). Photochem. Photobiol. v. 18, p. 99-100. 1993. COSTANTINI, P., et al. Mitochondria as a novel target of anticancer chemotherapy. J. Natl. Cancer Inst., v.92 p.1042-1053. 2000. COTTER, T. G., et al. Microfilament-disrupting agents prevent the formation of apoptotic bodies in tumour of cells undergoing apoptosis. Cancer Res. v. 52 p. 997-1000. 1992. DAHLE, J.; STEEN, H. B.; AND MOAN, J. The mode of cell death induced by photodynamic depends on cell density. Photochemistry and Photobiology, v. 70, n..3, p. 363-367. 1999. DECAUDIN, D., et al. Mitochondria in chemotherapy-induced apoptosis: a prospective novel target of cancer therapy. Int. J. Oncol. v.12, p. 141-152. 1998. DELLINGER, M. Apoptosis or necrosis following photofrin photosensitization: influence of the protocol. Photochem. Photobiol. v. 64 p. 182-187. 1996. DOUGHERTY, T. J., et al. Photodynamic therapy. J. Natl. Cancer Inst. v. 90. p. 889-905. 1998. DOUGHERTY, T., & POTTER, W.Of what value is a highly absorbing photosensitizer in PDT? J. Photochem. Photobiol. B: Biology. v. 8. p. 223-225. 1991. EDWARDS, A.M., et al. Apoptosis indution in Nonirradiated human HL-60 and murine NSO/2 tumor cells by photoproducts of indole-3-acetic and riboflavin. Photochem. Photobiol. v. 70, n.4, p. 645-649. 1999. EINSTEIN, A. Zur Quantentheriorie der Strablung. Physiol. Z. v. 18 p. 121-128. 1917. ELLERBY, H. M. Establishment of a cell-free system of neuronal apoptosis: comparison of premitochondrial, mitochondrial, and postmitochondrial phases. J Neurosci. v. 17, n.16, p. 6165-6178 1997. FRACKOWIAK, D., et al. Yeld of intrsystem (singlet-triplet) crossing in phthalocianynes evaluted on the basis of a time in resolved phothermal method. J. Photochem Photobio B: Biol. v. 141 p. 101-108. 2001. GODAR D. E. Singlet oxygen-triggered immediate preprogrammed apoptosis. Meth Enzymol, 1999b.[pré print] GODAR D. E.; MILLER, S. A.; THOMAS, D. P. Immediate and delayed apoptosis cell death mechanism: UVA versus UVB and UVC radiation. Cell Death Different. v. 1. p. 59-66. 1994. GODAR, D. E., Light and death: Photons and apoptosis. The Journal of Investigative Dermatology Symposium Proceedings. v.4 p.17-23. 1999. GODAR, D. E., Preprogrammed and programmed cell death mechanism of apoptosis: UV-induced immediate and delayed apoptosis. Photochem. and Photobiol. v. 63. p. 825-830. 1996. GODAR, D. E.. UVA1 radiation triggers two different final apoptotic pathways. J Invest Dermatol. v.112. p. 101-111. 1999a GODAR, D. E.; LUCAS A. D. Spectral dependence of UV-induced immediate and delayed apoptosis: the role of membrane and DNA damage. Photochem. and Photobiol. v. 62 p. 108-113. 1995. GORDON J. P., et al. New type of amplifier, frequency standard and spectrometer. Physiol. Rer. v.99, p. 1264-1274. 1955 GORMAN, A.; McGOWAN, A.; COTTER, T. G. Role of peroxide and superoxide anion during tumour cell apoptosis. FEBS Lett. v. 404, p. 27-33. 1997. GOTTLIEB, R. A. Mitochondria: execution central. FEBS Lett. v.482 ,p.6-12. 2000. GREBENOVA, D., et al. Mitochondrial and endoplasmatic reticulum stress induced apoptotic pathways are activated by 5-aminolevulinic acid-based photodynamic therapy HL60 leukemia cells. J. Photochem. Photobiol. B: Biol. v.69 , n.2, p. 7185. 2003. GROSS, E., EHREMBERG, B. and JOHNSON, F. M. Singlet oxigen generation by prophyrins and the kinetics of 9,10-dimethylanthracene photosensitization in liposomes. Photochem. Photobiol. v.57. p. 808-813. 1993. HE, X. Y., et al. Photodynamic therapy with photofrin II induces programmed cell death in carcinoma cell lines Photochem. Photobiol. v. 59. p. 468-473. 1994. HENDERSON, B. and DOUGHERTY, T.J. How does photodynamic therapy work? Photochem. Photobiol. v.55, n.1, p.145-157. 1992. HETCH, J., The laser Guidebook. 2.ed. New York:. McGraw-Hill, 1992.. cap. 24, p. 297-303. HSIEH, Y. J., et al. Subcelular localization Photopfrin determines death phenotype of epidermoid carcinom A431 cells triggered by photodynamic therapy: when plasma membranes are the main targets. J. Cell Physiol. v. 194, n.3, p. 363-375. 2003. JACQUES, S. L., Laser - Tissue interactions - Photochemical, photothermal and photomechanical mechanisms. Surgical Clinics of North America, v. 72. p. 531558. 1992. JAVAN, A., BENNETT, W. R., HERRIOTT, D. R. Population inversion and continuos optical MASER oscillation in a gas discharge containing a Ne-He mixture (letter). Physiol. Rer. v. 6, p.106-110. 1961. JONES C. A., et al. Mutagenesis and cytotoxicity in human epithelial cells by farand near- ultraviolet radiations: action spectra. Radiat Res. v. 110 ,p. 244-245. 1987. JORDAN, M. A, et al. Mitotic block induced in Hela cells by low concentration of paclixatel (Taxol) results in abnormal mitotic exit and apoptotic cell death. Cancer Res. v. 56 p. 816-825. 1996. JORI, G. and FABRIS, C. Relatives contribuitions of apoptosis and random necrosis in tumour response to photodynamic therapy: effect of the chemical structure of Zn(II)-phthalocyanines. J. Photochem. Photobiol. B: Biol. v.43 ,p.181-185. 1998. JORI, G. Tumour photosensitizers: approaches to enhance the selectivity and efficiency of photodynamic therapy. J. Photochem. Photobiol. B: Biol. v.38. p. 87-93. 1996. JUARRANZ, A., et al. Photodamage induced by Zinc(II)-phthalocyanine to microtubules, actin, α-actinin and keratin of HeLa cells. Photochem. Photobiol. v.73 n.3, p. 83-289. 2001. KARU T., PYATIBRAT, T.P; KALENDO, G. Irradiation with He-Ne laser increases ATP level in cells cultivated in vitro. J. Photochem. Photobiol. B: Biol l. v. 27, p. 219-223. 1995. KARU, T. I. Primary and secundary mecanisms of ativation of visible to near-IR radiation on cells. J. Phtochem Photobiol. B: Biol. v. 49 ,p. 1-17. 1999. KESSEL, D.; LUO, Y. Photodynamic therapy: A mitochondria inducer of apoptosis. Cell Death and Differentiation. v. 6, p. 28-35. 1999. KESSEL, D.; LUO, Y. Mitochondrial photodamage and PDT-induced apoptois. J. Photochem. Photobiol. v. 42, p. 89-95. 1998. KILANKZYK, E., et al. Effect of the red laser ligth on Na +, K+-ATPase a ctivity in Human Erytocyte membranes sensitized with Zn-Phthalocyanine. J. of Clinical Laser Medicine & Surgery. v.. 20, n.2. p. 71-75 2002. KLUCK, R. M., et al. Cytochrome c activation of CPP32-like proteolysis plays a critical role in a Xenopus cell-free apoptosis system. EMBO J. v.16, p. 4639-4649. 1997b. KLUCK, R. M., et al. The release of cytochrome c from mitochondria: a primary regulation of apoptosis. Science v.. 275, p. 1132-1136. 1997a. KROEMER, G., REED, J. C.Mitochondrial control of cell death. Nat. Med. v.6, p. 513-519. 2000. LEIST, M., et al. Intracellular adenosine triphosphate (ATP) concentration: a switch in the decision between apoptosis and necrosis. J Exp Med. v.185, p. 1481-1486. 1997. LEY, R. D.; APPLEGATE, L. D.; Ultraviolet radiation-induced histopathological changes in the skin of the marsupial Monodelphis domestica. II. Quantitative studies of the photoreactivation of induced hyperplasia and sunburn cell formation. J Invest Dermato. v.85, p. 365-367. 1985 LI, H., et al. Cleavage of BID by caspase 8 mediates 8 the mitochondrial damage in the Fas pathways of apoptosis. Cell. v. 94, p. 491-501. 1998. LIANG, H., et al. Subcellular phototoxicity of 5-aminolaevulinic acid (ALA) Lasers in Surgery and Medicine. v.. 22, p. 14-24. 1998. LIPSON, R. L., BALDES, E. J. The photodynamic properties of a particular hematoporphyrin derivative. Arch. Dermatol. v.82 , p. 76-84. 1960. LIU, X., et al. Induction of apoptosis program in cell-free extracts: requirement for dATP and cytochome c. Cell. v.86, p. 147-157, 1996. LOBNER, D. Comparision of the LDH and MTT assays for quantifyng cell death: validity for neuronal apóptosis? J. of Neuroscience Methods. v. 96 , p. 147-152, 2000. LUBART, R., et al. Effets of visible and near-infrared lasers on cell culture. J. Photochem. Photobiol. B: Biol l. v. 12, p.305-310, 1992 LUO, Y. and KESSEL, D. Inicition of apoptosis vs. necrosis by photodynamic therapy with cloroaluminum phthalocyanine. Photochem. Photobiol. v. 66, p. 479483, 1997. LUO, Y., CHANG C. K., KESSEL, D. Rapid initiation on apoptosis by photodynamic therapy. Photochem. Photobiol. v. 63 , p. 528-534, 1996. MARKS, D. I., FOX, R. M. Mechanisms of photochemotherapy-induced apoptotic cell death in lymphoid cells. Cell Biol. v. 69, p. 754-760, 1991. MARTIN, S. J. ; COTTER, T. G. Disruption of microtubules induces an endogenous suicide pathway in human leukaemia HL-60 cells. Cell Tissue Kinet. v. 23, p. 545-559, 1990. MARTINEZ, G. R., et al. Efeito Citotóxico de porfirinas supramoleculares fotossensibilizadas. In : ENCONTRO FOTOATIVAS E SUAS APLICAÇÕES NACIONAL EM MOLÉCULAS EM TERAPIA FOTODINÂMICA, 1., 2002, São Pedro SP: Anais... São Pedro 2002, p.33-34. MARTINKOVICS, A. T. Ação da cloroalumínio ftalocianina lipossomal no processo de morte celular após a terapia fotodinâmica. 2002. 44f. Trabalho de Graduação (Graduação em Ciência Biológicas) - Faculdade de Educação, Universidade do Vale do Paraíba MICROSCOPIA. Disponível em <http://www.google.com.br/search?q=cache:h3 owvWqdQM4C: www.uol.com.br/cienciahoje/chmais/pass/ch170/primeira.pdf+ microscopia+fluorescencia&hl=pt&lr=lang_pt&ie=UTF-8>: 2003 Acesso em: 02 mar. MIKVY, P., et al. Sensitization and photodynamic therapy (PDT) of gastrointestinal tumors with 5-aminolaevulinic acid (ALA) induced protoporphyrin IX (PPIX). A pilot study. Neoplasma. v. 42 p. 109-113, 1995. MILANESI, C., et al. Zn(II)-phthalocyanine as a photodynamic agent for tumor. II Studies on the mechanism of photosensitized tumor necrosis. Br. J. Cancer. v. 61, p. 846-850, 1990. MOAN, J. and BERG, K. The photodegration of porphyrins in cells can be used to estimate the lifetime of oxygen. . Photochem. Photobiol . v. 53, p. 549-553, 1991. MOAN, J., et al. Fluorescence and photodynamic effects of phthalocyanines and porphhyrins in cells. In: HENDERSON, B.W.; DOUGHERT, T. J., ed. Photodynamic therapy. Marcel Dekker, New York. 1992. p. 19-36. MOLECULAR PROBE. Disponível em: www.probes.com/media/pis/mpo1306. Acesso em: 16 abr.2003. OLEINICK, N. L., et al. Signal transduction and metabolic changes during tumor apoptosis following phthalocyanine-sensitized photodynamic therapy. Proc. SPIE. v. 181, p. 252-261, 1993. OLEINIKC, N. L., The role the apoptosis in response to photodynamic therapy what, where, why and how. Photochem. Photobiol. Sci., v.1, p.1-21, 2002. OLIVE, P. L.; DURAND, R. E. Apoptosis: an indicator of radiosensitivity in vitro? Int J Radiat Biol. v. 71, p. 695-707, 1997. PAZOS, M. C. Análise ultraestrutural de células submetidas a tratamentos com fotossensibilizadores e radiação laser. 2001. 75f. Dissertação (Mestrado em Engenharia Biomédica) - Instituto de Pesquisa e Desenvolvimento, Universidade do Vale do Paraíba. PEACK, J. G.; PEACK, M. J. Comparison of initial yields of DNA-to-protein crosslinks and single-strand breaks induced in cultured human cells by far- and near-ultraviolet light, blue light and X-rays. Mutat Res. v. 246, p. 178-191, 1991. PENG, Q., et al. Subcellular localization, redistribution and photobleaching of sulfonated aluminum phthalocyanines in a human melanoma cell line. Int J Cancer. v. 49, n.2, p. 290-295. 1991 REDDI, E., et al. Lipossome - or LDL - administred zinc(II)-phthalocyanine as a phptodynamic agent for tumours. I Pharmacokinetic properties and phototherapeutic efficiency. Br. J. Cancer, v. 61 ,p. 407-411, 1990. REDDI, E., et al. Pharmacokinetic studies with zinc(II) - phthalocyanine in tumor bearing mice. Br. J. Cancer. v. 56, p. 597-600, 1987. REED, J. C. Mechanismsof apoptosis. Am. J. Pathol. v. 157, p. 1415-1430, 2000. REERS, M., SMITH, T.W., CHEN, L. B. J-aggregate formation of a carbocyanine as a quantitative fluorescent indicator of membrane potencial. Biochemestry. v. 30, p. 4480-4486, 1991. REIS, E. R., et al. Avaliação do efeito Fotodinâmico Através do Monitoramento da fluorescência da protoporfirina IX de glândula harderiana submetidas ao laser de Helio Neônio. In TERAPIA FOTODINÂMICA: COMPLEXOS DE MOLÉCULAS FOTOATIVAS E SUAS APLICAÇÕES. ASPECTOS FÍSICOS, QUÍMICOS BIOLÓGICOS E MÉDICOS. 2002 São Pedro, SP Anais ... 2002. P.6768. RICCHELLI, F., et al. Liposomes as models to study the distribution of porphyrins in cell membranes. Biophys. Acta. v. 1065 ,p. 42-48, 1991. RICHTHER, A. M., et al. In vitro evaluation the phototoxic propertis of fuor structurally related benzophorphyrin derivatives. Photochem. Photobiol. v.52, p. 495-500, 1990. RIGAU, J. Acción de la luz láser a baja intensidad en la modulación de la función celular. 1996. Tese (Doutorado em Histologia). Faculdade de Medicina i Ciência de la Salut. Univ. Rovira i Virgili. RODAL, G. H., et al. Lipossome-bound Zn(II)-phthalocyanine. Mechanisms for cellular uptake and photosensitization. J. Photochem. Photobiol. B: Biol. v. 45, p.150-159, 1998. ROSENTHAL, I. Phthalocyanines as photodynamic sensitizers Photochem Photobiol. v. 53859-870l, 1991. RÜCK, A., et al. Dynamic fluorescence changes during photodynamic therapy in vivo and in vitro of hidrophilic AL (III) phthalocyanine tetrasulphonate and liphofilic Zn (II) phthalocyanine administered in lyposomes. J. Photochem. Photobiol. B: Biol. v. 36, p. 127-133, 1996. SCHEMPP, M. C., et. al. Hipericin photo-induced apoptosis involves the tumor necrosis factor-related apoptosis-indicing ligand (TRAIL) and activation of caspase8. FEBS Letter. v.495 ,p. 26-30, 2001. SCHIEWECK, K, et al. CPG 55847, lipossome-delivered zinc(II)-phthalocyanine as a phototherapeutic agennt for tumours, SPIE Proc. v. 2078 , p. 107-118, 1993. SCHNECKENBURGER, H.,et al. Time-resolved in-vivo fluorescence of photosensitizing porphyrins J. Photochem. Photobiol. B. v. 21, p.143-147,.1993 SCHWARZ, A., et al. Ultraviolet-B-induced apoptosis of keratinocytes: evidence for partial involvement of tumor necrosis factor-alpha in the formation of sunburn cells. J Invest Dermatol. v. 104, n.6, p. 922-927. 1995. SHEIKH, M. S., et al. Ultraviolet-irradiation-induced apoptosis is mediated via ligand independent activation of tumor necrosis factor eceptor1. Oncogene. v. 19, p. 2555-2563. 1998. SIBATA H., et al. Photodynamic therapy: a new concept in medical treatment. Brazilian, J. Med. Biolo. Research. v. 33, p. 869-880, 2000. SPIKES, J. D. Photochemotherapy: molecular and processes involved. SPIE Advances in Photochemotherapy. v. 997, p. 92-100. 1998. STENNICKE H. R.; JURGENSMEIER, M. J.; SHIN, H. Pro-caspase-3 is a major physiologic target of cspase-8. J Biol Chem. v. 273 ,p. 27084-27090, 1998. STRAUSS, W. S., et al. Intracellular fluorescence behaviour of meso-tetraa-(4 sulphonatophenil) porphirin during photodynamic treatment at various growth phases of cultured cells. J Photochem. Photobiol. B. v. 28 ,p. 55-161, 1995. SUSIN, S. A., et al. The central executioner of apoptosis: multiple connections between protease activation and mitochondria in Fas/APO-1/DC95- and ceramideinduced apoptosis. J. Exp. Med. v. 186, p. 25-37. 1997. TAKEMURA, T., et al. I Mechanism of photodynamic therapy: Investigation of Sensitizer Dose and Light Dose-rate Effects. SPIE Proceedings. v. 371, p. 351-354. 1995. TEITEN, MH., et al. Endoplasmic reticulum and Golgi apparatus are the preferential sites of Foscan localisation in cultured tumour cells. Br J Cancer. v. 88 (1) p. 14652. 2003. USUDA, J., et al. Domain-dependent photodamage to Bcl-12 A membranaanchorage region is needed to from the target of phthalocyanine photosentization. J. Biol. Chem. v. 278, n.3, p. 2021-2029. 2003. VALDUGA, C., et al. The production of singlet molecular oxygen by zinc(IIphthalocyanine in ethanol and unilamellar vesicles. Chemical quenching and phosphorescence studies. Photochem. Photobiol.. v. 48 ,p.1-5. 1988. VALDUGA, G., et al. Photosensitization of cells with different metastatic potential by lipossome-delivered Zn(II)-phthalocynanine. Inst. J. Cancer. v. 75 , p. 412-417. 1998. VERHAEGEN, S. Microscopical study of cells death via apoptosis. Eur. Microsc. Anal. v. 51, p. 31-33. 1998. VILLANUEVA, A., et al. Photokilling mechanisms induced by Zn(II)- phthalocyanine on cultured cells. Olcol. Res. v. 11, p. 447-453. 1999. VISONA, A., et al. Local photodynamic therapy with Zn(II)-phthalocyanine in na experimental model of intimal hyperplasia. J. Photochem. Photobiol. B: Biol l. v 57, p. 94-101. 2000. VOWELS, B. R.; YOO, E. K.; GASPARRO, F.P. Kinetic analysis of apoptosis induction in human cell lines by UVA and 8-MOP. Photochem. Photobiol. v. 63, p. 572-576. 1996. WANG, B., et al. Induction of apoptosis in cultured midbrain cells from embryonic mice. Radiat Res. v. 147, p. 304-308. 1997. WOOD, R. S., et al. The subcelular localization of Zn(II)phthalocyanine and their redistribution on exposure to light. Photochem. Photobiol. v. 65, n.3, p. 397-402. 1997. WRÓBEL, D., et al.,Photovaltaic effects in substituted metal-free and metalic sulfophthalocyanines in the photoelectrochemical cell. J. of Melecular Structure. v. 595 , p. 127-138. 2001. YANG, J., et al. Prevention of apoptosis by Bcl-2: release of cytochrome c from mitochondria blocked. Science. v. 275, p. 1129-1132. 1997. YOO, E. K., et al. Apoptosis induction by ultraviolet light A and photochemotherapy in cutaneous T-cell lymphoma: relevance to mechanism of therapeutic action. J Invest Dermatol. v. 107, p. 235-242. 1996. YU, W., et al. Photomodulation of oxidase metabolism and electron chain enzimes in rat liver miochondria. Photochem Photobiol. v. 66, n.6, p. 866-871. 1997. ZHOU, C., et al. Apoptosis of mouse MS-2 fibrosarcoma cells induced by Zn-(II)phthalocyanine. J. Photochem. Photobiol. B: Bio l. v.33 ,p. 219-223. 1996.
Download