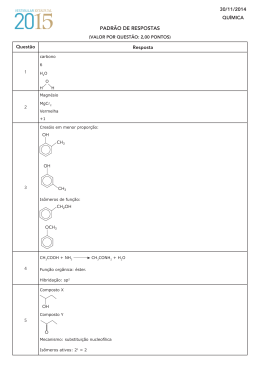
10/12/2006 Química PADRÃO DE RESPOSTAS (VALOR DE CADA QUESTÃO = 2 PONTOS) Questão Resposta 4,14% de 100g 4,14g de Pb 207g ----- 1 mol 4,14g ----- x x = 4,14/207= 0,02 2,0 102 mol número de átomos 2,0 102 6,0 1023 = 12,0 1021 = 1,2 1022 átomos 1 Decaimento: 210 Pb 206 Pb 82 82 2 210 2104 206 206 80206 82Pb 822 X 80 X 2 Pb 82Pb Partículas alfa 1 Partículas beta 2 Enxofre. 2 O elemento deve possuir 6 elétrons em sua camada de valência, já que há uma descontinuidade entre a 6ª e a 7ª energia de ionização, indicando uma mudança de camada. Grupo 17 (VII A). C4H4O4 3 Estereoisômeros 2 Amida. 4 Condensação. Como a amostra I é constituída por dois metais, os elétrons são livres para movimentar-se, advindo daí a alta condutividade no estado sólido. 5 amostra II AC3 amostra III MgC2 6 pOH log[OH] pOH log(2 5,00 102) pOH 1 pH 14 1 = 13 O volume diminui no frasco A e aumenta no frasco B. 10/12/2006 Química n.º de mols de elétrons n.º de mols de Fe 7 1,00 A 9650s 0,10 mols de elétrons 96500C/mol 2,80 g 0,05 mols de Fe 56,0 g n.º de mols de elétrons 0,10 = = 2,00 mols de elétrons por mol de Fe n.º de mols de Fe 0,05 Cloreto de ferro: FeCl2 anodo: 2 Cl(aq) Cl2(g) 2e CH3 CH CH3 CH3 C CH3 OH O 8 A CH3 C O CH CH3 Cl OH B Equação II: CO(g) OH CH3 CH3 C CH3 D OH Cl Equação III: H2(g) Aplicando a Lei de Hess: 2C(s) 2H2O(g)CH4(g) CO2(g) H 132 41 Hf (CH4 ) H 91 Hf (CH4 ) 9 CH4(g) 2O2(g) CO2(g) 2H2O(g) H 802kJ Hf(CO2 ) 2Hf(H2O) Hf(CH4 ) 802 393 2( 242) Hf(CH4 ) 802 Hf(CH4 ) 75 kJ mol1 91 75 16 2C(s) 2H2O(g) C H4(g) CO2(g)) Kc = [ NH3 ]2 [ N2 ] [ H2 ]3 [NH3] 10 vmédia t H = 16 kJ 64 104 8,0 102 mol L1 [ NH3 ] 2 t Δ[ NH3 ] 8,0 102 8,0 102 4,0 101 0,4min 2 vmédia 2 0,10 2,0 101 Não há alteração do valor numérico da constante de equilíbrio, já que o efeito do catalisador seria apenas sobre a velocidade do processo, não afetando o equilíbrio.
Baixar