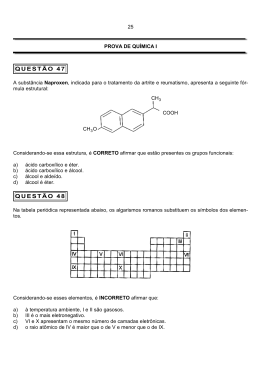
Curso Técnico em Química – Componente Curricular: Físico-Química Profª Cristina L. Ferreira – Avaliação sobre Propriedades Coligativas – Tonoscopia e Ebulioscopia QUESTÕES RESOLVIDAS 1. Considerando uma solução aquosa 0,05 molal de um soluto não eletrolítico e não volátil, calcule o efeito ebulioscópico. (Dado: Ke = 0,52ºC/1000g) ∆Te = Ke x W = 0,52 x 0,05= 0,026ºC 2. Determine o abaixamento relativo da pressão de vapor de uma solução formada por 32g de uréia (massa molar: 60u) em 450g de água. 0,018 x 1000 x 32 ∆P = 0,0213 = P° 60 x 450 3. Os efeitos coligativos aumentam à medida em que aumentam o número de partículas dissolvidas. Dadas as soluções aquosas: I. 2,0M de sacarose: Soluto molecular, logo há 2 mol/L de partículas dissolvidas. II. 0,5M de AlCl3: 0,5M x 4 (4 íons) = 2M. Há 2 mol/L de íons dissolvidos. III. 0,2M de KF: 0,2M x 2 (2 íons) = 0,4M. Há 0,4 mol/L de íons dissolvidos. Em função do número de partículas dissolvidas, a solução que apresenta menor efeito coligativo é a de menor concentração e, portanto, é a solução de KF 0,2M, que se comporta como uma solução 0,4 mol/L, pois dissocia-se em 2 íons. -1 -1 4. Dissolvendo-se 25g de glicose em 600g de água, pede-se (Dado: R = 0,082 atm.L.mol K ) a) o abaixamento relativo da pressão máxima de vapor de água. 0,018 x 1000 x 25 ∆P = 0,0042 = P° 600 x 180 b) o abaixamento absoluto da pressão máxima de vapor de água na solução. (Dado: pressão máxima de vapor na água a 20ºC = 17,535 mmHg) ∆P = 0,0042 ∆P = 0,0042 x 17,535 = 0,0731 mmHg P° 5. Determine o abaixamento relativo da pressão de vapor de uma solução contendo 10g de AlCl3 em 200g de água. (Dado: grau de ionização do sal 95%) i = 1 + α (q – 1) = 1 + 0,95 (4 - 1)= 1 + (0,95 . 3)= 3,85 0,018 x 1000 x 10 x 3,85 ∆P = 0,026 = P° 200 x 133,5 6. Qual o efeito ebulioscópico de uma soluçãode KCl (α% = 96%) que foi preparada pela dissolução de 2g do referido sal em 800g de água. (Dado: Ke = 0,52ºC/1000g) i = 1 + α (q – 1) = 1 + 0,96 (2 - 1)= 1 + 0,96 = 1,96 0,52 x 1000 x 2 x 1,96 ∆Te = = 0,0342ºC 800 x 74,5
Baixar