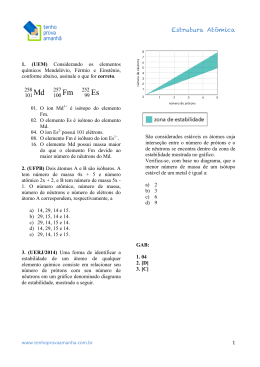
FACULDADES SANTO AGOSTINHO DE SETE LAGOAS CURSO DE ENGENHARIA AMBIENTAL QUÍMICA GERAL 1 – Prof.: Ramon Lamar – LISTA DE EXERCÍCIOS Nome: __________________________________________________________________ 01. Considerando os quatro tipos de sistemas abaixo identificados, classifique os sistemas apresentados na sequência. I – Substância pura simples II – Substância pura composta III – Mistura homogênea IV – Mistura heterogênea ( ( ( ( ) Iogurte ) Barra de chumbo ) Cristal de sal de cozinha (NaCl) ) Água mineral sem gás ( ( ( ( ) Diamante ) Ar atmosférico ) Granito ) Água + gelo ( ( ( ( ) Suco de limão ) Gás oxigênio ) Areia de praia ) Laranjada 02. Quais as características fundamentais de um material no estado gasoso? 03. Como se comportam as temperaturas de fusão e ebulição para A) substâncias puras. B) ligas eutéticas. C) misturas azeotrópicas. 04. Quais dos fenômenos seguintes são classificados como fenômenos químicos: A) dissolução de um comprimido efervescente em água B) adição de sal de cozinha na água C) combustão da gasolina D) enferrujamento de um prego E) funcionamento de uma pilha alcalina F) evaporação da acetona 05. Certo pedaço de metal de massa 38 gramas foi mergulhado em uma proveta contendo 90 cm3 de água destilada, provocando o deslocamento da água que passou a marcar 96,5 cm3. Qual a densidade aproximada do metal? 06. Caracterize as partículas subatômicas (prótons, nêutrons e elétrons) em relação à localização, massa e carga elétrica das mesmas. 07. Forneça o número de prótons, elétrons e nêutrons das seguintes espécies químicas: A) B) C) D) 08. Considerando os elementos seguintes espécies químicas: , e , determine o número de prótons, elétrons e nêutrons das A) B) C) 09. Qual a carga nuclear da espécie ? 10. Nomeie os elementos representados pelos símbolos: B, F, Na, P, S, Ar, K, Ni, Cu, Br, Ag, Au, Hg e Pb. 11. Conceitue isótopos e exemplifique. 12. Certo elemento é encontrado na natureza na forma de dois isótopos. O isótopo 30A corresponde a 80% de uma amostra e o isótopo 32A corresponde a 20% da amostra. Determine a massa atômica de A. 13. Certo elemento é encontrado na natureza na forma de três isótopos. O isótopo 40B corresponde a 50% de uma amostra, o isótopo 41B corresponde a 30% da amostra e o isótopo 42B corresponde a 20% da amostra. Determine a massa atômica de B. 14. Certo elemento E tem massa atômica 68,7. Sabendo-se que na natureza existem os isótopos 68E e 69E, determine o percentual de cada um dos isótopos em uma amostra. 15. No chamado “Experimento de Rutherford”, uma fina folha de ouro foi bombardeada com um feixe de partículas alfa (4α2+). Na época, acreditava-se que os átomos eram maciços e uniformes. Sendo assim, qual seria o resultado esperado após o feixe de partículas alfa atravessarem a folha de ouro? 16. Cite as principais conclusões de Rutherford sobre a estrutura dos átomos. 17. Böhr, em seus experimentos, obteve um espectro descontínuo da luz do gás hidrogênio submetido a uma descarga elétrica. Descreva o espectro obtido por Böhr nesse experimento. 18. Cite as principais conclusões de Böhr sobre a estrutura dos átomos. 19. Quais as principais características do modelo atômico de Rutherford-Böhr? 20. Diferencie órbita e orbital. 21. Descreva de forma simplificada e exemplifique: filtração, decantação, destilação simples, destilação fracionada, cromatografia e eletroforese.
Baixar