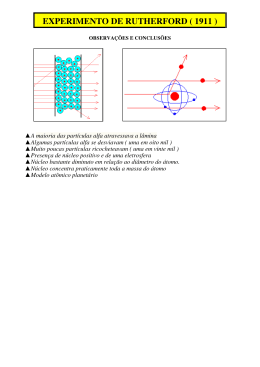
QUÍMICA I AULA 04: ESTRUTURA ELETRÔNICA DOS ÁTOMOS TÓPICO 01: COMPORTAMENTO DOS ÁTOMOS 1.1 O ÁTOMO DE THOMSON Em 1898 J.J. THOMSON propôs um modelo para a estrutura do átomo: O átomo era uma esfera de carga elétrica na qual estavam contidos elétrons de tal modo que o átomo como um todo era NEUTRO. A porção positiva continha a maior parte da massa do átomo. Em 1896 W. Röntgen envolveu o tubo catódico com pedaços de papelão preto. Trabalhando em um ambiente escuro, Röntgen observou que um papel embebido com um composto como sulfeto de zinco, fosforescia. Ele conclui que a fosforescência era devido a radiações desconhecidas que as chamou de RAIOS-X. RAIOS-X são formados quando elétrons de alta energia (raios catódicos) se chocam com um metal ou outro alvo. São radiações eletromagnéticas dotadas de alta frequência. Substâncias radioativas contêm átomos que sofrem desintegração ou decaimento. Existem três tipos de radiação resultantes da desintegração de elementos radioativos naturais: • Partículas - Núcleos de átomos de hélio movendo-se rapidamente. • Partículas - São elétrons movendo-se rapidamente. • Raios - São raios-x de alta energia. O Átomo Nuclear (Clique aqui para abrir) O Átomo Moderno (Clique aqui para abrir) EXEMPLOS EXEMPLO 1 O elemento Urânio possui 92 prótons e 146 nêutrons, seu número de massa é 238. ATENÇÃO: O número de massa A não é uma massa. Ele é um número inteiro representando o número total de núcleos. O átomo pode ser especificado através do símbolo químico do elemento, o numero atômico Z como subscrito e o numero de massa A como sobrescrito. A notação: Indica um átomo do elemento X tendo o número atômico Z e o numero de massa A. EXEMPLO 2 Podemos escrever ou onde cada um é lido como “oxigênio 16”, para representar este átomo específico de oxigênio. EXEMPLO 3 Na natureza o elemento boro ocorre como uma mistura de: • (19,78%) • (80,22%) Através da média ponderada podemos calcular a massa atômica do elemento boro. As massas isotópicas e abundâncias isotópicas relativas são determinadas por meio de uma técnica denominada espectrometria de massa utilizando o aparelho espectrofotômetro de massa. 1.2 ELÉTRONS NO ÁTOMO Com a aceitação do modelo nuclear de Rutherford a comunidade cientifica pôs-se a indagar: “E os elétrons, o que fazem?” Como resposta Rutherford sugeriu que o átomo tinha uma estrutura planetária, com o núcleo correspondendo ao sol em nosso sistema solar e os elétrons aos planetas que se movimentam através de um espaço vazio empregando órbitas fixas. Aplicando este modelo ao átomo de hidrogênio, onde temos um núcleo e distante deste, o seu único elétron. Para esse elétron único existem duas possibilidades do estado de movimento: • O elétron está parado • O elétron está em movimento Caso o elétron esteja estacionário, a atração eletrostática entre cargas opostas (elétron – núcleo) deveria provocar o movimento do elétron na direção do núcleo levando o universo ao colapso. Como o universo não entra em colapso a escolha é rejeitar o modelo do elétron estacionário. A segunda hipótese do modelo planetário com o elétron movimentandose o mais próximo possível ao redor do núcleo com órbitas circulares para que o efeito da força centrifuga evite o arraste do elétron para dentro do núcleo. Este modelo está em desacordo com o principio da física que afirma: “no momento em que uma partícula carregada sofre uma aceleração, elas deve emitir energia radiante”. Sabemos que um objeto seguindo uma órbita circular sofre uma aceleração em direção ao centro do circulo; caso contrário, o elétron seguiria uma linha reta e se perderia no espaço. Assim, concluímos que um elétron planetário em movimento deveria irradiar energia devido a esta aceleração. Tal conclusão não se adequar ao modelo planetário devido: Não ser observado essa radiação. Se o elétron perdesse energia, a sua velocidade era diminuída, e em consequência, o raio de sua órbita diminuiria, levando-o a mover-se em espiral na direção do núcleo. Os dois modelos: (1) elétron estacionário, ou (2) elétron em movimento, são inconsistentes com a observação. Neste ponto foi necessário modificar a física clássica. O primeiro a desenvolver um modelo atômico fora da física clássica foi Niels Bohr. Ele estabeleceu que a elucidação da estrutura atômica estava relacionada com a natureza da luz emitida pelas substancias a temperaturas altas ou sob influencia de uma descarga elétrica. Bohr apontava que luz era produzida quando elétrons nos átomos sofriam alterações de energia. DESAFIO Para realizar um estudo de maneira sólida e interativa, segue abaixo quatro questionamentos. Leia a aula, faça uma reflexão e tente resolver mentalmente os desafios. Clique aqui para abrir. FONTES DAS IMAGENS Responsável: Eduardo H. Silva de Sousa Universidade Federal do Ceará - Instituto UFC Virtual
Download