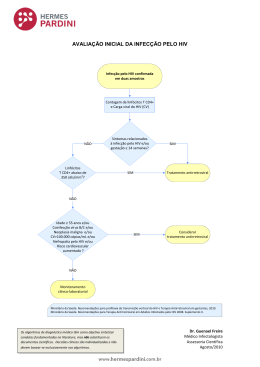
Relatórios de Conferência para o NATAP (Projeto Nacional de Advocacy em Tratamento para a Aids) IAS 2013: 7ª Conferência da IAS sobre o HIV Patogênese, Tratamento e Prevenção 30 de junho a 3 de julho de 2013 Kuala Lumpur, Malásia Simpósio IAS: Rumo à Cura do HIV, 29-30 de junho de 2013, Kuala Lumpur Escrito para o NATAP (Projeto Nacional de Defesa do Tratamento da AIDS) pelo médico David Margolis, UNC Chapel Hill e CARE - Collaboratory of AIDS Researchers for Eradication (Colaboração de Pesquisadores da AIDS para a Erradicação) A Dra. Françoise Barré-Sinoussi adotou o lema “RUMO À CURA DO HIV” para deixar sua marca ao final da gestão como presidente da IAS (International Aids Society). O resultado mais recente dessa iniciativa foi um simpósio pré-conferência, realizado em dois dias, imediatamente antes da 7ª Conferência sobre Patogênese, Tratamento e Prevenção do HIV em Kuala Lumpur, no período de 29 a 30 de junho de 2013. O simpósio serviu como uma plataforma para apresentar a última palavra da ciência básica e das pesquisas clínicas em torno da cura do HIV. Combatendo a infecção persistente do HIV Duas apresentações destacaram avanços potenciais nas tentativas de erradicar a infecção do HIV: uma, sobre a infecção do HIV em um modelo de rato humanizado e a outra em seres humanos. Martin Tolstrup relatou os esforços do grupo da Universidade de Aarhus, Dinamarca, para testar os efeitos da dosagem cíclica repetida do panobinostat, um inibidor de HDAC (histona-deacetilase) em pacientes HIV positivos recebendo TARV. O panobinostat (PAN) é o segundo seletivo e potente inibidor de HDAC testado em pacientes HIV positivos. Atualmente, esse fármaco desenvolvido pela Novartis está em estudo para o tratamento de mieloma múltiplo e leucemia aguda. Assim como no caso do vorinostat (VOR), os alvos do PAN são os HDACs de Classe 1, 2 e 3, supostamente fundamentais para a manutenção da latência do HIV, embora o PAN seja mais potente que o VOR na base molar. Para evitar as baixas contagens de plaquetas observadas quando a droga é utilizada em oncologia, o grupo dinamarquês optou por fornecer 12 doses de 20 mg do PAN, três vezes por semana, a cada duas semanas, totalizando 4 ciclos no período de 8 semanas. Foram estudados quinze pacientes, todos do sexo masculino, com médias de idade de 47 anos, diagnóstico do HIV de 82 meses, TARV durante 43 meses, nadir do CD4 de 350 e CD4 pré-tratamento de 935. Dois pacientes tinham iniciado TARV durante a infecção aguda (duração da infeção não definida). Como o VOR, o PAN foi aparentemente bem tolerado. Somente eventos de Grau I foram relatados; as contagens do CD4 permaneceram estáveis e as contagens de plaquetas tenderam a cair com tempo maior de exposição, mas não chegaram a alcançar os critérios de graduação da toxicidade. O resultado pareceu bastante similar à experiência com VOR. Os inibidores de HDAC aumentam a quantidade de proteínas dentro da célula, a qual é modificada com a adição de um grupo acetila (acetilação). Assim, a acetilação celular total pode ser usada como marcador do efeito biológico para provar que o inibidor de HDAC entrou na célula e realizou seu trabalho. O grupo de pesquisadores deve ser aplaudido pelo estudo cuidadoso da acetilação celular total nas células mononucleares do sangue periférico (PBMC) como biomarcador do efeito PAN dentro das células, como foi realizado com o estudo utilizando doses únicas do vorinostat. Observou-se aumento de 2 a 3 vezes da acetilação da histona H3 no período de duas horas após a dose, geralmente permanecendo nesse patamar duas horas após a dosagem e desaparecendo após 52 horas. Na verdade, o nível de acetilação global intracelular não pareceu voltar aos níveis pré-tratamento antes da nova rodada da dosagem cíclica. Infelizmente, o grupo não tinha ou ainda não podia apresentar os dados coletados sobre a cópia única de HIVRNA plasmático ou HIV-RNA de associação celular. Presume-se que esses dados serão apresentados na próxima reunião. Entretanto, extraordinariamente, o grupo relatou algumas evidências preliminares de que o PAN pode ter desestabilizado a infecção latente do HIV, utilizando um ensaio de amplificação mediada por transcrição (TMA, sigla em inglês). A TMA é uma tecnologia diferente do PCR que detecta DNA ou RNA. Pode ser muito sensível, mas não tão precisa quanto o PCR. Contudo, tratase de uma boa ferramenta para verificar a “presença” ou “ausência” de um alvo, tal como o HIV-RNA. Foi relatado que os ensaios TMA utilizados aqui apresentaram sensibilidade de 50% para a detecção de 3,8 cópias do HIVRNA/mL, e 95% para a detecção de 12 cópias/mL. Durante o estudo, em vários momentos após a administração do PAN, 60% dos participantes apresentaram resultado positivo do TMA para HIV-RNA na corrente sanguínea, em comparação com apenas 28% antes da administração do panobinostat. Apenas um dos quinze participantes não apresentou resultado positivo para o teste do TMA durante o período do estudo. Portanto, se o resultado negativo do TMA é, na sua maioria, para valores menores que 3 cópias e o resultado positivo, na sua maioria, para valores maiores que 3 cópias ou alcançando >12 cópias, estamos nos referindo a quantidades muito pequenas do HIV-RNA e alterações também muito pequenas. Os resultados de uma única cópia do HIV-RNA plasmático ou ensaios de HIV-RNA de associação celular poderiam ajudar a esclarecer os dados. Seria muito interessante verificar se um segundo inibidor de HDAC realmente poderia desestabilizar uma infecção latente do HIV. Na apresentação de um pôster, Wightman et al. (Universidade de Monash & Instituto Burnet, Austrália) sugeriu que um terceiro inibidor de HDAC, o entinostat, também pode ser útil. O entinostat também é seletivo para HDAC de classe 1 e, em um modelo de latência usando células primárias (não uma linha de células), a droga induziu a expressão do vírus latente sem alterações nos marcadores da ativação das células T ou expressão dos correceptores CXCR4 ou CCR5 do HIV. Os autores afirmaram que esse composto é uma opção nova e atraente para futuras experiências clínicas. Em um importante estudo, Victor Garcia, da UNC, demonstrou a capacidade de uma toxina ligada ao anticorpo do envelope do HIV de eliminar células residuais produtoras de HIV em um modelo de ratos humanizados. Mediante a disponibilização integral das informações, o laboratório do autor auxiliou alguns dos ensaios utilizados neste estudo. Em outro estudo complexo liderado por Paul Denton, ratos humanizados BLT (Bone Marrow Liver Thymic) foram infectados com o HIV e tratados com TARV ou deixados sem tratamento. Nesse modelo, um rato imunodeficiente, incapaz de rejeitar células transplantadas, reconstituiu um sistema imunológico humano completo, derivado das células tronco, e um organoide tímico. Nesse sistema, a infecção do HIV, a TARV e a infecção latente durante a TARV já foram validados em diversas publicações do laboratório de Garcia e outros. As amostras enviadas para o laboratório de Angela Kashuba demonstraram que a TARV (raltegravir, tenofovir, FTC) penetrou totalmente todos os tecidos relevantes do rato. Similarmente aos humanos, após várias semanas de TARV, o HIV-RNA não é detectável no plasma, mas as células com HIV-RNA+ ainda estão abundantes nos tecidos (sangue, medula, timo, fígado/baço, pulmões, intestino grosso). Essa situação reproduz a chamada “reserva ativa residual” observada em humanos recebendo TARV, em que raras células expressam o HIV-RNA, embora novas rodadas da infecção e da replicação viral estejam bloqueadas pela TARV. O grupo de Garcia buscou testar a eficácia de uma nova abordagem direcionada a matar as células, para eliminar células infectadas produtivas in vivo, utilizando a imunotoxina 3B3-PE38 direcionada ao envelope do HIV (pelo anticorpo 3B3) que carrega a potente toxina produzida pela bactérias Pseudomonas (PE38). O controle da imunotoxina ou do veículo foi introduzido além da TARV a cada dois dias durante 14 dias em animais. Os animais foram então sacrificados e os níveis do RNA residual nos tecidos foram comparados com ratos infectados pelo HIV não tratados, tratados com TARV e tratados com TARV/imunotoxina. Embora uma abordagem utilizando imunotoxinas em humanos represente um desafio em virtude da vasta diversidade de envelopes virais presentes em um enxame de HIV, nesse modelo os ratos humanizados foram infectados com um único inóculo de vírus clonal, permitindo o direcionamento pelo 3B3. A TARV isolada suprimiu fortemente os níveis do HIV-RNA no plasma e tecidos, mas a expressão do RNA de associação celular nos tecidos persistiu. A imunotoxina reduziu os níveis do RNA medidos pelo PCR em até 3,2 log em tecidos individuais. Esse resultado foi confirmado por hibridização in situ que visualizar de modo direto as moléculas de HIV-RNA dentro de células infectadas. Esse resultado abre caminho para várias experiências importantes no futuro. Demonstra a capacidade de um reagente de eliminar células infectadas persistentes de maneira mensurável em um modelo com animais pequenos tratáveis. Além disso, embora o segundo tipo de infecção persistente – a reserva viral latente e quiescente em contraste com a reserva ativa residual – não tenha sido objeto de estudo nessa experiência, condições foram criadas para o teste de estratégias de indução da latência, seguido de estratégias para eliminar a expressão ativa residual. Os pacientes da Cura de Boston As importantes histórias do paciente de Berlim, seguidas pelo estudo de coorte de Visconti e do bebê de Mississipi nos ensinaram muito, ampliaram a nossa imaginação e criaram esperança com relação às pesquisas direcionadas a estratégias de cura do HIV. Tim Henrich, do Hospital Brigham da Mulher e da Faculdade de Medicina de Harvard, acrescentou um novo capítulo sobre descobertas clínicas com estudos sobre os reservatórios do HIV-1 e outros fenômenos específicos a pacientes HIV positivos que tiveram neoplasias tratadas com o transplante alogênico de células tronco, em Boston. Anteriormente, Henrich havia reportado uma eliminação muito significativa de HIV-DNA em células sanguíneas periféricas em 3 indivíduos após o transplante alogênico em regime de condicionamento de intensidade reduzida (RIC-alloHSCT) de células tronco hematopoiéticas de doadores que tinham genes receptores CCR5 “normais” (tipo selvagem), e cujas células eram susceptíveis à infecção pelo HIV, diferentemente das células transplantadas no caso do paciente de Berlim. Após um período de 4,3 anos do transplante, um paciente estava totalmente transplantado, com detecção apenas das células doadoras e ausência de HIV-DNA em 2 pools de 25 milhões de PBMC testados, com uma redução do HIV-DNA de pelo menos 1.500 vezes em comparação com o nível de DNA antes do transplante. Após um período de 2,6 anos do transplante, o segundo paciente estava totalmente transplantado, com a detecção apenas de células doadoras e ausência de HIV-DNA em um pool de 50 milhões de PBMC testado; nenhum exemplar de HIV foi recuperado após a cultura de 150 milhões de PBMC. Um terceiro paciente morreu de câncer 188 dias após o transplante, com níveis decrescentes de HIV-DNA. Os dois pacientes não apresentaram função imunológica celular específica ao HIV detectável pelo teste ELISpot IFN-gamma no PBMC total envolvendo os painéis de peptídio específicos para o HLA. Contudo, tinham a doença do enxerto contra hospedeiro (GVHD) crônica, isto é, os sistemas imunológicos enxertados dos pacientes apresentavam uma resposta imunológica ativa crônica contra as suas células nativas. Uma interpretação para esses eventos é que o GVHD percebe todas as células do paciente infectado pelo HIV e as mata, resultando na cura como efeito colateral do GVHD crônico. Como já havia sido antecipado desde a última apresentação dessa experiência, Henrich relatou que os dois pacientes concordaram em se submeter a uma interrupção da terapia antirretroviral, sob observação e aprovação do IRB (Conselho de Revisão Institucional da Universidade). Na época da reunião, os dois pacientes ainda não apresentavam HIV-RNA ou HIV-DNA detectável em PBMC, em amostras semanais durante 7 e 14 semanas, respectivamente. Conversando com o Dr. Henrich um mês depois, a situação permanece inalterada. O estudo e acompanhamento continuam. TARV e Cura Diversos estudos destacaram o papel da TARV precoce e/ou intensiva nas estratégias de erradicação ou pelo menos de redução do reservatório viral. O trabalho de Cheret, Rouzioux e outros ilustram o impacto de 12 meses de TARV em HIV-DNA de associação celular em infecções primárias agudas pelo HIV-1 no estudo OPTIPRIM ANRS 147. Noventa pacientes receberam tratamento 35 dias em média após a data estimada da infecção: 43% apresentaram HIV-1 determinado pelo Western-Blot com ≤1 anticorpos; 92% eram do sexo masculino e 96% apresentavam sintomas. Os valores médios pré-tratamento para CD4, HIV-RNA e HIV-DNA eram de 472 células/mm3 [IQR: 368-640], 5,4 cópias log/mL [IQR: 4,9-5,8], e 3,65 cópias log/milhão de PBMC [IQR: 3,35-4,02], respectivamente. Os pacientes foram tratados com raltegravir, maraviroc, darunavir/r, emtricitabina/tenofovir (Braço 1) ou darunavir/r, emtricitabina/tenofovir (Braço 2). Os resultados combinados dos dois braços da experiência aos 12 meses mostraram um aumento na contagem de CD4 de 239 células/μL, o nível de RNA de HIV plasmático < 50 cópias/mL em 91%, e uma grande queda no HIV-DNA no PBMC. Dados comparativos serão analisados aos 24 meses. Em outra apresentação feita por Wolf em Munique, a TARV com 5 drogas combinadas durante a infecção primária pelo HIV levou a uma redução dos níveis de DNA pró-viral maior que o normalmente observado após tratamento de infecções crônicas. Similarmente, a TARV incluiu 2 ITRN + 1IP + maraviroque (MVC) + raltegravir (RAL). Em um estudo de coorte paralelo de pacientes infectados crônicos, a TARV foi intensificada com MVC + RAL. Aos 24 meses, os níveis médios do DNA pró-viral estavam significativamente menores em pacientes com infecção primária pelo HIV-1 (2,1 vs. 2,6 cópias log/106 PBMC, p=0,001). O estudo SPARTAC também demonstrou que os níveis do HIV-1-DNA após a terapia antirretroviral em infecções primárias prevêem a progressão da doença. O nível do reservatório do HIV-1-DNA após 48 semanas de tratamento prevê de maneira significativa a progressão da doença, sendo que os níveis do DNA total do HIV-1 são melhores previsores do que os níveis do DNA integrado do HIV-1. Laurent Hocqueloux relatou os resultados de um estudo da ANRS demonstrando que pacientes cronicamente infectados, que iniciaram a TARV com CD4 acima de 500/mm3, alcançaram uma contagem melhor e mais alta de CD4 e níveis menores de HIV-DNA. 309 pacientes foram incluídos após um período médio de 4 anos de TARV. Os pacientes submetidos à TARV com CD4 < 500 células/μL apresentaram níveis de HIV-DNA significativamente mais baixos (média = 2,50 log). Os benefícios da terapia precoce parecem claros e universais, quando implantados com sucesso. Esses pacientes seriam os principais candidatos para futuros projetos em busca da cura. Medições da Infecção do HIV Sarah Palmer, do Instituto Westmead Millenium para Pesquisas Médicas e Universidade de Sidney, Austrália, relatou uma análise das frequências da infecção pelo HIV e a configuração genética do HIV-1 intracelular em compartimentos de tecidos de pacientes tratados após infecções agudas e crônicas. Utilizando técnicas de sequenciamento de genomas e pró-virais únicos, foram sequenciados os genomas intracelulares do HIV-1 de células T virgens, centrais, transicionais e de memória efetora em sangue periférico, intestino grosso e tecido de nódulo linfático. Após 4 a 12 anos de terapia supressora, foram coletadas amostras de 5 indivíduos que iniciaram a terapia durante uma infecção aguda e 3 que iniciaram a terapia durante a infecção crônica, com intervalos de 6 meses entre cada coleta. Os principais resultados foram: · As frequências da infecção em cada população não mudaram muito com o passar do tempo na maioria dos pacientes; · As frequências da infecção de todos os subconjuntos de células T foram maiores em sujeitos tratados durante a infecção crônica do que durante a infecção aguda, com a memória central carregando a maior parte do HIVDNA. No intestino grosso, as células T efetoras carregavam a maior quantidade de HIV-DNA; · Houve pouca evidência de mudanças sequenciais (evolução) do HIV-DNA no sangue, linfonodos, intestino grosso para as populações de células centrais, efetoras, virgens, de memória e transicionais. · O aumento de sequências clonais do HIV-1 das células T efetoras de memória em dois sujeitos, especialmente um paciente com cepa do HIV com incompetência replicativa, carregando uma grande supressão de protease, indica uma expansão de células com DNA pró-viral integrado ao invés de replicação viral ativa. No geral, esses resultados reforçam a ideia de que uma TARV supressora bem sucedida bloqueia inteiramente a replicação do HIV, conforme definido por um ciclo completo da vida viral, necessário para gerar diversidade genética e evolução. Esses dados evidentes ainda não encerraram o debate entre o grupo (incluindo o autor) que acredita que a TARV já alcançou sua eficácia virológica máxima (ou seja, mais e melhores terapias não curarão a infecção pelo HIV) e os que percebem a “replicação persistente” como parte do problema da infecção persistente pelo HIV. Richard Koup apresentou o trabalho de seu colega Joe Casazza, do Centro de Pesquisas de Vacinas, com um estudo sobre os detalhes das células T CD4 isoladas das células mononucleares do sangue periférico (PBMC) que apresentavam HIV-RNA+, e, portanto, com grande chance de transcrever ativamente o HIV-RNA. Os HIV-RNA se apresentam de duas formas principais: os HIV-RNA emendados que representam os primeiros estágios da expressão viral e os não-emendados, longas fitas de HIV-RNA que representam os estágios finais da replicação viral e que podem resultar na produção de vírions e na expressão de antígenos de HIV na superfície da célula infectada. Utilizando primers de PCR especialmente desenvolvidos, essas duas espécies de RNA podem ser distinguidas, identificando quais as células que estão gerando o HIV, mas que podem estar menos visíveis ao sistema imunológico, e quais células podem estar produzindo vírions e podem ser eliminadas pela resposta imunológica. Os PBMC in vivo negativos para CD8 de 6 indivíduos infectados pelo HIV e não tratados por TARV foram classificados em CD4+ com expressão alta, CD4+ com expressão baixa e CD4+ sem expressão. Essa é uma característica importante, pois se sabe que as células CD4+ podem perder a expressão do CD4 em sua superfície nos estágios produtivos da infecção pelo HIV, devido à ação da proteína viral Nef. Marcadores de superfície da ativação da célula T e a expressão na superfície dos antígenos do HIV foram usados para classificar as células expressando o HIV. A frequência de células T contendo HIV-RNA e a quantidade de HIV-RNA em cada população foram determinados usando a diluição limitante RT qPCR. O número de cópias do HIV-RNA por célula foi determinado utilizando-se valores dos poços nos pontos extremos da diluição que tinham maior probabilidade de conter uma única célula HIV-RNA+. O RNA emendado mensurável foi utilizado como evidência da transcrição ativa do DNA pró-viral. A frequência média de células contendo RNA não emendado na população de CD4 com expressão alta foi de 1:2500, significativamente maior que a frequência de RNA emendado na mesma população (em torno de 1:5000). Na população de CD4 com baixa expressão, ocorreu coexpressão rotineira de RNA emendados e não emendados, com frequência média em torno de 1 em 60 células. O número médio de cópias de RNA emendados e não emendados aumentou com a redução da expressão da superfície da célula T CD4, como esperado. Quando as células expressando marcadores da ativação da célula T foram estudadas, o número de células ativamente transcrevendo o HIV chegou a 1 em 30 (3,3%). Entretanto, considera-se muito difícil a utilização de amplos anticorpos monoclonais específicos neutralizantes para o gene env (envelope) para a identificação direta ex-vivo de células contendo HIV-RNA+. Aparentemente, embora seja possível detectar células contendo HIV-RNA, é muito mais difícil detectar células positivas para o antígeno do HIV utilizando as atuais técnicas de anticorpos. Isso pode representar um desafio para a detecção de células infectadas em pacientes tratados com TARV durante as tentativas de desenvolver estratégias para a eliminação/erradicação do vírus. Una O’Doherty, da Universidade da Pensilvânia, relatou resultados melhores na detecção de células do reservatório positivas para o antígeno Gag do HIV. A pesquisadora tingiu células T CD4+ fenotipicamente em repouso (HLA-DR-, CD25-, CD69-), de indivíduos infectados pelo HIV sendo tratados por TARV, com um anticorpo contra o Gag do HIV, e classificou-as como células Gag+ e Gag-. A seguir, mediu o HIV-DNA nas frações Gag+ e Gag- para determinar se o HIV-DNA foi enriquecido na população Gag+. Níveis mais altos de HIVDNA foram medidos nas células Gag+ em todos os 5 pacientes do estudo preliminar. Calculou-se que as células Gag+ representaram até 2% das células CD4+ em repouso que também eram positivas para o HIV-DNA. Seria importante determinar, se possível, quanto das 98% que eram Gag negativas poderiam se tornar Gag+ sob estimulação, e que proporção dessas células (tanto as Gag+ sem ativação quanto as Gag+ após estimulação) produziram replicação competente do HIV. O’Doherty também apresentou evidências de que as células que são Gag+ podem ser eliminadas por células T citotóxicas específicas para o HIV (CTL). Finalmente, em um sistema utilizando cultura celular, a eficácia do CTL para eliminar células Gag+ in vitro, apresentou forte correlação com a frequência de DNA integrado do HIV em células de pacientes in vivo. Ela concluiu que uma fração do reservatório de células T CD4+ em repouso expressa as proteínas Gag do HIV em pacientes tratados com TARV; tais células podem ser eliminadas por CTL e pacientes com CTL mais eficiente devem ter um reservatório menor. Estudos mecanísticos Diversos e interessantes estudos mecanísticos ilustram potenciais alvos futuros para terapias anti-latência, destacando os mecanismos celulares que podem levar a uma infecção latente e manter reservatórios da infecção dormente do HIV apesar da TARV. Direcionar a pesquisa para tais mecanismos pode forçar o vírus a sair do seu esconderijo. Mathias Lichterfeld, do Hospital Geral de Massachusetts, propôs que a infecção latente pelo HIV-1 era causada pelo fator beta-catenina do hospedeiro em um tipo relativamente novo de célula T CD4 de memória, chamada de célula tronco de memória. Além disso, ele apostou nessa ideia sugerindo que drogas inibidoras de beta-catenina poderiam eliminar tais reservatórios latentes. Células tronco T CD4+ de memória (Tscm) representam uma descoberta recente da subpopulação de células T que aparentam ter longa vida. Considera-se que essas células são mantidas por vias de sinalização celular que envolvem uma cascata de fatores celulares conhecidos como via Wnt/beta-catenina. Trata-se de uma via complexa composta de muitos fatores celulares humanos, dentre os quais um que regula muitos dos genes humanos. A beta-catenina, com seu coativador CBP (a proteína de ligação ao elemento de resposta ao AMP cíclico – proteína de ligação a CREB), junto com outros fatores de transcrição, se liga a regiões do genoma humano que contêm a sequência de DNA conhecida como elemento de resposta Wnt, e ativa a transcrição de diversos genes alvo. A via de sinalização Wnt/beta-catenina regula a morfologia celular, sua mobilidade e proliferação. A regulação anormal dessa via causa proliferação neoplásica (isto é, câncer). O inibidor experimental PRI-724 está sendo usado em estudo para tratar neoplasias supostamente causadas por anormalidades na sinalização Wnt. Esse inibidor bloqueia essa via em células tronco cancerosas e parece ter atividade antineoplásica. Lichterfeld testou a ideia de que esse inibidor poderia desestabilizar a latência do HIV e utilizou ensaios PCR para determinar a quantidade de HIV-1 de associação celular em subconjuntos de células T CD4 classificadas, de pacientes infectados pelo HIV-1 tratados com TARV. O autor encontrou altos níveis de HIV-DNA em Tscm nos pacientes, e a presença de vírus com replicação competente dentro dos subconjuntos de células T CD4, utilizando ensaios de reativação viral. A recuperação do HIV de células expostas ao PRI-724 sugeriu que os inibidores farmacêuticos de beta-catenina podem ter um papel adjunto ou adicional para a redução da persistência viral de longo prazo nas Tscm do CD4. Ao examinar uma população mais típica de células, a célula T CD4+ de memória central, Tokameh Mahmoudi, do Centro Médico Erasmus, Países Baixos, também apresentou evidências de que a ativação da via Wnt por ligantes naturais ou inibidores de pequenas moléculas poderia induzir a expressão do HIV latente. Seu trabalho foi realizado em clássicos modelos laboratoriais de linha celular de latência, as linhas celulares J-Lat 1.1 e SLat30. Embora essas linhas sejam às vezes criticadas como representações de artefatos laboratoriais ao invés do caráter verdadeiro do reservatório latente em pacientes, muitos estudos realizados com esses modelos simples deram origem a outros mais complexos ou que utilizam as células de pacientes. Mahmoudi descobriu que o tratamento de células latentes infectadas pelo HIV com ativadores da via Wnt resultou no recrutamento do TCF/LEF e beta-catenina, os efetores moleculares da sinalização Wnt, para o LTR de HIV latente. Esse evento foi medido utilizando imunoprecipitação da cromatina, um método laboratorial de padrão ouro para mostrar a presença de um fator celular específico em uma região regulatória de um gene específico ou promotor. A ativação mediada pelo Wnt do LTR de HIV latente foi sinergicamente reforçada com a presença de inibidores de histona deacetilase, cuja capacidade de induzir o HIV latente já é conhecida. Esses estudos também foram confirmados em um modelo de latência desenvolvido mediante a infecção de células CD4 primárias em laboratório, como descrito por Bosque e Planelles. Os estudos de Mahmoudi reforçam as pesquisas de Lichterfel. Entretanto, o valor final dessa abordagem ainda precisa ser inteiramente validado em estudos utilizando inibidores de pequenas moléculas altamente específicos e ferramentas moleculares em células primárias, preferencialmente de pacientes HIV positivos, ao invés dos reagentes não específicos utilizados para induzir a sinalização Wnt (lítio) e a inibição do HDAC (ácido valpróico). Em termos gerais, o Simpósio da IAS sobre a Cura do HIV em Kuala Lumpur apresentou ciência de alto nível e a viagem foi bastante frutífera. É animador ver essa área se expandir e seguir avançando constantemente.
Download