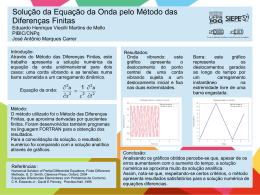
Ferramentas matemáticas no ensino de Química: um estudo sobre orbitais atômicos Karine F. Magnago Departamento de Matemática/FURG - [email protected] Márcio M. Martins Departamento de Química Analítica e Inorgânica/UFPel – [email protected] ABSTRACT 1. Introdução Livros-texto de Química costumam apresentar representações gráficas de orbitais atômicos. O que nem sempre fica claro é que estas figuras surgem naturalmente da solução de uma equação diferencial, conhecida por equação de Schrödinger. Esta equação só tem solução analítica para o átomo de hidrogênio (Z = 1), mas pode ser estendida para átomos hidrogenóides (Z≠1). Ela associa autovalores de energia de um elétron a uma autofunção de onda, denotada comumente por Ψ(r,θ,ϕ) e descrita em coordenadas polares esféricas. No texto clássico de Pauling sobre a teoria quântica[1], temos uma coletânea de funções radiais e angulares para diversos números quânticos n, l e m.. Considere, por exemplo, a função genérica que descreve a parte radial (eq.1) e a parte angular (eq.2) da função de onda: 12 2Z 3 ( n − l − 1)! − Zr 2 Zr l 2 Zr L2nl++l1 e na R nl (r) = − (1) 3 na na 2 n ( ( n + l ) ! ) 0 0 na0 (eqs. 1 e 2) de quaisquer orbitais atômicos para os mais diferentes elementos químicos. Esta ferramenta pode ser desenvolvida no software MAPLE[2] ou em software de código aberto, como o gnuplot[3]. Tomemos como exemplo a função de onda angular abaixo, um caso particular da equação 2: Ψnlm (θ, φ) = Ψ320 (θ, φ) = Θ32 (θ ) ⋅ Φ 0 (φ) = 10 1 (3 cos 2 θ − 1) ⋅ 4 2π Figura 1: Função Densidade de Probabilidade 2 Ψ320 (θ, φ). References [1] Pauling, Linus; Wilson Jr, E. B., Introduction to Quantum Mechanics with applications to Chemistry, Dover 12 imφ ( 2l + 1) ( l − m !) Publications, New York, 1985 e m (2) Θ lm ( θ ) ⋅ Φ m = Pl (cos θ) ⋅ [2] Moore, B.G.; Orbital Plots Using Gnuplot, ( ) 2 l + m ! 2π Journal of Chemical Education, 77(6), Onde L é um polinômio de Legendre e P é um 785-789, 2000 polinômio associado de Laguerre. Os números quânticos seguem as seguintes restrições: n = [3] Maple, disponível em www.maplesoft. 0, 1, 2,...; l = 0, 1,..,n-1; m = 0, ±1, .., ±l. O com, acessado em 15/06/2006 quadrado da parte angular (eq.2) da função de [4] gnuplot, disponível em www.gnuplot.info, onda nos fornece uma densidade de acessado em 15/06/2006. probabilidade que permite determinar as regiões do espaço onde é mais provável encontrar um elétron que possua um determinado conjunto de números quânticos. 2. Objetivos Visando aperfeiçoar a compreensão de professores e alunos acerca deste aspecto da Química, nós pretendemos, neste trabalho, mostrar o desenvolvimento de uma ferramenta para a obtenção de representações gráficas 0
Baixar