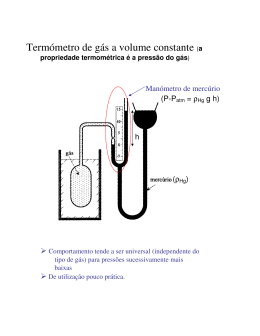
I – Termodinâmica Albert Einstein em 1905, quando recebeu seu Ph.D pela Universidade de Zurique, na Suíça. No mesmo ano, publicou uma série de artigos de grande importância para o desenvolvimento da Física sobre o Efeito fotoeléctrico, o Movimento Browniano e a Teoria da Relatividade Restrita. Em 1922, recebeu o Prémio Nobel de Física, por seu trabalho publicado em 1905 sobre o efeito fotoeléctrico. Até o momento, o nosso estudo de Física tratou principalmente da mecânica newtoniana, que explica uma ampla gama de fenómenos como o movimento das bolas de ténis, dos foguetes e dos planetas. Aplicamos estes princípios aos sistemas oscilantes, à propagação de ondas mecânicas num meio e às propriedades dos fluidos em repouso e em movimento. Agora dirigiremos a nossa atenção para o estudo da termodinâmica, que envolve conceitos de transferências de energia, entre um sistema e seu ambiente e as variações resultantes na temperatura ou mudanças de estados. A termodinâmica explica as principais propriedades da matéria e a correlação entre estas propriedades e a mecânica dos átomos e moléculas. Historicamente a termodinâmica se desenvolveu paralelamente à teoria atómica da matéria. Em 1827 o botânico Robert Brown descobriu que um grão de pólen flutuando na água se move continuamente de maneira aleatória, quando observado ao microscópio. Em 1905 Albert Einstein, no artigo intitulado “Sobre o movimento de partículas suspensas em fluidos em repouso, como postulado pela teoria molecular do calor”, utilizou a teoria cinética para explicar a causa deste movimento aleatório, que hoje em dia é conhecido como Movimento Browniano. A suposição básica de Einstein era a de que as partículas em suspensão num líquido ou num gás compartilham da agitação térmica das moléculas que constituem o meio. Explicou que o movimento browniano resulta, dos impactos das moléculas do fluido sobre a partícula em suspensão. Pelos resultados obtidos por Einstein, quanto menores fossem as moléculas do fluido, menor seria o movimento das partículas em suspensão. Isto significa que se o fluido não fosse feito de moléculas, se fosse completamente contínuo, infinitamente divisível, as partículas brownianas não se moveriam. Portanto, a própria observação de que elas se movem é uma evidência irrefutável da existência das moléculas. Jean-Perrin confirmou esta previsão de Einstein e o seu trabalho forneceu uma confirmação impressionante da existência dos átomos, e por isso ele recebeu o Prémio Nobel de Física em 1926. Hoje em dia temos evidências mais directas da existência dos átomos. A termodinâmica também trata de muitas questões práticas: como um refrigerador arrefece, ou que tipos de transformações ocorrem num motor de carro, ou porque uma bomba de bicicleta se aquece enquanto alguém enche o pneu? As leis da termodinâmica nos permitem responder tais perguntas. Em geral, a termodinâmica trata das transformações físicas e químicas da matéria em todos os seus estados: sólido, líquido, gás e plasma. Nota: Endereço na Internet da demonstração do movimento Browniano: http://galileo.phys.virginia.edu/classes/109N/more_stuff/Applets/brownian/brownian.html Termodinâmica – 2007/2008 Ana Rodrigues 1 Capítulo 1 Temperatura Tópicos do Capítulo 1.1 1.2 1.3 1.4 1.5 1.6 Temperatura e o Princípio Zero da Termodinâmica Termómetros e a Escala Celsius O Termómetro de Gás a Volume Constante e a Escala Kelvin Escala Fahrenheit Expansão Térmica de Sólidos e Líquidos Descrição Macroscópica de um Gás ideal 1.1 Temperatura e o Primeiro Princípio da Termodinâmica Frequentemente associamos o conceito de temperatura com o grau de calor ou de frio de um corpo que tocamos. Assim, nosso sentido de tacto nos fornece uma indicação qualitativa da temperatura; entretanto, nossos sentidos são pouco confiáveis e normalmente enganadores. Por exemplo, se removemos um recipiente de metal com gelo e um pacote de papel cartão com vegetais congelados do congelador, o recipiente com gelo parecerá mas frio para a nossa mão do que os vegetais, apesar de estarem ambos à uma mesma temperatura. Isso acontece porque as propriedades do metal são tais que a transferência de energia (pelo calor) da nossa mão para o recipiente de gelo é mais rápida do que para a embalagem de papel cartão. A nossa pele é sensível à taxa de transferência de energia – potência –, não à temperatura do corpo. Naturalmente, quanto maior for a diferença entre a temperatura do corpo e a nossa mão, mais rápida é a transferência de energia e, assim, a temperatura e o nosso tacto estão de alguma maneira relacionados. O que necessitamos é de algum método confiável e reprodutível para estabelecer a “quentura” e a “frieza” relativa dos corpos que esteja relacionado apenas à temperatura do corpo. Os cientistas desenvolveram uma variedade de termómetros para fazer tais medidas quantitativas. Estamos todos familiarizados com experiências nas quais dois corpos a temperaturas iniciais diferentes alcançam alguma temperatura intermediária quando colocados em contacto um com o outro. Por exemplo, se misturarmos em uma banheira água quente e água fria de torneiras separadas, a água combinada rapidamente alcança uma temperatura de equilíbrio entre as temperaturas da água quente e da fria. Do mesmo modo, se um cubo de gelo for colocado num copo de café quente, o gelo eventualmente irá derreter e a temperatura diminuirá. Através destes exemplos familiares desenvolveremos a noção científica de temperatura. Imagine dois corpos colocados num recipiente isolado de tal modo que formem um sistema isolado. Se os corpos estiverem a temperaturas diferentes, a energia pode ser trocada entre eles por meio de, por exemplo, calor ou radiação electromagnética. Diz-se que estão em contacto térmico os corpos que podem trocar energia uns com os outros desta maneira. Eventualmente, as temperaturas dos dois corpos irão igualar-se, um tornando-se mais quente e o outro mais frio, como nos exemplos citados anteriormente. O equilíbrio térmico é a situação na qual dois corpos em contacto térmico deixam de ter qualquer troca de energia. Utilizando estas ideias, podemos desenvolver uma definição formal da temperatura. Considere dois corpos A e B que não estão em contacto térmico e um terceiro corpo C que será o nosso termómetro – um dispositivo calibrado para medir a temperatura do corpo. Desejamos determinar se A e B estariam em equilíbrio térmico se fossem colocados em contacto térmico. O termómetro é colocado primeiramente em contacto térmico com A e sua leitura é registada, como mostrado na Figura 1.1.a. O termómetro é então colocado em contacto térmico com B e sua leitura é registada (Figura 1.1.b). Termodinâmica – 2007/2008 Ana Rodrigues 2 Figura 1.1. O Princípio Zero da Termodinâmica. Se as duas leituras forem as mesmas, então A e B estão em equilíbrio térmico um com o outro. Se forem colocados em contacto térmico um com o outro, como na Figura 1.1.c, não há nenhuma transferência de energia entre eles. Podemos resumir este resultado num enunciado conhecido como O Princípio Zero da termodinâmica (a lei do equilíbrio): Se os corpos A e B estiverem separadamente em equilíbrio térmico com um terceiro corpo C, então A e B estão em equilíbrio térmico entre si. Essa afirmação, elementar como pode parecer, é facilmente comprovada experimentalmente e é muito importante porque pode ser utilizada para definir a noção de temperatura. Podemos pensar a temperatura como a propriedade que determina se um corpo está em equilíbrio térmico com outros corpos. Dois corpos em equilíbrio térmico entre si estão na mesma temperatura. 1.2 Termómetros e a Escala Celsius Em nossa discussão do princípio zero da termodinâmica, mencionamos um termómetro. Os termómetros são dispositivos utilizados para medir a temperatura de um corpo ou de um sistema com o qual o termómetro está em equilíbrio térmico. Todos os termómetros empregam alguma propriedade física que exibe uma mudança com a temperatura que pode ser calibrada para fazer a temperatura mensurável. Algumas das propriedades físicas usadas são: (1) O volume de um líquido. (2) O comprimento de um sólido. (3) A pressão de um gás mantido a volume constante. (4) O volume de um gás mantido a pressão constante. (5) A resistência eléctrica de um condutor. (6) A cor de um corpo quente. Escala Celsius de Temperatura Um termómetro comum no uso diário consiste de um líquido – geralmente mercúrio ou álcool – que se expande num tubo capilar de vidro quando sua temperatura aumenta. Neste caso a propriedade física que muda é o volume do líquido. Como a área da secção transversal do tubo capilar é uniforme, a mudança no volume do líquido varia linearmente com seu comprimento ao longo do tubo. Podemos, então, definir uma temperatura como estando relacionada ao comprimento da coluna do líquido. O termómetro pode ser calibrado se colocado em contacto térmico com alguns sistemas que permaneçam a temperatura constante e marcando-se a extremidade da coluna de fluido no termómetro. Um sistema assim é uma mistura de água e gelo em equilíbrio Termodinâmica – 2007/2008 Ana Rodrigues 3 térmico na pressão atmosférica. Uma vez que marcamos as extremidades da coluna de fluido para os sistemas de nossa escolha em nosso termómetro, precisamos definir uma escala de números associada às várias temperaturas. Uma escala desse tipo é a escala Celsius de temperatura. Na escala Celsius, a temperatura da mistura água-gelo é definida como zero graus Celsius, escrito 0 °C; esta temperatura é chamada de ponto de fusão do gelo. Outro sistema geralmente utilizado é uma mistura de água e vapor em equilíbrio térmico à pressão atmosférica. Na escala Celsius, esta temperatura é definida como 100 °C, o ponto de vapor ou ponto de ebulição da água. Uma vez que as extremidades da coluna do líquido no termómetro foram marcadas nesses dois pontos, a distância entre as marcas é dividida em 100 seguimentos iguais, cada um denotando uma mudança na temperatura de um grau Celsius (ver Figura 1.2). Figura 1.2. A escala Celsius é definida por dois pontos fixos e uma lei linear. Os termómetros calibrados dessa maneira apresentam problemas quando são necessárias leituras extremamente exactas. Por exemplo, um termómetro de álcool calibrado nos pontos de fusão do gelo e de ebulição da água pode coincidir com um termómetro de mercúrio somente nos pontos de calibração. Como o mercúrio e o álcool têm propriedades de expansão térmica diferentes, quando um indica uma determinada temperatura, o outro pode indicar um valor ligeiramente diferente. As discrepâncias entre os diferentes tipos de termómetro são especialmente grandes quando as temperaturas medidas estão distantes dos pontos de calibração. 1.3 O Termómetro de Gás a Volume Constante e a Escala Kelvin . Embora dispositivos práticos, tais como o termómetro de mercúrio, possam medir a temperatura, eles não a definem de maneira fundamental. Somente um termómetro oferece uma maneira de definir a temperatura e relacioná-la directamente à energia interna: o termómetro de gás. Num termómetro de gás, as leituras da temperatura são quase independentes da substância nele usada. Um tipo de termómetro de gás é o exemplo de volume constante mostrado na Figura 1.3. O comportamento observado nesse dispositivo é a variação da pressão com a temperatura de um volume fixo de gás. Quando o termómetro de gás a volume constante foi desenvolvido, ele foi calibrado utilizando-se os pontos de fusão do gelo e de ebulição da água como mostrado a seguir. O frasco de gás é introduzido num banho de gelo e o reservatório B de mercúrio é levantado ou abaixado até que o volume do gás confinado esteja em algum valor, indicado pelo ponto zero da régua. A altura h (a diferença entre os níveis do reservatório e da coluna A) indica a pressão no frasco a 0 o C , de acordo com a equação: P = P0 + ρgh (pressão num fluido depende somente da profundidade h. P0 é pressão atmosférica). Termodinâmica – 2007/2008 Ana Rodrigues 4 Figura 1.3. Termómetro a gás a volume constante. Agora o frasco é introduzido na água no ponto de ebulição e de novo o reservatório B é reajustado até que a altura na coluna A seja novamente trazida para o zero da régua, garantindo-se que o volume do gás seja o mesmo observado no banho de gelo (daí a designação “volume constante”). Uma medida do novo valor de h dá um valor para a pressão a 100 °C. Esses valores de pressão e temperatura são, então, traçados num gráfico como mostra a Figura 1.4. Com base nas observações experimentais de que a pressão de um gás varia linearmente com sua temperatura (o que é discutido mais detalhadamente mais adiante), traçamos uma linha recta através de dois pontos. A linha que conecta os dois pontos serve como uma curva de calibração para a medição de temperaturas desconhecidas. Se quisermos medir a temperatura de uma substância, colocamos o frasco de gás em contacto térmico com a substância e ajustamos a coluna de mercúrio até que o nível na coluna A retorne a zero. A altura da coluna nos informa a pressão do gás e podemos, então, encontrar a temperatura da substância a partir da curva de calibração. Figura 1.4. Típico gráfico de Pressão versus Temperatura obtido com um termómetro de gás a volume constante. Suponha agora que as temperaturas são medidas com vários termómetros de gás que contêm gases diferentes. Experimentos mostram que as leituras do termómetro são quase independentes do tipo de gás utilizado, contando que a pressão do gás seja baixa e a temperatura esteja bem acima do ponto no qual o gás se liquefaz. Podemos também executar as medidas da temperatura com o gás no frasco com diferentes pressões iniciais a 0 °C. Enquanto a pressão for baixa, geraremos curvas de Termodinâmica – 2007/2008 Ana Rodrigues 5 calibração em linha recta para cada pressão inicial diferente, com mostrado para três experiências (linhas contínuas) na Figura 1.5. Se as curvas na Figura 1.5 forem estendidas para trás rumo às temperaturas negativa, encontraremos um resultado surpreendente. Em todos os casos, não obstante o tipo de gás ou valor de pressão inicial Figura 1.5. Pressão versus Temperatura para três tipos de gases. baixa, a pressão extrapolada vai a zero quando a temperatura é de –273.15 °C. Esse resultado sugere que essa temperatura particular é universal em sua importância porque não depende da substância usada no termómetro. Além disso, como a pressão a mais baixa possível é P=0, que seria um vácuo perfeito, tal temperatura deve representar um limite inferior para os processos físicos. Assim definimos essa temperatura como zero absoluto. Alguns efeitos interessantes ocorrem em temperaturas próximas do zero absoluto, tal como o fenómeno da supercondutividade. Essa temperatura significativa é utilizada com a base da escala Kelvin de temperatura que estabelece –273.15 °C como seu ponto zero (0 K). O tamanho de um grau na escala Kelvin é escolhido para ser idêntico ao tamanho de um grau na escala Celsius. Assim, a seguinte relação permite a conversão entre essas temperaturas: TC = T − 273.15 (1.1) onde TC é a temperatura na escala Celsius e T é a temperatura Kelvin (às vezes chama da de temperatura absoluta). A diferença principal entre essas duas escalas de temperatura é um deslocamento no zero da escala. O zero da escala Celsius é arbitrário, uma vez que depende de uma propriedade associada a uma substância: água. O zero da escala Kelvin não é arbitrário, porque é característico de um comportamento associado a todas as substâncias. A equação 1.1 mostra que a temperatura TC está deslocada da temperatura absoluta T por 273.15. Como o tamanho de um grau é o mesmo nas duas escalas, o ponto de fusão (273.15 K) corresponde a 0.00 °C e o ponto de ebulição (373.15 K) é equivalente a 100.00 °C. Os primeiros termómetros de gás empregaram pontos de fusão do gelo e de ebulição da água de acordo com o procedimento descrito anteriormente. Contudo, esses pontos são experimentalmente difíceis de duplicar. Por tal razão, um novo procedimento baseado em dois novos pontos foi adoptado em 1954 pelo Comité Internacional de pesos e medidas. O primeiro ponto é o zero absoluto. O segundo ponto é o ponto triplo da água, que corresponde à única temperatura e à única pressão nas quais a água, o vapor d’água e o gelo podem coexistir em equilíbrio (Veja a Figura Termodinâmica – 2007/2008 Ana Rodrigues 6 1.6). Esse ponto é uma temperatura conveniente e reprodutível de referência para a escala Kelvin. Ocorre a uma temperatura de 0.01 °C e a uma pressão muito baixa, de 4.58 mm de mercúrio (ou 0.61 kPa). A temperatura no ponto triplo da água na escala Kelvin tem valor de 273.16 K. Assim, a unidade da temperatura do SI, o kelvin, é definida como 1/273.16 da temperatura do ponto triplo da água. Figura 1.6. Ponto triplo da água. A Figura 1.7 mostra temperaturas Kelvin para vários processos e condições físicas. Como a figura revela, o zero absoluto nunca foi atingido, embora experimentalmente em laboratório tenham criado condições muito próximas do zero absoluto. O que aconteceria a um gás se sua temperatura pudesse atingir 0 K? Como a Figura 1.6 indica (se ignorarmos a liquefacção e a solidificação da substância), a pressão que seria exercida nas paredes de seu recipiente seria zero. Quando estudarmos a Teoria cinética dos Gases mostraremos que a pressão de um gás é proporcional à energia cinética das moléculas desse gás. Assim, de acordo com a física clássica, a energia cinética do gás iria a zero e não haveria nenhum movimento das componentes individuais do gás; portanto as moléculas iriam assentar-se no fundo do recipiente. A teoria quântica, modifica esta afirmação ao indicar que haveria alguma energia residual, chamada energia do ponto zero, nessa temperatura baixa. Figura 1.7. As temperaturas absolutas nas quais ocorrem vários processos físicos seleccionados. A escala apresentada é logarítmica. Termodinâmica – 2007/2008 Ana Rodrigues 7 1.4 Escala Fahrenheit A escala de temperatura mais comum no uso diário nos Estados Unidos é a escala Fahrenheit. Essa escala ajusta a temperatura do ponto de fusão em 32 °F e a temperatura no ponto de vapor em 212 °F. A relação entre as escala Celsius e Fahrenheit de temperatura é 9 (1.2) TF = TC + 32 °F 5 A equação 1.2 pode ser facilmente utilizada para encontrar uma relação entre mudanças na temperatura nas escalas Celsius e Fahrenheit. A Figura 1.8 mostra a relação entre as três escalas de temperatura, Fahrenheit, Celsius e Kelvin. A temperatura Celsius muda de ∆TC e a temperatura Fahrenheit muda por uma quantidade ∆TF dada por: 9 ∆TF = ∆TC 5 (1.3) Figura 1.8. Escalas Fahrenheit, Celsius e Kelvin. Enigma 1.1. Numa aula de astronomia, a temperatura do núcleo de uma estrela é dada pelo professor como sendo 1.5 × 107 graus. Um estudante pergunta se o valor está na escala Kelvin ou na Celsius. Como você responderia? Exemplo1.1.Convertendo temperaturas. Num dia quando a temperatura alcança 50 °F, qual é a temperatura em graus Celsius e kelvins? Termodinâmica – 2007/2008 Ana Rodrigues 8
Baixar