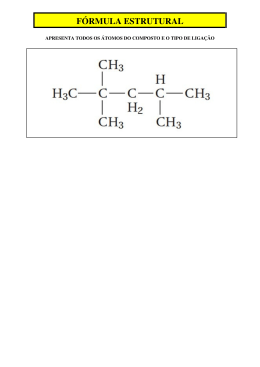
QUÍMICA - 1o ANO MÓDULO 25 ESTEQUIOMETRIA: TIPOS DE FÓRMULA Fixação F 1) (PUC) A água oxigenada é uma solução de peróxido de hidrogênio (H2O2) fortemente antis2 éptica por liberar O2. Os percentuais, em massa, de hidrogênio e oxigênio, neste compostod são, respectivamente: p n a) 2% e 2% m b) 2% e 32% a c) 4,0% e 4,0% b d) 5,9% e 94,1% c e) 50% e 50% d e Fixação 2) (UFF) Alguns óxidos de nitrogênio, dentre os quais N2O, NO, NO2 , N2O3 e N2O5 , podem ser detectados na emissão de gases produzidos por veículos e, também, por alguns processos para fabricação de fertilizantes. Tais óxidos contribuem para tornar o ar muito mais poluído nos grandes centros, tornando-o nocivo à saúde. Dentre os óxidos citados, o que apresenta maior percentual de N é: a) NO b) NO2 c) N2O d) N2O3 e) N2O5 Fixação F 3) (UFRRJ) Os sais de cobre são conhecidos por apresentarem coloração azul, inclusive sendo4 utilizados em misturas destinadas a tratamento de água em piscinas. O sulfato cúprico pentaS h hidratado apresenta uma percentagem de água de aproximadamente a) 23,11% b) 55,34% c) 89,09% d) 36,07% e) 76,22% a b c d e Fixação 4) (PUC) A hidrazina é um composto utilizado na remoção de íons metálicos em águas poluídas. Sabe-se que ela é constituída de 87,42% em massa de nitrogênio e de 12,58% em massa de hidrogênio. Com base nessas informações, é correto afirmar que a sua fórmula mínima é: a) (NH)n b) (NH2)n c) (NH3)n d) (N2H)n e) (N3H)n Fixação 5) (UFF) Para o composto cuja composição centesimal vale C = 42,10% , H = 6,48% e O = 51,42% a fórmula mínima é: a) C2H3O3 b) CH2O c) C2H2O3 d) C2H6O3 e) C3H8O Fixação 6) (USS) A 200g de uma mistura contendo (em massa) 30% de zinco, 40% de chumbo, 20% de estanho e 10% de níquel, foram adicionados 40g de ferro. O teor de zinco na nova mistura é: a) 15% c) 25% b) 20% d) 27,5% e) 30% Fixação F 7) (UFES) A análise elementar de um composto organoclorado forneceu a seguinte composição8 centesimal: 37% de carbono, 8% de hidrogênio e 55% de cloro. p C Com base nes a informação, pode-se afirmar que a fórmula mínima do composto é: H Massas molares (g/mol): C = 12,0; H = 1,0; C = 35,5. N a) C2H5 C O b) C2H2 C2 D c) C H C 4 5 d) C6H5 C e) C5H11 C a b c d e Fixação 8) (UFSM) Na decomposição de 15,01g de um determinado composto, obteve-se a seguinte proporção de massa (em gramas): C= 3,0 H= 1,01 N= 7,0 O= 4,0 Dados: Massas molares (g/mol): C= 12,0; H= 1,0; N=14,0; O= 16,0. A fórmula mínima deste composto é: a) C=1; H=8; N=8; O=4 b) C=1; H=4; N=2; O=1 c) C=2; H=4; N=8; O=4 d) C=2; H=1; N=2; O=1 e) C=3; H=1; N=7; O=4 Fixação F 9) (PUC) A fórmula mínima de um composto orgânico é (CH2O)n. Sabendo-se que o peso1 molecular desse composto é 180, qual o valor de n? 6 d a) 2 c) 6 b) 4 d) 8 e) 12 a b c d e Fixação 10) (PUC) A análise de uma substância desconhecida revelou a seguinte composição centesimal: 62,1% de carbono, 10,3% de hidrogênio e 27,5% de oxigênio. Pela determinação experimental de sua massa molar, obteve--se o valor 58,0 g/mol. É correto concluir que se trata de um composto orgânico de fórmula molecular: (Massas atômicas: C= 12; H= 1; O= 16.) a) C3H6O2 b) CH6O2 c) C2H2O2 d) C2H4O2 e) C3H6O Proposto 1) (PUC) O ácido ascórbico, vitamina C, é um composto orgânico de massa molar 176 g/mol. Se uma amostra de 8,8g de ácido ascórbico possui 3,6 de carbono, 4,8g de oxigênio e 0,4g de hidrogênio, a fórmula molecular deste composto é: a) C9HO12 b) C8H16O4 c) C7H12O5 d) C6H8O6 e) C9H4O4 Proposto 2) (UFF) No combate à dor e à febre, um medicamento muito utilizado é a aspirina, cuja composição centesimal é: C= 60,00%, H= 4,44% e O= 35,56%. Sabendo-se que em uma amostra de aspirina com 0,18g de massa existem 6,02 x 1020 moléculas, conclui-se que a fórmula molecular deste composto é: a) C9H6O3 b) C8H4O5 c) C10H12 O3 d) C9H8O4 e) C8H8O4 Proposto 3) (UFRN) Um fertilizante obtido industrialmente apresenta compostos dos elementos nitrogênio, fósforo e potássio. O teor de nitrogênio é geralmente expresso em NH3. Um saco de 17 kg desse fertilizante contém 10%, em massa, de amônia. A massa de nitrogênio contida no saco é: Dados: Massas molares (g/mol): H = 1; N = 14. a) 1,0 kg b) 1,4 kg c) 1,7 kg d) 2,8 kg Proposto ,4)Uma argila apresenta 45% de sílica e 10% de umidade. Se secarmos completamente esta gargila, o teor de sílica será: a) 100% b) 90% c) 55% d) 50% e) 45% Proposto P 5) (PUC) Em 0,5 mol de quinina, substância utilizada no tratamento da malária, há 120g de6 carbono, 12g de hidrogênio, mol de átomos de nitrogênio e 1,0 mol de átomos de oxigênio.O Pode-se concluir que a fórmula molecular da quinina é: m a) C20 H12 N2O2 b) C20 H24 N2O2 c) C10 H12 NO d) C10 H6N2O2 e) C5H6NO o c — a d a b c d e Proposto 6) (UFF) O esmalte dos dentes contém um mineral chamado hidroxiapatita — Ca5 (PO4)3 OH. Os ácidos presentes na boca, ao reagirem com a hidroxiapatita, provocam o desgaste do esmalte, originando as cáries. Atualmente, com o objetivo de prevenção contra as cáries, os dentifrícios apresentam em suas fórmulas o fluoreto de cálcio. Este é capaz de reagir com a hidroxiapatita, produzindo a fluorapatita — Ca5 (PO4)3 F — uma substância que adere ao esmalte, dando mais resistência aos ácidos produzidos, quando as bactérias presentes na boca metabolizam os restos de alimentos. Com base nas fórmulas mínimas das duas substâncias, pode-se afirmar que o percentual de fósforo nos compostos é, aproximadamente: a) 0,18% b) 0,60% c) 6,00% d) 18,50% e) 74,0% Proposto P 7) (FUVEST - Adaptada) O hidrogênio reage com quase todos os elementos. Sua reação com8 nitrogênio produz amônia (NH3). Industrialmente, esta reação é realizada na presença de umf catalisador. D Calcule a porcentagem em massa de hidrogênio na amônia. Massas molares H = 1,0 g/mol N = 14,0 g/mol Proposto 8) (FUVEST) Determine a fórmula molecular de um óxido de fósforo que apresenta 43,6% de fósforo, 56,4% de oxigênio (% em massa) e massa molecular 284. Dados: P= 31; O= 16. Proposto 9) (UNICAMP) Sabe-se que 1,0 mol de um composto contém 72g de carbono (C), 12 mol de átomos de hidrogênio (H) e 12 x 1023 átomos de oxigênio (O). Admitindo-se o valor da Constante de Avogadro como sendo 6,0 x 1023 mol-1 e com base na Classificação Periódica dos elementos, escreva: a) a fórmula molecular do composto; b) a fórmula mínima do composto. Proposto 10) Determine o número de átomos de oxigênio por molécula de uma substância que apresenta massa molecular 400 e 48% de oxigênio. e Proposto 11) (UNESP) Um éter, de massa molar 60g/mol, tem a seguinte composição centesimal: C = 60%; H = 13,33%; O = 26,67%. (Massas molares, em g/mol: C = 12; H = 1; O = 16) Determine a fórmula molecular do éter. Proposto 12) (UNICAMP) O ácido acetilsalicílico, C9H8O4 é uma substância muito empregada em medicamentos antitérmicos e analgésicos. Uma indústria farmacêutica comprou uma certa quantidade de ácido acetilsalicílico para usá-lo em uma de suas formulações. Como de praxe, para verificar a pureza do material, foi feita a análise química que indicou um teor de carbono de 50%. O produto comprado estava puro? Justifique. Dados: massas atômicas: C =12 H = O = 16 Proposto P 13) (UNITAU) Sabendo-se que um composto mineral apresenta a seguinte composição cen-1 tesimal: Na=27,06%; N=16,47% e O=56,47% e que existe nes e composto somente um átomoq de sódio, calcular a sua fórmula molecular. e Dados: N = 14; O = 16; Na = 23 D Proposto 14) A nicotina contém 73,5% de carbono, 8,6% de hidrogênio e 17,3% de nitrogênio. Sabe-se que este composto contém dois átomos de nitrogênio por molécula. Quais são as fórmulas empírica e molecular da nicotina? Dados: Massas atômicas: C = 12; H = 1; N = 14 Proposto 15) (UFU) Um óxido de nitrogênio foi analisado e apresentou as seguintes porcentagens em massa: 25,9% de nitrogênio e 74,1% de oxigênio. Tendo em vista as informações acima, faça o que se pede: a) Dê a fórmula empírica desse composto. b) O óxido acima apresentado é um óxido molecular ou iônico? Justifique sua resposta. c) Escreva a equação que representa a reação entre óxido e a água.
Download