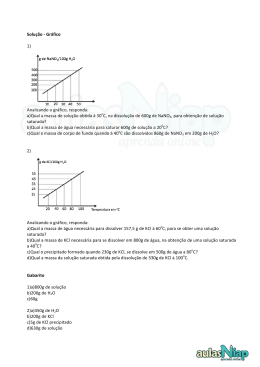
Nome: ______________________________________________________________ nº: ________ Bimestre: 3º Ano/série: 3ª série _____ Ensino: Médio Componente Curricular: Química Professor: Ricardo Honda Data: ____ /____ /____ Lista de exercícios de Química nº 12 Revisão para a 2ª Avaliação: Hidrólise salina e Solubilidade 01. (FEI) – Indique o caráter ácido, básico ou neutro das a) Qual é a massa de KBr que se precipita? reações de hidrólise dos seguintes compostos: b) Calcule a massa total da solução final. c) Determine a menor massa de água necessária para a) cianeto de sódio (NaCN) dissolver 40 g de KBr a 50 ºC. b) cloreto de zinco (ZnCl2) 08. Determine a massa de sal que irá cristalizar no c) sulfato de sódio (Na2SO4) d) cloreto de amônio (NH4Cl) resfriamento de 95 g de solução saturada de 70 ºC para 30 ºC. 02. Foram preparadas três soluções aquosas: uma de NH4Br; outra de NaCN; uma terceira de NaBr. Coloque- Analise o preparo de três soluções de brometo de as em ordem crescente de pH e justifique sua resposta, potássio, a 50 ºC, e responda às questões 09 a 11. utilizando equações químicas. 03. A única das espécies abaixo que, ao ser dissolvida em água, resulta em uma solução com pH menor que o do solvente puro é: a) NaCl b) Na2CO3 c) KCl d) NH3 e) (NH4)2SO4 04. Considere os seguintes sais: NaCℓ, K2SO4, NH4Br, AℓCℓ3, KBr, K2S, NH4Cℓ, KCℓ, NaCN, H3CCOONa e Na2CO3. a) Quais dos sais a seguir poderiam ser usados para diminuir a acidez do solo? Justifique sua resposta, utilizando equações químicas. b) Quais dos sais a seguir poderiam ser usados para diminuir a alcalinidade do solo? Justifique sua resposta, utilizando equações químicas. Considere essas informações e responda às questões 05 a 08. O brometo de potássio apresenta a seguinte tabela de solubilidade: Temperatura (ºC) 30 50 70 g de KBr / 100 g de H2O 70 80 90 09. Classifique em saturada ou não-saturada cada solução analisada (A, B e C). 10. Apenas uma das soluções está saturada e apresenta corpo de fundo. Identifique-a e calcule a massa desse corpo de fundo. 11. Qual das três soluções encontra-se mais diluída (menos concentrada)? 12. O coeficiente de solubilidade de um sal é de 60 g por 100 g de água a 80 ºC. Determine a massa em gramas desse sal, nessa temperatura, necessária para saturar 80 g de H2O. 05. Qual a massa de brometo de potássio necessária 13. (UnB) – Examine a tabela abaixo, em que constam dados sobre a solubilidade da sacarose (C12H22O11), do para saturar: sulfato de sódio (Na2SO4) e do clorato de potássio (KClO3) em água, a duas temperaturas diferentes e a) 100 g de água a 50 ºC; julgue os itens seguintes: b) 200 g de água a 70 ºC. 06. Uma solução foi preparada, a 30 ºC, dissolvendo-se 40 g de brometo de potássio em 100 g de água. Essa solução é saturada? Substância C12H22O11 Na2SO4 KClO3 Solubilidade em água (g/L) 40 ºC 60 ºC 2381 2873 488 453 12 22 07. Uma solução saturada desse sal foi preparada utilizando-se 200 g de H2O a 70 °C e a seguir foi resfriada a 30 ºC. Com base nessas informações, (0) A solubilidade de uma substância em determinado solvente independe da temperatura. responda: (1) Uma solução aquosa de sulfato de sódio, de concentração 488 g/L, deixa de ser saturada, quando aquecida a 60 ºC. (2) A uma dada temperatura, a quantidade limite de um soluto que se dissolve em determinado volume de solvente é conhecida por solubilidade. (3) Nem todas as substâncias são mais solúveis a quente. Quais desses itens são corretos? 20. Para que a solução I seja considerada saturada a 20 ºC, a quantidade de NaNO3 dissolvida deve ser igual, maior ou menor que 88 g? 21. Para que a solução I seja considerada supersaturada a 20 ºC, a quantidade de NaNO3 dissolvida deve ser igual, maior ou menor que 88 g? 22. A solução II, a 20 ºC, encontra-se não-saturada, saturada ou supersaturada? Com base no gráfico abaixo, responda às questões 14 a 23. Se a massa do frasco for igual a 200 g e a massa do 18. corpo de fundo for de 12 g, qual será a massa total do sistema a 20 ºC? 24. (UFGO) – O gráfico a seguir representa a solubilidade de vários sais em função da temperatura, expressa em gramas do soluto por 100 gramas de água. 14. Considerando apenas as substâncias NaNO3 e Pb(NO3)2, qual delas é a mais solúvel em água, a qualquer temperatura? Indique os itens corretos: 15. Aproximadamente a qual temperatura a solubilidade I — A solubilidade dos sais aumenta com a elevação da do KCl e do NaCl são iguais? temperatura na ordem: NaCl, KCl, RbCl, CsCl. II — Com exceção do Li2SO4, a solubilidade de todos os 16. Qual das substâncias apresenta maior aumento de sais aumenta com a elevação da temperatura. solubilidade com o aumento da temperatura? III — A solubilização do KCl aumenta com o aumento da temperatura. 17. Compare as solubilidades das substâncias KNO3 e IV — A 0 ºC o NaCl é menos solúvel que o KCl. NaNO3 a 68 ºC, abaixo e acima dessa temperatura. Gabarito: 01. a) caráter básico; b) caráter ácido; c) 18. Qual a massa de uma solução saturada de NaNO3 a caráter neutro; d) caráter ácido; 02. pH: NH4Br < NaBr < 20 ºC obtida a partir de 500 g de H2O? NaCN; 03. E; 04. a) K2S, NaCN, H3CCOONa e Na2CO3; b) NH4Br, AℓCℓ3 e NH4Cℓ; 05. a) 80 g; b) 180 g; 06. Não, Considere duas soluções aquosas de NaNO3 a 20 ºC, é insaturada; 07. a) 40 g; b) 380 g; c) 50 g; 08. 10 g; 09. cada qual contendo 100 g de H2O, cujo coeficiente de A: não saturada, B: saturada (sem corpo de chão), C: solubilidade seja 88 g de NaNO3 / 100 g de H2O e saturada (com corpo de chão); 10. Solução C (20 g de responda às questões 19 a 23. corpo de fundo); 11. Solução A; 12. 48 g; 13. Estão corretos os itens (2) e (3); 14. NaNO3; 15. 35 ºC; 16. AgNO3; 17. Abaixo de 68 ºC: NaNO3 é mais solúvel que KNO3; Acima de 68 ºC: KNO3 é mais solúvel que NaNO3; 18. 440 g; 19. Menor que 88 g; 20. Igual a 88 g; 21. Maior que 88 g; 22. Saturada com corpo de chão; 23. 400 g; 24. Estão corretos os itens II e III. 19. Para que a solução I seja considerada não-saturada a 20 ºC, a quantidade de NaNO3 dissolvida deve ser igual, maior ou menor que 88 g?
Baixar