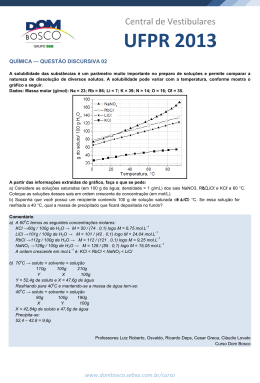
Química 2 Módulo 1 COMENTÁRIOS – ATIVIDADES 1. 1. PARA SALA Em 100mL de H2O 20mL de H2O x = 2,5g de K2Cr2O7 12,5g de K2Cr2O7 x Resposta correta: D Característica de suspensão. Resposta correta: C 2. COMENTÁRIOS – ATIVIDADES PROPOSTAS 2. I. II. III. IV. (V) (F) A 20 oC a solubilidade de B é menor que a de A. (V) (F) A solubilidade de B, aumenta com o aumento de temperatura. V. (V) Uma dispersão coloidal é todo sistema no qual uma ou mais substâncias estão disseminadas sob a forma de pequenas partículas, estas possuem tamanho médio entre 1 e 1000nm, temos como exemplo o leite pasteurizado. Resposta correta: C Resposta correta: C 3. 3. o A 80 C a quantidade de K2SO4 dissolvida é de 18g. o A 20 C a quantidade de K2SO4 dissolvida é de 10g. Álcool e água são líquidos, ao misturar os dois obteremos uma solução líquida. Ao resfriar a solução de 80oC para 20oC, a quantidade que irá permanecer dissolvida é de 10g, o restante precipitará, ou seja, 8g. Resposta correta: E 4. I. Solução insaturada, quando contém uma quantidade de soluto inferior ao seu coeficiente de solubilidade na temperatura que se encontra a solução. Resposta correta: D 4. II. Solução supersaturada, quando ela contém uma quantidade de soluto superior ao seu coeficiente de solubilidade na temperatura que se encontra a solução. A 10oC temos: 20,0g do sal/ 100g de H2O ou 10,0g do sal/50g de H2O o A 25 C temos: 18g do sal / 50g H2O o Resfriando a 10 C, temos a formação de 8g de precipitado e 10g permanecem dissolvidos. III. Solução saturada, quando a quantidade de soluto presente na solução é igual ao valor do coeficiente de solubilidade na temperatura que se encontra a solução. Resposta correta: D 5. Resposta correta: B Observe: 5. Temperatura (Cº) a) Temperatura (°C) g de KBr/100g de H2O g de KBr/200g de H2O 30 70 140 50 80 160 70 90 180 Solubilidade (g de KCA/100g Solubilidade (g de KCA/200g de água) de água) 27,5 30 35 37,5 40 55 60 70 75 80 10oC 20oC 40oC 50oC 60oC Ao adicionar 60g de KCA em 200g de água a 50oC, a solução será insaturada e sem corpo de fundo pois a 50oC a solubilidade do sal é 75g/200g água. 180g – 140g = 40g de KBr que se precipita. Ao resfriar o sistema a 10oC, a solução será saturada e com corpo de fundo, pois a 10oC a solubilidade do sal é 55g/200g de água. b) MT = 140g + 200g = 340g Resposta correta: C PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2 1 6. Água e óleo não são soluções, soluções são dispersões homogêneas de dois ou mais componentes. Água e óleo formam uma mistura bifásica, e não uma solução. Resposta correta: C 7. (F) Na temperatura de 60oC, a quantidade máxima da solução B que se dissolve em 1L de água é de 453g/L. Logo, a solução sobrenadante continua saturada, porém, nessa temperatura passaria a apresentar 35g de corpo de fundo. Se o aquecimento fosse feito bem lentamente e se a solução fosse mantida em absoluto repouso, seria possível obter uma solução supersaturada da solução B, com 488g de sal/L de água. Tal solução, no entanto, é muito instável e qualquer perturbação causaria a precipitação dos 35g da solução B. II. (V) III. (V) IV. (F) A solubilidade depende diretamente da temperatura. I. 13. As soluções são definidas como dispersões homogêneas de dois ou mais componentes. Resposta correta: A 14. Coloides são dispersões que possuem características intermediárias às misturas heterogêneas e às misturas homogêneas. Numa dispersão coloidal, as partículas do disperso são pequenos agregados de átomos, de íons, de moléculas, de macromoléculas ou de macroíons, cujo diâmetro varia entre 10Å e 1000Å. Estas dispersões possuem mais de uma fase. Essas fases, porém, só podem ser observadas em um ultramicroscópio ou microscópio eletrônico. Resposta correta: B Módulo 2 COMENTÁRIOS – ATIVIDADES 1. PARA SALA Pela análise do gráfico, observa-se que suas solubilidades são praticamente iguais. Resposta correta: C Resposta correta: E 8. (F) A 25oC a solubilidade do sal é de 15g/100g de H2O. II. (V) III. (F) O sistema III é uma solução saturada com corpo de fundo. IV. (V) 2. Pelo gráfico: I. Temperatura (°C) g de soluto/100g de H2O g de soluto/200g de H2O 40 40 80 80 60 120 Resposta correta: B 9. Todas as afirmações são verdadeiras. mdepositada = 120g – 80g = 40g Resposta correta: E Resposta correta: 40g 3. 10. m1 = ? Coloides são dispersões de partículas com diâmetro entre 1nm e 100nm em um solvente. Muitos alimentos são coloides, como creme de leite e maionese. Espumas são dispersões de um gás em um líquido ou sólido. A espuma de poliestireno (isopor) é coloide. m = 2,5 x 10 − 3 mol / L V = 5.000 L M CO 2 = 44g / mol m= m1 mCO 2 x V(L) m1 = m . M CO 2 . V(L) m1 = 2,5 × 10–3 × 44 × 5.000 m1 = 550g = Resposta correta: D Resposta correta: A 11. Sabão e detergentes são usados na limpeza, tais produtos possuem uma parte de sua molécula hidrofóbica que se une às gorduras que são apolares, e a parte hidrofílica se une às moléculas da água que são polares, quando ocorre essa agregação e a formação de partículas coloidais, que conhecemos por micelas. Resposta correta: D 4. MMNaC O = 74,5g/mol V = 3000L –3 M = 1,0 . 10 mol/L =? A M= 12. Característica de suspensão. MM x V ⇒ –3 = 1,0 . 10 . 74,5 . 3000 = 223,5g Resposta correta: C Resposta correta: C 2 =M×M.M×V PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2 0,55kg 5. Pela estequiometria, temos: 3− + K3PO4 + PO4( aq) 3K (aq) 5. 1mol 3mol x 0,6mol 0,6 mol x= = 0,2 3 L A 35oC temos aproximadamente 50g de sal em 100g de H2O, logo temos: H2O 100g x SAL 50g 30g x = 60g Resposta correta: B Resposta correta: B COMENTÁRIOS – ATIVIDADES PROPOSTAS 1. 6. V = 200 mL m = 58 mg A 0oC, temos: 20g de B 120g de B 100g de H2O xg de H2O C= m1 58 mg ⇒ C= ⇒ V 200 mL x = 600g de H2O C = 0,29 g/L A 0oC, temos para A: 10g de A Resposta correta: A 7. 100g de H2O 1000mL de água 2 . 106mL de água 0,03kg do sal x kg do sal mA = 10g x = 60kg ∴ 6,0 . 101kg Resposta correta: C Resposta correta: A 2. A solubilidade dos gases em um solvente líquido aumenta com a diminuição da temperatura. 8. m1 = ? m1 = . MCO . V(L) 2 = 0,25M m1 = 0,25 . 342 . 2 MC H O = 342g / mol 12 22 11 m1 = 171g V = 2L Resposta correta: B 3. Temperatura (°C) g de K2Cr2O7/100g de H2O g de K2Cr2O7/50g de H2O 100 100 50 90 80 40 80 65 32,5 70 55 27,5 Resposta correta: D 9. Cálculo da massa do ácido fosfórico recomendada para um indivíduo de 42kg. 1kg 42kg 5mg x x = 210mg Cálculo do volume da solução de ácido fosfórico. A cristalização deve começar, pelo gráfico, a 70°C. 0,6g 210 . 10–3g Resposta correta: D 1L y y = 350 . 10–3L ∴ 350mL 4. A solubilidade dos gases nos líquidos diminui com altas temperaturas e baixas pressões. O indivíduo pode ingerir uma latinha. Resposta correta: A Resposta correta: A PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2 3 10. mC12H22O11 = 0,171g MC12H22O11 = 342g/mol mNaCA = 0,585g MNaCA = 58,5g/mol 15. – Cálculo da concentração molar: • Para o LiCA: I. MC 12H22O11 = m1 0,171 0,171 –1 = = 0,001mol . L = M1 . V 342 . 0,5 171 = m ⇒ M . V(L) = 0,1g ⇒ 42,39.0,1 II. MNaCA = m = 0,023mol/L m1 0,585 0,585 –1 = = 0,02mol . L = 29,25 M1 . V 58,5 . 0,5 Resposta correta: B • Para o NaCA: 11. Sacarina M1 = 183g/mol m1 = 3,66mg/gota ⇒ 50 gotas ⇒ m1 = 183mg de sacarina −3 m1 183 x 10 g –1 = = 0,004mol . L = 183g / mol . 0,25L M1 . V = m ⇒ M . V(L) 0,1g ⇒ 58, 44.0,1 = 0,017mol/L 0,1g ⇒ 84,0079.0,1 = 0,011mol/L = • Para o NaHCO3: Resposta correta: D = 12. Pela estequiometria, temos: m ⇒ M . V(L) = • Para o Na2CO3: 3− K3PO4 3K+(aq) + PO4( aq) 1mol 3mol x 0,6mol 0,6 mol = 0,2 x= 3 L = m ⇒ M . V(L) = 0,1g ⇒ 93,98.0,1 = 0,010mol/L = 0,1g ⇒ 138,21.0,1 = 7,23 × 10 mol/L • Para o K2CO3: Resposta correta: B = 13. Dados: m ⇒ M . V(L) MNaCA = 117g O LiCA possui maior molaridade. mNaCA = 0,25mol/L Resposta correta: A –3 MNaCA = 23 + 35,5 = 58,5g/mol Módulo 3 Substituindo, na fórmula da molaridade temos: m 117 = ⇒ 0,25 = M . V (L ) 58,5 . V V= 117 ⇒ 14,625 COMENTÁRIOS – ATIVIDADES V = 8L 1. τ = 2,0% = 0,02 Resposta correta: C ⇒τ= m1=? 14. Solução: 1L de água + 10mL de água sanitária VFINAL = 1.000mL + 10mL = 1010mL = 1,01L I. 2. MNaOH = 40 g mol MH O = 18g mol 2 nNaOH = m1 0,3725 = = = 0,005mol / L = V V 74,5 ⋅1,01 nH O = Resposta correta: A 2 mNaOH MNaOH mH O 2 MH O = = 160g = 4 mols 40g.mol−1 216g = 12mols 18g.mol−1 2 PRÉ-VESTIBULAR m ⇒ 0,02 = Resposta correta: C Massa molar de NaOCA = 74,5g/mol 4 m1 m = 0,75kg = 750g Cálculo da massa de NaOCA (C = 37,25g/L) 37,25g ____ 1.000mL x _____ 10mL ⇒ x = 0,3725g n1 PARA SALA | VOLUME 1 | QUÍMICA 2 m1 750 ⇒ m1 = 15 g XNaOH = nNaOH ⇒ XNaOH = nNaOH + nH O 2. 4 4 = = 0,25 4 + 12 16 2 XNaOH + XH O = 1 ⇒ XH O = 1− 0,25 = 0,75 2 2 Resposta correta: B 3. nKNO = 3 Dados: m1 =6g m2 = 90g M1 = 60g/mol M2 = 18g/mol I. mKNO 3 MKNO 20 g = = 0,2mol 100 g mol 3 mH O = msolução − mKNO 2 II. Fração Molar: m 0,1 6 n n1 = 1 = = 0,1mol → x1 = 1 = = 0,019 M1 5,1 60 n m 90 n2 = 2 = = 5mols M2 18 3 mH O = 100g − 20g = 80g = 0,08kg 2 ω= nKNO 3 mH O (kg) ⇒ω= 0,2 = 2,5molal 0,08 2 Resposta correta: B 4. Molalidade: m .1000 6.1000 60 = ω= 1 = = 1,11 60.90 54 M1 .m2 III. m = m1 + m2 = 6 + 90 = 96g 96g de solução 100% 6g de soluto x 80g ⎯⎯⎯⎯ → 1g 100 ⇒ x= = 1,25g ELEVA 100g ⎯⎯⎯⎯ → x 80 C = 1,4 + 1,25 = 2,65g/L C 2,65 = = 1,5 . 10–2mol/L = MM 180 ELEVA x = 6,25% IV. τ= m1 m = 6 = 0,0625 96 Resposta correta: D 5. Resposta correta: B 1000.d. τ m . M = 1000 . d . τ ⇒ m = M 1000.0,970.0,20 ⇒m= ⇒ m = 4,2mol/L 46 3. CHNO 3 = 126g/L A adição de solutos pouco voláteis causa uma diminuição na volatilidade do solvente puro, ou seja, essas soluções apresentam um ponto de ebulição maior que o do solvente puro. COMENTÁRIOS – ATIVIDADES PROPOSTAS t – t2 = KE . t t2 KE m1 M1 m2 m1 .1000 M1 .m2 nH2 O = , onde: X HNO 3 = ponto de ebulição do solvente numa solução = ponto de ebulição do solvente puro = constante ebuliométrica = massa do soluto = massa molar do soluto = massa do solvente 874 = 48,55mol 18 nHNO 3 1,99 ⇒ ⇒ = 1,99 + 48,55 nHNO 3 + nH2 O HHNO ≅ 0,0392 3 HHNO3 + X H2 O = 1 X H2 O = 1 − X HNO 3 Dados: t = 56,88°C t2 = 56,38°C –1 KE = 1,67°C . mol . kg m1 = 0,707g m2 = 10g HH2 O ≅ 0,9607 Resposta correta: C 4. Cálculo da massa de álcool no sangue de um adulto com 5L de sangue: 0,707.1000 (56,88 – 56,38) = 1,67 . M1 .10 0,5 = 1L de H2O Significa dizer que temos 126 g do soluto dissolvido em 874 g do solvente. Assim, temos: 126 = 1,99mol nHNO 3 = 63, 02 Resposta correta: A 1. MHNO3 = 63,02 MH2 O = 18 Temos: 126g de HNO3 Resposta correta: D 6. d = 1,008g/mL 118,069 118,069 ⇒ M1 = ⇒ M1 = 236,138g/mol M1 0,5 0,6 g 1L m 5L ⇒ m = 3,0g de álcool no sangue Resposta correta: 236 PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2 5 Como a porcentagem de álcool que fica no sangue é de 15% em massa, a massa de álcool ingerida é: 7. τ = 60% = 0,6 mC6H12O6 = 180g 15% 3,0g ⇒ m = 20g de álcool ingerido m m=? 100% m = mC Cálculo do volume de álcool ingerido: 6H12 O6 m1 180 ⇒ 0,6 = ⇒ m m 180 g ⇒ m = 300 g m= 0,6 ⇒ 300g = 180g + mH O ⇒ + mH O 2 τ= 2 ⇒ mH O = 120g 2 m 20 ⇒ 0,80 = ⇒ V = 25mL d= V V Resposta correta: A 8. Cálculo do volume de cerveja que contém 25mL de álcool: 25mL – 5% ⇒ V = 500mL de cerveja V – 100% Observação: o etanol é o solvente e a água é o soluto. Passando os valores fornecidos em massa para a quantidade de matéria, teremos: H2O = 18 g/mol e C2H5OH = 46 g/mol 18g de água 90g de água Cálculo do número de latas de cerveja: 1 mol de água x 350mL 1 Lata x 500mL x = 1,43 lata x = 5mol de água. Resposta correta: A 1 mol de etanol y 46g de etanol 230g de etanol y = 5mol de etanol 5. τ% = τ x 100 m τ% = 1 x 100 m m1 8= x 100 200 m = 16g Cálculo da porcentagem molar: τ= mol1 mol1 + mol2 ⇒ τ= τ = 0,5 × 100 ⇒ Resposta correta: A τ % = 50% Resposta correta: A 6. I. τ= m1 10 10 ⇒ = = 0,09 m 10 + 100 110 9. τ = 0,091% ⇒ 0,009 m1 = ? m = 0,5kg = 500g m m1 τ = 1 ⇒ 0,009 = ⇒ m1 = 4,5g m 500 τ% = τ x 100 τ% = 0,09 x 100 ⇒ τ% = 9% II. τ = m1 10 ⇒ = 0,09 m 110 Resposta correta: C τ% = 0,09 x 100 ⇒ τ% = 9% III. τ = 10. Cálculo da massa de água fluoretada em 2L, admitindo densidade igual a 1g/mL 1mL 1g de H2O 2000mL x m1 20 20 ⇒τ= = = 0,1 m 20 + 180 200 x = 2000g de H2O τ% = 0,1 x 100 ⇒ τ% = 10% IV. τ% = Cálculo da massa de flúor nesses 2 litros dessa água 584,5 = 0,26 584,5 + 1620 0,9g de flúor y 106g de água 2000g de água y = 1,8 . 10–3g de flúor = τ% = 0,26 x 100 = 26% = 1,8mg de flúor Resposta correta: B Resposta correta: D 6 5 ⇒ τ = 0,5 5+5 PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2 11. Atribuindo 1g para a massa dos peixes e da água, temos: Para a água: 6 10 g 200mg x 1g Para os peixes: 6 0,05 mg 10 g y 1g x = 2 × 10 mg y = 5 × 10 mg –7 182500L de H2O y II. 1 hab por ano consome 6 2 x 10 hab por ano 11 y = 3,65 x 10 L de H2O – III. Em 1L de H2O temos 1mg de F 11 3,65 x 10 L ––––––––– z 8 – z = 3,65 × 10 g de F -11 Fator: 2 x 10−7 5 x 10−11 = 4000 ∴ 4 × 10 3 – IV. Para cada 100g de NaF 36,5g de F 8 – ωg de NaF 3,65 × 10 g de F 9 6 ω = 10 g = 10 kg de NaF Resposta correta: A Resposta correta: D 12. 1,25 mol de Fe2(SO4)3 ________ 1kg de H2O = 500mg de Fe2(SO4)2 ________ 1000g de H2O 1.500g de solução. Em: 1.500g de solução 500g de Fe2 (SO4 )3 = 33,3% Módulo 4 COMENTÁRIOS – ATIVIDADES 1.000g de H2O = 66,7% Logo: 15kg de solução 1. 5,0kg de Fe2 (SO4 )3 = 33, 3% 10kg de H2O = 66,7% Resposta correta: E C2 = 10 g/L v1 = ? V2 = 125ML v1 = 50mL Resposta correta: A 2. Resposta correta: A C1 = 25 g/L C1V1 = C2V2 25 . V1 = 10 . 125 13. Soluções moleculares são aquelas que possuem apenas moléculas como partículas dispersas. Soluções iônicas são aquelas que possuem íons como partículas dispersas, lembrando que uma solução iônica não tem necessariamente apenas íons dissolvidos. I. ( F ) III. ( V ) II. ( V ) IV. ( F ) 14. Os efeitos coligativos dependem unicamente da quantidade de partículas do soluto. + – K + CA (α = 100%) KCA 1,2mol PARA SALA CiVi = CfVf 1 . 150 = 0,25 . Vf Vf = 600 – mL ⎧ VADD = Vf − Vi ⎨ ⎩ VADD = 600 − 150 12 , mol 12 , mol VADD = 450mL 2,4 mol → no de partículas de K+ e CA– em solução 2+ Resposta correta: E – CaCA2 Ca + 2CA x mol xmol 2 . xmol 3. I. Realizamos a mistura das soluções 3 . xmol → n de partículas de 2+ – Ca e CA em solução o m1 . v1 + m2v 2 ⇒ v1 + v 2 1,75 M = Para que as soluções tenham efeitos coligativos iguais e número de partículas de KCA = número de partículas de CaCA2, logo: II. Realizamos a diluição: . v = F . vF 2,4mol = 3 . xmol ⇒ x = 0,8mol de CaCA2 Resposta correta: D 1,75 . 2000 = 15. I. 1 ano/365 dias 1 dia x consome 1M . 500 mL + 2 M .1500 mL = 2000 mL F 500L de H2O ⇒ x = 182500L de H2O F . 2500 = 1,4 M Resposta correta: B PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2 7 4. COMENTÁRIOS – ATIVIDADES PROPOSTAS KCA → K + CA (v = 150mL) 4,0M 4,0M 4,0M + – 1. v = 1 1 2 . v2 + [K ] mf = 0,4mol/L . 1,2L = 16mol/L . v2 m1v1 + m2v2 vf v2 = 0,03L do ácido concentrado 4 .150 + 6. 350 mf = 500 mf = 5,4mol/L Retira-se 0,03L do ácido concentrado e completa o volume com água. K2SO4 → 2K + SO24− (v = 350mL) + 3,0M 6,0M Logo, o volume de água utilizado para preparar 1,22 de HCA 0,4M é: 3,0M ⎡SO2 − ⎤ ⎣ 4 ⎦ mi vi = mf vf VÁGUA = 1,2 – 0,03 3 . 350 = mf . 500 VÁGUA = 1,17L mf = 2,1mol/L Resposta correta: E Resposta correta: C 5. 2. Seja a reação de neutralização: τ . mf = τfmf 2HCA + Ca(OH)2 → CaCA2 + 2 H2O 0,07 . 150 = 0,03 . mf Cálculo do número de mols do HCA: mf = 350mL nHCA = mHCA × V(L)HCA Para calcular a quantidade de água adicionada, fazemos o cálculo: mÁGUA = mf – mi nHCA = 0,2mol/L × 0,2L nHCA = 0,04mol mÁGUA = 350 – 150 Pela estequiometria temos: 2mol HCA → 1mol Ca(OH)2 0,04mol HCA mÁGUA = 200mL x Resposta correta: C x = 0,02mol de Ca(OH)2 necessários para neutralizar o ácido. 3. τ . mi = τ . mf Cálculo da concentração molar: 0,8 . 1000 = 95 . mf n Ca(OH)2 = V(L) Ca(OH)2 = mf = 1600mL mÁGUA = mf – mi 0,02mol ⇒ 0,05L = 1600 – 1000 mCa(OH) = 0,4mol/L mÁGUA = 600mL 2 Resposta correta: C Resposta correta: C 8 PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2 4. ’v’ = 2 mol/L . 50mL = m” . 1000mL V = 100mL - m1v1 + m2v2 0,1 . 100 + 0,2 . 100 ⇒ ⇒ vf 200 mf = MgCA2 → Mg + 2CA 2+ – Mg + 2 CA 0,1M 0,2M [CA ] ” = 0,1mol/mL 0,1mol/L 2+ MgCA2 0,1M ’ . v” – mf = 0,15M – 0,1mol/L [CA ] = 2 . 0,1mol/L Resposta correta: E – [CA ] = 0,2mol/L 8. Resposta correta: B KCA → K + CA (v = 150mL) 4,0M 4,0M 4,0M + 5. Vf = 800 – 600 Vf = 200mL Vi = f Vf i 0,02 . 800 = f – + [K ] m1v1 + m2v2 vf mf = f 4 .150 + 6. 350 500 mf = 5,4mol/L . 200 mf = = 0,08 ∴ –2 8,0 x 10 = mol/L K2SO4 → 2K + SO24− (v = 350mL) + Resposta correta: B 3,0M Se o volume de sangue de uma pessoa adulta é de 6L então a massa de álcool fatal para essa pessoa é: ⎡SO2 − ⎤ ⎣ 4 ⎦ mi vi = mf vf 6. 0,0070 x 1mL 6000mL x = 42g 3,0M 3 . 350 = mf . 500 mf = 2,1mol/L E a massa de intoxicação por etanol, no sangue é de: 0,0030 1mL x 6000mL x = 18g Resposta correta: C 9. Cf = C1v1 + C2v 2 vf 24.200 + 2,08 . 1300 1500 Cf = 5 g/L Como a diferença em gramas entre a dose fatal e a dose de intoxicação é de 42 g – 18 g = 24 g, se 24 g de etanol corresponde a um volume de 30 mL, então a diferença em volume de uísque correspondente à diferença entre a intoxicação e a dose fatal é: 30mL x 6,0M Cf = Lei da diluição: C1v1 = C2v2 40% 100% x = 75mL 5 . 1500 = C2 . 2500 C2 = 3,0g/L Resposta correta: D Resposta correta: C 7. KCA 0,1M + – K + CA 0,1M 0,1M V = 100mL 10. KCA → K + CA v = 10mL MgCA2 → Mg + 2CA v = 10mL + Vf = 200mL 1M + [k ] 0,1 . 100 = mf . 200 mf = 0,05M – 1M 1M vf = 100 mL 0,5M – 1.10 + 1.10 100 mf = 0,2mol/L 0,1 . 100 = mf . 200 mf = 0,05M 1M [Mg ] mf = [Mg ] 0,5M – 2+ [CA ] 2+ 2+ 0,5 . 10 = mf . 100 mf = 0,05mol/L Resposta correta: B PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2 9 15. 11. nAg+ = nSCN− (no ponto de equivalência) ↓ Ag+ KOH KOH KOH Ag+ = mSCN− . VSCN− ⇒ Ag+ v1 = 600mL v2 = ? M1 = 0,25mol/L M2 = 1,5mol/L v3 = v1 + v2 = 0,15 . 0,042 ⇒ 108 M3 = 1,2mol/L Ag+ M3V3 = M1V1 + M2V2 1,2 (600 + V2) = 0,25 . 600 + 1,5 . V2 720 + 1.2 V2 = 150 + 1,5 . V2 570 = 0,3V2 V2 = 1900ML V2 = 1,9L = 0,6804g Logo: 0,8g 0,6804g 100% x x = 85,05% Resposta correta: E Resposta correta: 85,05% 12. m v + m2v2 mfc = 1 1 vf *v1 = v2 = 100mL 1.100 + 2.100 200 mfc = 1,5mol/L mfc = À solução C foram adicionados 200mL de água, resultando na solução D, que, por estar diluída, possui concentração menor que 1,5mol/L. Resposta correta: D 13. τi% . vi = τf % . vf 25 . x = 7,5 . 10 x = 3L Logo: vf = vi + vH2O ⇒ vH2O = vf – vi = 10 – 3L = 7L Resposta correta: B 14. Reação: 1H2SO4 + 2NaOH → Na2SO4 + H2O Pela estequiometria no P.E., temos: 1. nNaOH = 2 . nH2SO4 nNaOH = 2 ( H2SO4 . VH2SO4 ) ⇒ ⇒ 0,5mol = 2 . (1mol/L . VH2SO4 ) 0,5 = 2 . VH2SO4 VH2SO4 = 0,25L CML-28/11/08 Resol_Química 2_CV/Rev.:Juliana Resposta correta: E 10 PRÉ-VESTIBULAR | VOLUME 1 | QUÍMICA 2
Download