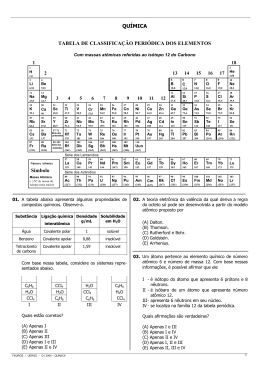
QUÍMICA AVALIAÇÃO Avaliação da unidade I Pontuação: 7,5 pontos 2 QUÍMICA AVALIAÇÃO QUESTÃO 01 ( 1 ponto) Foram realizados dois experimentos. 1º - Em um copo com cerca de 200 mL de água, foi adicionada uma colher pequena de cloreto de sódio (NaCl), o sal de cozinha. 2º- Em um copo com cerca de 200 mL de água, foi adicionada uma pequena colher de açúcar. 3 QUÍMICA AVALIAÇÃO Marque a alternativa que indica corretamente o solvente de cada experimento. a) O cloreto de sódio e o açúcar b) A água e o cloreto de sódio c) A água nos dois casos d) A água e o açúcar 4 QUÍMICA AVALIAÇÃO QUESTÃO 02 ( 1 ponto) Observe a tabela de solubilidade abaixo para várias substâncias: Solubilidade de diferentes substâncias em 100 gramas de água a 20°C Gramas que podem ser Substâncias dissolvidos Sal comum (NaCl) 36,0 Açúcar (C12H22O11) 33,0 Cloreto de potássio (KCl) 7,4 5 QUÍMICA AVALIAÇÃO Classifique o tipo de solução (saturada, insaturada ou supersaturada) que obteremos se adicionarmos essas massas de soluto a 100 g de água, à temperatura de 20°C: 50 g de NaCℓ; 33,0 g de açúcar; 5,0 g de KCℓ. 6 QUÍMICA AVALIAÇÃO a) Saturada, supersaturada, insaturada. b) Saturada, insaturada, saturada. c) Insaturada, saturada, supersaturada. d) Supersaturada, insaturada, saturada. e) Saturada, saturada, insaturada. 7 QUÍMICA AVALIAÇÃO QUESTÃO 03 ( 1 ponto) Considere este gráfico: 8 QUÍMICA AVALIAÇÃO As soluções indicadas pelos pontos A, B e C podem ser classificadas quanto à saturação, respectivamente, como: a) Insaturada, saturada com corpo de chão, supersaturada. b) Saturada, insaturada, saturada com corpo de chão. c) Saturada com corpo de chão, saturada, insaturada. d) Supersaturada, insaturada, saturada. e) Saturada com corpo de chão, supersaturada, insaturada. 9 QUÍMICA AVALIAÇÃO QUESTÃO 04 ( 1 ponto) (MED – ITAJUBA) Quantos gramas de Na3PO4 (MM = 164) são necessárias para preparar 5,0 litros de uma solução 3 molar? a) 10,9 d) 273 b) 65,6 e) 2460 c) 98,4 10 QUÍMICA AVALIAÇÃO QUESTÃO 05 ( 1 ponto) Uma massa de 40g de NaOH são dissolvidos em 160g de água. A porcentagem, massa, NaOH presentes nesta solução é de: a) 20% b) 40% c) 10% d) 80% e) 100% 11 QUÍMICA AVALIAÇÃO QUESTÃO 06 ( 1 ponto) (FUC-MT) Na diluição de uma solução, podemos afirmar que: a) A massa do solvente permanece constante. b) A massa do soluto permanece constante. c) O volume da solução permanece constante. d) A molalidade da solução permanece constante. e) A molaridade da solução permanece constante. 12 QUÍMICA AVALIAÇÃO QUESTÃO 07 ( 1,5 pontos ) Dado o esquema abaixo: 13 QUÍMICA AVALIAÇÃO Julgue os itens, colocando verdadeiro ou falso. ( ) No esquema I, a massa do soluto permanece constante. ( ) No esquema II, a concentração, em mol/L, do frasco 3 é a média aritmética das concentrações c mol/L e d mol/L. ( ) A concentração a mol/L será maior que b mol/L, para o esquema I. 14 QUÍMICA AVALIAÇÃO ( ) O esquema I representa a diluição de uma solução e o esquema II, a mistura de soluções de solutos e solventes iguais. 15
Baixar