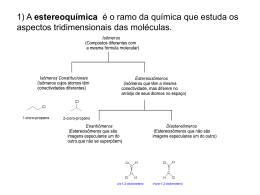
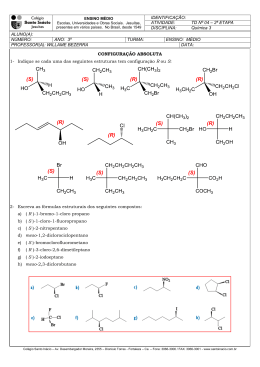
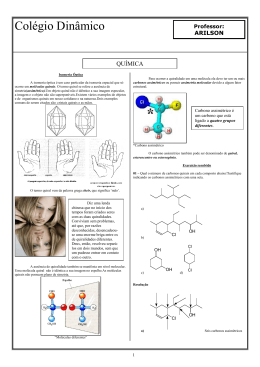
Moléculas Quirais: as novidades da indústria farmacêutica que estão deixando os genéricos obsoletos! Um mercado que, em 2000, irá ultrapassar a barreira dos $100 bilhões. As drogas quirais já são uma realidade na indústria farmacêutica. Algumas delas são novidades completas, mas muitas são apenas enantiômeros puros obtidos de racematos que, hoje, são vendidas como genéricos. A indústria farmacêutica já está liberando no mercado produtos resultantes dos mais avançados centros de pesquisa, tornando os atuais genéricos uma coisa do passado: a estereoseletividade já é uma tecnologia dominada por grande parte dos maiores laboratórios. Tudo graças ao trabalho de pesquisa de muitos químicos, que há tempos desenvolvem rotas sintéticas estereoseletivas e métodos de separação enantiomérica, hoje aplicados na indústria. O fármaco conhecido como clorazepate era vendido, até 1998, por $11 cada frasco com 500 tabletes do racemato. A empresa italiana Profarmaco passou a produzir um enantiômero puro do mesmo fármaco e, hoje, esta droga é vendida por $377 por frasco. O mesmo aconteceu com o lorazepam, cujo racemato é vendida por $7,30 e o enantiômero puro a $191,50, nos EUA. Ambos os racematos já possuem patente por quase 20 anos, ou seja, logo irão para os genéricos. Os enantiômeros puros, por outro lado, acabaram de ser lançados no mercado, e os preços continuaram exorbitantes por muito tempo. Por enquanto, barato só o racêmico - como, na maioria das vezes, apenas um dos enantiômeros tem atividade biológica, continuaremos a engolir boa parte de B.O. juntamente com a substância ativa... Em alguns casos, o racemato pode provocar efeitos colaterais não observados com apenas um dos enantiômeros - é o caso das glitazonas, drogas utilizadas no tratamento da diabetes tipo II. O fármaco consiste da mistura de 4 diasteroisômeros da substância. Uma pequena porcentagem dos pacientes que tomam estas drogas acabam sendo acometidos de uma grave lesão hepática, podendo levar à morte. Estudos mostraram que apenas 2 dos quatro diasteroisômeros provocam esta lesão. O laboratório Parke-Davis já está produzindo uma nova versão da droga, sem os isômeros "ruins". O preço, obviamente, é bem maior. A indústria se vale de métodos descobertos na pesquisa acadêmica. Em qualquer jornal de química orgânica dos últimos 10 anos é possível se encontrar artigos relatando alguma rota sintética estereoseletiva. Além de aprimorar os métodos de síntese, as técnicas para separação de estereoisômeros também estão sendo aperfeiçoadas ano a ano, graças ao trabalho incessante de pesquisadores do mundo inteiro. Atividade Biológica Os estereoisômeros podem apresentar atividades biológicas diferentes: um deles pode ser muito ativo, e o outro inativo ou fracamente ativo. As ilustrações abaixo mostram como a orientação espacial de uma molécula é importante na interação com o seu receptor biológico. Neste caso, somente o primeiro enantiômero possui a configuração correta para o receptor: quando os grupos A estão em trans a molécula não "encaixa" com o sítio receptor. Neste caso, o grupo C do segundo enantiômero está em uma posição desfavorável à interação com o receptor. O que é uma molécula quiral? A palavra "quiral" se refere à alusão destas moléculas com as mãos (quiromancia, lembra?). Olhe para suas mãos: a direita e esquerda são muito similares, mas não são idênticas. Por mais que você se esforce, não consegue sobrepô-las - não há como colocar uma sobre a outra, perfeitamente - os dedões ficam em lados opostos!. O mesmo acontece com as moléculas quirais moléculas não superponíveis com sua imagem no espelho. Um centro de quiralidade é definido como um átomo que possui um conjunto de ligantes cujo arranjo espacial não é superponível com sua imagem no espelho. Em compostos orgânicos, é um carbono de hibridização sp3 que está ligado a quatro átomos ou grupos diferentes. A molécula 2-bromobutano é um exemplo. O carbono ligado ao bromo (C2) é um centro de quiralidade, pois está ligado a quatro grupos diferentes: A mistura formada por quantidades equimolares dos estereoisômeros é chamada de racemato. A maior parte das rotas sintéticas da química orgânica leva à produção de racematos, e não somente de um dos enantiômeros. Se este for o objetivo, a rota é sempre mais complicada e demanda mais tecnologia. Enantiômeros são moléculas que são imagens no espelho uma da outra e não são superponíveis. Diasteroisômeros são estereoisômeros que, ao contrário dos enantiômeros, não possuem uma relação objeto-imagem especular. Embora a diferença entre os enantiômeros pareça irrelevante, estes compostos podem apresentar atividade biológica completamente diferentes. A maioria das moléculas presentes na estrutura dos organismos vivos são quirais. Exemplos de sínteses estereoseletivas As técnicas para a síntese enantioseletiva são recentes. Um professor de química orgânica da Stockholm University, combinou a ação da enzima lipase e um catalisador de metal de transição, para a produção de um éster com pureza enantiomérica de 100%. No processo, a enzima lipase catalisa a acilação de um dos enantiômeros com muito mais rapidez do que do outro. O catalisador racemiza continuamente o enantiômero do álcool não desejado, que novamente é acilado pela enzima. No final do processo, obtém-se apenas o enantiômero desejado. Os professores de química orgânica E. J. Corey, da Harvard University, e Amir Hoveyda, do Boston College, chegaram, independentemente, a sínteses de alfa-amino ácidos com pureza enantiomérica. Corey utilizou uma base de Schiff do benzaldeído com benzidrilamina. Esta base, ao reagir com ácido cianídrico na presença de um catalisador, resulta na (R)-fenilglicina, com uma excesso enantiomérico >96%. Na síntese feita por Hoveyda, o substrato é a base de Schiff do p-anisaldeído e benzidrilamina, que reage com cianeto de trimetilsilano, resultando no amino nitrila correspondente ao (S)-pmetoxifenilglicina, com excesso enantiomérico >99%. Estereoisômeros e a Vida A maioria dos compostos no organismos vivos são quirais, incluindo o DNA, enzimas, anticorpos e hormônios. Cada enantiômero tem características diferentes. O limoneno é um exemplo clássico: enquanto que a forma R apresenta o odor de laranjas, a forma S apresenta o odor de limão! R-(+)limoneno S-(-)-limoneno laranja limão A atividade de fármacos também depende da quiralidade: a talidomida, por exemplo, causou a má formação de milhares de fetos, quando administrada, na década de 1960, a várias gestantes. Descobriu-se que apenas um dos enantiômeros, entretanto, causava a má formação congênita, enquanto que o outro não era prejudicial. O carbono marcado é um centro de quiralidade. Vários pesquisadores do Japão também estudam sínteses estereoseletivas. Na University of Tókio, Shibasaki, um químico professor, desenvolveu uma reação de condensação aldólica assimétrica direta. Sem passar pelo derivado enólico, com o uso de um catalisador que é um trímero de um sal de lítio-lantânio do binaftol. No exemplo, o bfenilpivalaldeído reage com metil etil cetona, resultando no produto aldólico assimétrico, com 94% de excesso enantiomérico. Shibasaki também obteve bons rendimentos e excesso enantiomérico a partir de ciclopentanona com vários aldeídos e de hexanal com várias cetonas. Outra síntese desenvolvida por Corey é a do (5S)trimetilsilil-2ciclohexenona. A síntese inicia com anisole, que é convertido ao trimetilsililciclohexenol. A assimetria é induzida por uma enzima lipase, que acetila um dos estereoisômeros preferencialmente em relação ao outro. A remoção do grupo acetila, oxidação do álcool resultante e isomerização da ligação dupla dá o produto desejado. Este mesmo produto é vendido comercialmente pela Daiso Co., de Osaka, no Japão. O método, entretanto, é diferente, e foi desenvolvido por Fumie Sato, do Tokyo Institute of Technology. Sato adiciona mais dois carbonos à molécula inicial, com um reagente de Grignard vinílico. Após converter o grupo hidroxila a um tributilsililóxi, ele cicliza esta molécula, formando o (5S)tributillsililóxi-2-ciclohexenona. Fonte: QMCWEB
Baixar