Universidade do Vale do Paraíba
Instituto de Pesquisa e Desenvolvimento
Universidade Comunitária Regional de Chapecó
Programa de Mestrado Interinstitucional em Engenharia Biomédica
TÁDIA FERNANDA LAPINSKI
“FOTOSSENSIBILIZADORES NATURAIS EM
TERAPIA FOTODINÂMICA ANTIMICROBIANA:
DESENVOLVIMENTO DE CREME E GEL CREME CONTENDO
EXTRATOS DE Alternanthera brasiliana (AMARANTHACEAE)”
São José dos Campos, SP
2008
TÁDIA FERNANDA LAPINSKI
“FOTOSSENSIBILIZADORES NATURAIS EM
TERAPIA FOTODINÂMICA ANTIMICROBIANA:
DESENVOLVIMENTO DE CREME E GEL CREME CONTENDO
EXTRATOS DE Alternanthera brasiliana (AMARANTHACEAE)”
Dissertação apresentada no Programa de Pósgraduação
em
Engenharia
Biomédica,
como
complementação dos créditos necessários para
obtenção do título de Mestre em Engenharia
Biomédica
Orientador: Prof. Dr. Marcos José Salvador
Orientador: Prof. Dr. Egberto Munin
São José dos Campos
2008
1999í
TádiaFernanda
Lapinski,
naturais em terapia fotodinâmicaantimicrobiana:
Fotossensibilizadores
de creme e gel creme contendoextratosde Alternanthera
desenvolvimento
ProÍ. Dr.
/ Ìádia FernandaLapinski;Orìentadores
brasí\íana(Amaranthaceae)
MaÍcos José Salvador,Prof. Dr. Egberto Munìn. São José dos campos,
Chapecó,2008.
1 discolaser:color.
Dissertaçãoapresentadaao Programade Pós-Graduaçãoem Engenharia
da Universidade
do Vale
Biomédicado Institutode Pesquisae Desenvolvimento
MinterUnivap/ Unochapeó.2008.
do Paraíba,
modalìdade
farmacêutìcas
7. Alternantherabrasiliana2. Amaranthaceae3. Formulações
(PDT) s.Produtosnaturaìs
tópicas4. TerapiaÍotodinâmicaantimicrobiana
lll Título
Il. Munin,Egberto,
orientador.
MafcosJosé,orientador
l. Salvador,
C D U 6: 1 5 . 8 4 9
para fins acadêmicose científicos,a reproduçãototal ou
Autorizo,exclusivamente
parcialdesta dissertação,por processosfotocopiadores
ou trânsmissãoeletrônica,
desdequecitadaa fontecorretamente.
Assinatura
daaluna:
írar* ít'"**ao"
o a t a .1 8 i C 8 / l - i - O E
t"y"^Ll'
TÁDIA FERNANDALAPINSKI
'oForossENsrBúIz\DoRxs N,{rrÌRA{s EM TER{PLAForoDINAMrcA
ANTIMICROBIANA: DESENVOL\.IMENTO DE CRENIE E GEL CRNME CONTENDO
EXTIL{TOS DE,4'78ÌJV,4 NTITEM BMS ILIANÁ (ÁMARANTIIACEAE)''
Dissertaçãoaprcvaalacomo requisito par0ial à obtençãodo glau de Mestrc em Engenharia
em EngenhariaBiornedica,do Instituto de Pesqúsa
Biomédica,do Pro$ama de Pós-Graduação
SãoJosédosCam?os,SP,pelasegunte
do Valedo Paraíba,
daUniversidade
e Deservolvimento
bancaexaúinadota:
Prof. Dra.STELLA REGINA ZAMUNER (UNIV
Prof.Dr. ECBERTO\4U\lN (1,\IVAP
Prol Dr. MARCOS JOSESALVADOR (U
Prof. Dra. CRISTIANE YUMI KOGA-ITO (tll\lEs
Prof. Dr. MarcosTadçuTavaresPacheco
Diretor do IP&D Univap
28 deagostode2008.
SãoJosédosCampos,
DEDICATÓRIA
Aos meus amados pais, Cleusa e Alvanir, pelo apoio e encorajamento,
fundamentais em todas as etapas da minha vida e por compreenderem minha
ausência, dada importância desta etapa.
Ao meu namorado, Silvio, pessoa cara ao meu coração, pelo carinho,
incentivo e por partilhar minha história.
Ao meu avô paterno, Alexandre Lapinski, que me dá o prazer de sua
convivência, sempre preocupado em se fazer presente em minha caminhada.
A minha avó paterna (in memorian), Maria Montagna Lapinski, por
permanecer viva em meu coração.
Ao meu avô materno (in memórian), Osvaldo Valentin Castanho, por encher
de música minha infância.
A minha avó materna, Ambrosina Castanho, por conceber e educar com tanto
carinho minha mãe.
A minha madrinha, Carmen Lapinski, por seu amor e atenção, por tanto
doar-se, sem nada pedir em troca.
A vocês, todo meu amor!
AGRADECIMENTO
A Deus, agradeço, enquanto viver, pela força, graça, segurança, paz e saúde.
Pela oportunidade de recomeçar todos os dias, errando, na tentativa de acertar.
Ao meu orientador professor, Dr. Marcos José Salvador, pelo apoio, incentivo
e oportunidade de trabalhar, sendo um exemplo de humano, pesquisador e
professor. Obrigado pela oportunidade, confiança depositada, pela paciência e,
especialmente, pela amizade. Minha admiração e respeito!
Ao meu orientador, professor Dr. Egberto Munin, pela colaboração e amizade
durante as etapas desta dissertação. Obrigada pela presteza, atenção e paciência.
À professora Dra. Stella Zamuner, pelo carinho, dedicação e auxílio, pois
mesmo com tantas tarefas, reservou tempo para colaborar com nossa pesquisa.
Aos amigos Guilherme Theodoro, Ricardo Belo e à professora Ms. Sonia
Khouri do Laboratório de Produtos Naturais e Bioensaios e de Microbiologia da
UNIVAP, pela cooperação amizade e aprendizado durante essa jornada.
Ao Engenheiro Leandro Procópio Alves, pelo auxílio técnico na obtenção dos
espectros de absorção.
Aos professores do IP&D, pela oportunidade, disposição em ajudar e elucidar
dúvidas.
À
bibliotecária do IP&D, Rúbia Gravito de Carvalho Gomes, meu
agradecimento pelo carinho e auxílio imensurável.
À secretária do IP&D, Valéria Maeda, pela atenção e cuidado com a
documentação da dissertação e pela presteza durante todas as passagens por São
José dos Campos.
Aos meus pais, Cleusa e Alvanir Lapinski, que me proporcionaram a vida com
tanta sabedoria e amor. A quem devo tudo o que sou! Meu amor e eterna gratidão
por toda preocupação, cuidado e pela presença diária, mesmo que em pensamento.
Exemplos de luta e dignidade que me deram a chance de dividir a existência com
dois irmãos, lindos, Tiago Alexandre e Thainá Valentina, sem os quais a vida não
seria tão bela. Minha razão de existir reside nesse alicerce, minha família!
Ao meu namorado, Silvio Antonio Teston, pessoa muito especial, com quem
dividi meus desesperos e satisfações durante a realização desse trabalho. Alguém
que esteve sempre presente e que não mediu esforços para me fazer feliz, mesmo
quando as coisas não davam certo. Você faz parte de mim! Amo você!
Ao meu avô, Alexandre Lapinski, e a minha madrinha Carmen Lapinski, que
com carinho e dedicação auxiliaram a mim e minha família nos momentos de
dificuldades.
Aos demais familiares que sempre fizeram o possível para auxiliar nos
desafios do dia-a-dia.
A minha eterna professora, amiga e colega de mestrado, Silvana Muraro
Wildner, pela compreensão nos momentos de ausência e pelo auxílio constante.
À professora Dra. Samara Leite, que, com seu incentivo, deu forças ao início
do nosso trabalho. Obrigada pela amizade!
As minhas colegas técnicas dos laboratórios do CCS da Unochapecó,
especialmente, Daniela Moraes Pinto, Ionara Bertotti Valdameri, Lucile Francescatto
e Liliane Santos Wanderlei, e, às monitoras do laboratório de anatomia humana,
Marina Petzen Vieira dos Santos e Ana Paula Dalmagro, por auxiliarem nos
momentos em que precisei me ausentar. Obrigada pela amizade e compreensão.
Aos professores Dr. Alexandre Meneghello Fuentefria e Sandro Chander da
Silva, por me permitirem cumprir o estágio de docência sob sua supervisão e, além
disso, compartilhar seu conhecimento das áreas de microbiologia e anatomia,
respectivamente. Obrigada pela compreensão e amizade! Ao professor Ms. Luís
Flavio Souza de Oliveira minha gratidão pelas sugestões durante a realização deste
trabalho.
A minha grande amiga e colega farmacêutica da Farmácia Escola da
Unochapecó, Candida Nissola, pela fundamental ajuda durante a manipulação das
formulações tópicas analisadas nesta pesquisa.
À Adriana Gasparetto, colega de mestrado que me presenteou com bons
momentos e risadas durante os períodos mais angustiantes da realização das
nossas pesquisas.
À Fabiane Wouters, companheira de longas horas de viagem a São José dos
Campos. Obrigada pela companhia e pela amizade.
Aos demais colegas do mestrado pela cumplicidade e companheirismo e por
terem proporcionado momentos de alegria e descontração, muito importantes em
determinados momentos deste trabalho.
À FAPESP pelo apoio financeiro.
A todos aqueles que estão, estiveram e continuarão presentes em minha vida,
nos momentos de tristeza e felicidade e que, assim com o eu, esperam que estes
últimos ocupem a maior parte de nossa existência.
Muito obrigada!
Certeza
De tudo ficaram três coisas:
A certeza de que estamos sempre começando...
A certeza de que precisamos continuar...
A certeza de que seremos interrompidos antes de terminar.
Portanto, devemos:
Fazer da interrupção um caminho novo...
Da queda, um passo de dança...
Do medo, uma escada...
Do sonho, uma ponte...
Da procura, um encontro!
Fernando Sabino
“FOTOSSENSIBILIZADORES NATURAIS EM
TERAPIA FOTODINÂMICA ANTIMICROBIANA:
DESENVOLVIMENTO DE CREME E GEL CREME CONTENDO EXTRATOS DE
Alternanthera brasiliana (AMARANTHACEAE )”
RESUMO
A espécie Alternanthera brasiliana (Gomphreneae, Amaranthaceae) é utilizada na
medicina tradicional brasileira para o tratamento de infecções e é conhecida
popularmente por penicilina e terramicina. Neste estudo procedeu-se o preparo de
extratos e formulações farmacêuticas tópicas (creme e gel creme) contendo extratos
de A. brasiliana e a avaliação do efeito destas preparações farmacêuticas como
fotossensibilizadores naturais em terapia fotodinâmica (PDT) antimicrobiana. Foram
obtidos extratos em hexano e etanol de A. brasiliana planta total, que apresentaram
bandas de absorção entre 650 e 700nm, compatível com o comprimento de onda
utilizado em terapia fotodinâmica (685 nm). Como microrganismos indicadores na
avaliação da atividade fotodinâmica antimicrobiana foram utilizadas quatro cepas
padrão: Staphylococcus aureus ATCC 14458, Staphylococcus epidermidis ATCC
12228 e Candida dubliniensis ATCC 778157 e ATCC 777. Para estes extratos
bioativos (2,5 ou 25 mg de extrato/mL) na PDT antimicrobiana, procedeu-se o
desenvolvimento de preparações farmacêuticas tópicas (creme e gel creme), as
quais apresentaram efeito antimicrobiano na concentração de 5 mg de creme/mL
(equivalente a 0,25mg de extrato/mL) em associação com a radiação laser. As
formulações obtidas otimizaram a atividade antimicrobiana dos extratos frente a
alguns dos microrganismos indicadores quando associados à formulação
farmacêutica tópica, observando-se efeito em PDT antimicrobiana para as
formulações em concentração 100 vezes menor do que a observada para o extrato
bruto nas mesmas condições experimentais. Os fitocosméticos desenvolvidos
(creme e gel creme) apresentaram pH= 5,5, compatível com o pH de preparações
farmacêuticas que são veiculadas na pele humana. Em ensaio de estabilidade por
centrifugação os extratos hexânico e etanólico apresentaram-se instáveis com
separação de fases e as formulações farmacêuticas desenvolvidas minimizaram
esta instabilidade uma vez que não se visualizou separação de fases para as
formulações creme e gel creme desenvolvidas. Os resultados sugerem redução no
crescimento microbiano em S. aureus, S. epidermidis e C. dubliniensis quando
tratados com os extratos hexânico e etanólico ou com as formulações creme e gel
creme contendo os extratos de A. brasiliana e irradiados (685 nm) com o laser de
baixa potência diodo InGaAIP. Pode-se concluir que as preparações farmacêuticas
(extratos, creme e gel creme) conte ndo A. brasiliana apresentaram fotoatividade
frente a microrganismos.
Palavras chaves: Fotossensibilizadores, terapia fotodinâmica antimicrobiana,
extratos, formulações farmacêuticas, Alternanthera brasiliana, Amaranthaceae.
“NATURAL PHOTOSENSITIZERS IN ANTIMICROBIAL PHOTODYNAMIC
THERAPY: DEVELOPMENT OF CREAM
AND GEL CREAM CONTAINING CRUDE EXTRACTS OF
Alternanthera brasiliana (AMARANTHACEAE )”
ABSTRACT
Alternanthera brasiliana (Gomphreneae, Amaranthaceae) is used in the Brazilian
traditional folk medicine for the treatment of infections and is known popularly by
penicillin and terramicin. In this study proceeded the preparation of crude extracts
and topical pharmaceutical formulations (cream and gel cream) containing extracts of
A. brasiliana and the evaluation of the effect of these pharmaceutical preparations as
a photosensitizer in antimicrobial photodynamic therapy (PDT). The hexanic and
ethanolic crude extracts of the whole plants of A. brasiliana presented bands of
absorption in 650 and 700nm, which are compatible with region of work of the PDT.
In the susceptibility tests were used standard strains of Staphylococcus aures ATCC
14458, Staphylococcus epidermidis ATCC 12228, Candida dubliniensis ATCC
778157 and ATCC 777. The results indicate that it was possible to observe reduction
in the microbial growth when the microorganism tests had been dealt with hexanic
and ethanolic extracts (2,5 or 25 mg/mL) in association with laser radiation. For these
bioactive extracts the development of topical pharmaceutical preparations (cream
and gel cream) was proceeded and these pharmaceutical preparations presented
antimicrobial effect (at 5 mg of cream or gel cream/mL = 0.25mg of extracts/mL) in
association with the laser radiation. The antimicrobial PDT effects against S. aureus,
S. epidermidis and C. dubliniensis of the topical pharmaceutical formulations
containing the extracts was optimized and was verified activity in a concentration 100
times smaller, as compared to the crude extract in the same experimental conditions.
The developed phytocosmetics (cream and gel cream) had presented pH= 5.5,
compatible to pH of common pharmaceutical preparations for use in the human skin.
In assay of stability, only for gel cream containing the bioactive extracts it was
possible to visualize separation of phases. Reduction in the microbial growth in S.
aureus, S. epidermidis and C. dubliniensis were verified when treated with the
hexanic and etanolic extracts or with the formulations cream and gel cream
containing A. brasiliana extracts and irradiated (685 nm) with the low power laser of
InGaAIP. In conclusion these results suggest that hexanic and ethanolic extracts of
A. brasiliana and the cream and gel cream pharmaceutical formulations containing
these bioative extracts can be used as a photosensitizer in antimicrobial PDT.
Keywords: Natural photosensitizers, antimicrobial photodynamic therapy, topical
pharmaceutical formulation, Alternanthera brasiliana, Amaranthaceae,
LISTA DE FIGURAS
Figura 1: Alternanthera brasiliana (L.) O. Kuntze ............................................................ 22
Figura 2: Esquema da preparação dos extratos brutos extraídos em solventes
orgânicos. ............................................................................................................................... 60
Figura 3: Amostras analisadas por varredura na região visível do espectro
eletromagnético ..................................................................................................................... 67
Figura 4: Equipamentos empregados nas medidas espectrofotométricas, na região
visível do espectro eletromagnético................................................................................... 68
Figura 5: Equipamento laser Photon Lase®...................................................................... 72
Figura 6: Ilustração da capela de fluxo laminar e aparato de irradiação ..................... 73
Figura 7: Embalagem final e rótulo das bases creme e gel creme............................... 76
Figura 8: Formulação 2 – creme contendo extrato AbptE 5% e formulação 8 – gel
creme contendo extrato AbptE 5% submetidas ao ensaio de centrifugação.............. 77
Figura 9: Formulação 5 – creme contendo extrato AbptH 5% e formulação 11 – gel
creme contendo extrato AbptH 5% submetidas ao ensaio de centrifugação ............. 78
Figura 10: Bases creme e gel creme após teste de centrifugação a 2800 rpm. ........ 78
Figura 11: Creme contendo 5% do extrato AbptE, gel creme contendo 5% de extrato
AbptE e extrato AbptE após teste de centrifugação a 2800 rpm. A seta indica o
precipitado decorrente da separação de fases. ............................................................... 79
Figura 12: Creme contendo 5% do extrato AbptH, gel creme contendo 5% de extrato
AbptH e extrato AbptH após teste de centrifugação a 2800 rpm. A seta indica o
precipitado decorrente da separação de fases. ............................................................... 79
Figura 13: Espectroscopia de absorção: perfil dos extratos AbptE, AbptH, das
formulações creme contendo os extratos AbptE ou AbptH, gel creme contendo os
extratos AbptE ou AbptH, do controle positivo da PDT Azul de metileno, do controle
negativo solvente (Água:Propilenoglicol, 5:95, v/v) e do controle negativo das
formulações sem extratos (creme e gel creme)............................................................... 80
Figura 14: Espectroscopia de absorção: perfil das formulações creme e gel creme
contendo os extratos AbptE ou AbptH. ............................................................................. 81
Figura 15: Número de unidades formadoras de colônias por mililitro (UFC/mL) das
cepas Staphylococcus aureus ATCC 14458 tratadas com os extratos de
Alternanthera brasiliana (AbptH ou AbptE) e com as formulações Creme contendo
AbptH (CH) ou AbptE (CE) e Gel creme contendo AbptH (GCH) ou AbptE (GCE), na
presença (L+) e ausência (L-) de irradiação com laser diodo InGaAlP. Estatística: * ?
**, Teste de Tukey, P<0,05. ................................................................................................ 88
Figura 16: Número de unidades formadoras de colônias por mililitro (UFC/mL) das
cepas Staphylococcus epidermidis ATCC 12228 tratadas com os extratos de
Alternanthera brasiliana (AbptH e AbptE) e com Gel creme contendo AbptH (GCH)
na presença (L+) e ausência (L-) de irradiação com laser diodo InGaAlP. Estatística:
* ? **, Teste de Tukey, P<0,05. .......................................................................................... 89
Figura 17: Número de unidades formadoras de colônias por mililitro (UFC/mL) das
cepas Candida dubliniensis ATCC 777 tratadas com o extrato etanólico (AbptE) de
Alternanthera brasiliana e com o Gel creme contendo extrato hexânico (GCH) na
presença (L+) e ausência (L-) de irradiação com laser diodo InGaAlP. Estatística: * ?
**, Teste de Tukey, P<0,05. ................................................................................................ 89
Figura 18: Número de unidades formadoras de colônias por mililitro (UFC/mL) das
cepas Candida dubliniensis ATCC 778157 tratadas com os extratos de Alternanthera
brasiliana e com Gel creme contendo extrato AbptE (GCE) na presença (L+) e
ausência (L-) de irradiação com laser diodo InGaAlP. Estatística: * ? **, Teste de
Tukey, P<0,05. ...................................................................................................................... 90
LISTA DE TABELAS
Tabela 1: Composição percentual das formulações base Gel Creme e Creme (q.s.p.
30 g) ........................................................................................................................................ 63
Tabela 2: Composição das formulações farmacêuticas contendo extrato AbptE ou
AbptH de Alternanthera brasiliana ..................................................................................... 65
Tabela 3: Rendimento em massa dos extratos brutos obtidos de Alternanthera
brasiliana................................................................................................................................ 75
Tabela 4: Concentração Inibitória Mínima (CIM) dos extratos hexânico (AbptH) e
etanólico (AbptE) de Alternanthera brasiliana utilizando o método de microdiluição
em placas de 96 poços. ....................................................................................................... 82
Tabela 5: Resultados da contagem de microrganismos das amostras controles antes
e após a irradiação ............................................................................................................... 84
Tabela 6: Resultados da contagem de microrganismos das amostras teste antes e
após a irradiação................................................................................................................... 86
Tabela 7: Percentual de redução de unidades formadoras de colônias por mililitro
(UFC/mL) após irradiação com laser diodo InGaAlP e tratamento com os extratos de
Alternanthera brasiliana....................................................................................................... 87
Tabela 8: Percentual de redução de unidades formadoras de colônias por mililitro
(UFC/mL) após irradiação com laser diodo InGaAlP e tratamento com as
formulações creme e gel creme contendo extrato etanólico (AbptE) de Alternanthera
brasiliana................................................................................................................................ 87
Tabela 9: Percentual de redução de unidades formadoras de colônias por mililitro
(UFC/mL) após irradiação com laser diodo InGaAlP e tratamento com as
formulações creme e gel creme contendo extrato hexânico (AbptH) de Alternanthera
brasiliana................................................................................................................................ 88
LISTA DE ABREVIATURAS E SIGLAS
AbptH – Extrato hexânico de Alternanthera brasiliana (planta total)
AbptE – Extrato etanólico de Alternanthera brasiliana (planta total)
ALA – Ácido aminolevulínico
5-ALA – Ácido 5-aminolevulínico
AMP – Aminometilpropanol
AlSPc – Alumínio cloroftalocianina sulfonada
ASD – Ágar Saboraud Dextrose
BHT – Butilhidroxitolueno
Ca2+ – Íons cálcio
CaCl2 – Cloreto de cálcio
CIM – Concentração inibitória mínima
cm2 – centímetro ao quadrado
CV – coeficiente de variação
°C – Graus Celsius
DNA – Ácido desoxirribonucléico
g – grama
GaAlAs – Arseneto de Gálio e Alumínio
h – hora
He-Ne – Hélio Neônio
HIV – (do inglês Human Immunodeficiency Virus) Vírus da imunodeficiência humana
HP – Hematoporfirina
HpD – Hematoporfirina deri vada
HSV – Herpes simplex vírus
J – Joule
J/cm2 – Joules por centímetro ao quadrado
L- – não irradiado
L+ – irradiado
LPS – Lipopolissacarídeo
mg – miligrama
mg/Kg – miligrama por quilograma
mg/mL – miligramas por mililitro
MHb – Meio Muller Hinton
min – minuto
mL – mililitros
mm – Milímetro
MOPS – tampão ácido 3-[N-morfolino] propanosulfônico
mW – Miliwatts
mW/cm2 – miliwatts por centímetro ao quadrado
nm – nanômetro
PACT – (do inglês Photodynamic antimicrobial chemotherapy) Quimioterapia
fotodinâmica antimicrobiana
PDT – (do inglês Photodynamic therapy) Terapia fotodinâmica
pH – Potencial hidrogeniônico
pka – constante de dissociação
p/p – peso em peso
PpIX – Protoporfirina nove
ROS – (do inglês reactive oxygen species) Espécies reativas de oxigênio
rpm – rotações por minuto
RPMI 1640 – meio/caldo de cultura (Roswell Park Memorial Institute)
s – Segundo
TSb – (do inglês Tryptone Soy Broth) Caldo triptona de soja
UFC ou ufc – unidade formadora de colônia
UFC/mL ou ufc/mL – Unidades formadoras de colônia por mililitro
UI/mL – Unidades internacionais por mililitro
UV A – Ultravioleta A
v/v – volume em volume
W/cm2 – Watts por centímetro ao quadrado
µg/mL – microgramas por mililitro
µg – microgramas
µL – microlitros
? – comprimento de onda
SUMÁRIO
1
INTRODUÇÃO .............................................................................................................. 19
1.1
Considerações gerais sobre a família Amaranthaceae............................ 21
1.2
Considerações gerais sobre a espécie Alternanthera brasiliana.......... 22
1.3
Considerações gerais sobre formulações farmacêuticas ....................... 26
1.3.1
Formulações farmacêuticas semi-sólidas................................................. 27
1.3.2
Emulsões ........................................................................................................ 28
1.3.3
Incorporação de princípios ativos em emulsões...................................... 29
1.3.4
Conservação de emulsões .......................................................................... 29
1.3.5
Potencial hidrogeniônico (pH) ..................................................................... 30
1.3.6
Atividade dos cremes na pele ..................................................................... 30
1.3.7
Géis ................................................................................................................. 31
1.4
Considerações gerais sobre LASER, Terapia Fotodinâmica,
Fotossensibilizadores,
Terapia
fotodinâmica
antimicrobiana
e
microrganismos .............................................................................................................. 32
1.4.1
LASER............................................................................................................ 32
1.4.2
Terapia fotodinâmica (PDT) ........................................................................ 33
1.4.3
Fotossensibilizadores empregados em PDT............................................ 38
1.4.4
Terapia Fotodinâmica (PDT) Antimicrobiana ........................................... 43
1.4.5 Considerações gerais sobre os microrganismos empregados no estudo:
Staphylococcus aureus, Staphylococcus epidermidis e Candida dubliniensis... 53
2
OBJETIVOS ................................................................................................................... 58
3
MATERIAL E MÉTODOS ............................................................................................ 59
3.1
Coleta, classificação e obtenção do material vegetal .............................. 59
3.2
Preparação dos extratos brutos ..................................................................... 59
3.3
Elaboração de formulações farmacêuticas semi-sólidas para uso
tópico60
3.3.1
Procedimento geral de manipulação ......................................................... 61
3.3.2
Preparação da base creme (formulação controle – sem extrato) ......... 61
3.3.3
Preparação da base gel creme base (formulação controle – sem
extrato) 62
3.3.4
Incorporação dos extratos bioativos às bases creme e gel creme ....... 64
3.3.5
Análises organolépticas das formulações farmacêuticas tópicas......... 65
3.4
Análise físico-química das formulações ...................................................... 66
3.4.1
Análise do potencial hidrogeniônico (pH).................................................. 66
3.4.2
Análise de estabilidade ................................................................................ 66
3.5
Avaliação da absorção na região visível do espectro eletromagnético
67
3.6
Avaliação da atividade antimicrobiana in vitro .......................................... 69
3.7
Avaliação dos extratos e de formulações tópicas contendo
Alternanthera brasiliana como fotossessibilizadores naturais ......................... 71
4
3.8
Equipamento Laser ............................................................................................ 71
3.9
Análise estatística .............................................................................................. 74
RESULTADOS .............................................................................................................. 75
4.1
Preparação dos extratos brutos de Alternanthera brasiliana ................ 75
4.2
Elaboração de formulações farmacêuticas semi-sólidas para uso
tópico75
4.2.1
Avaliação das características organolépticas das formulações
farmacêuticas ................................................................................................................ 76
4.2.2
Análises físico-químicas das formulações farmacêuticas ...................... 77
4.3
Avaliação da absorção na região visível do espectro eletromagnético
80
4.4
Avaliação da atividade antimicrobiana in vitro .......................................... 82
4.4.1
Determinação da concentração inibitória mínima (CIM) ........................ 82
4.5
Avaliação dos extratos e de formulações tópicas contendo extratos de
Alternanthera brasiliana como fotossessibilizadores naturais ......................... 82
5
DISCUSSÃO.................................................................................................................. 91
6
CONCLUSÃO................................................................................................................ 99
7
SUGESTÕES PARA TRABALHOS FUTUROS .....................................................100
REFERÊNCIAS ...................................................................................................................101
19
1 INTRODUÇÃO
Indícios do uso de plantas medicinais e tóxicas foram encontrados nas mais
antigas civilizações onde o homem primitivo, ao procurar plantas para o seu
sustento, foi descobrindo espécies com ação tóxica ou medicinal. Os benefícios
obtidos com a utilização empírica levaram o homem a buscar “novas” plantas para o
tratamento de patologias e a experiência acumulada foi transmitida por gerações,
conduzindo ao descobrimento de medicamentos utilizados na medicina moderna
(CORDELL, 1995, COWAN, 1999, GUERRA; NODARI, 2001). Sabe-se que mais de
80% da população mundial emprega plantas no tratamento das doenças, com base
em informações da medicina tradicional (CORDELL, 1995, HAMBURGER;
HOSTETTMANN, 1991). Dessa forma, muitos trabalhos científicos vêm sendo
realizados com o intuito de comprovar o uso popular de plantas medicinais. Outros
têm por objetivo isolar os princípios ativos majoritários de uma determinada espécie,
responsáveis pelo efeito terapêutico, visando à descoberta de novos fármacos
(HAMBURGER; HOSTETTMANN, 1991).
As reações tóxicas associadas ao uso de plantas também contribuíram para
que os estudos desenvolvidos neste campo fossem cada vez mais criteriosos.
Diversos
autores
têm
apontado
à
importância
dos
estudos
químicos
e
farmacológicos de espécies vegetais, principalmente daquelas encontradas em
ecossistemas tropicais (BRITO; BRITO, 1993, YAMADA, 1998; MANCINE, 1996).
Atualmente, estima-se que existam aproximadamente 500.000 espécies de plantas
terrestres, das quais são conhecidos cerca de 50.000 metabólitos secundários
(MONTANARI; BOLZANI, 2001).
Estes metabólitos têm papel fundamental na proteção das plantas contra
predadores (fungos, bactérias, vírus, insetos, moluscos), produzindo toxinas contra o
agente invasor e promovendo resistência a infecções. Assim, estas substâncias são
de interesse em investigações que almejam identificar novos agentes com atividade
biológicas, como por exemplo, os que apresentam atividade antimicrobiana, por
possuírem estruturas químicas complexas, com vários centros estereogênicos e que
podem ser empregados também como substâncias protótipos para a síntese de
novos fá rmacos. Dentre os metabólitos secundários de plantas que, in vitro,
20
demonstraram ter propriedades antimicrobianas podem ser citados taninos,
terpenóides, alcalóides e flavonóides (PINTO et al., 2002; YUNES; CALIXTO, 2001).
Especialmente no início do século XIX, com o desenvolvimento da química
farmacêutica, as plantas passaram a representar a primeira fonte de substâncias
para o desenvolvimento de medicamentos. Nos países industrializados, apesar do
grande desenvolvimento da síntese orgânica e de novos processos biotecnológicos,
estima-se que 25% dos medicamentos prescritos e registrados contenham
constituintes ativos derivados do reino vegetal (extratos, substâncias puras ou
modificadas) (COWAN, 1999; CUNICO et al., 2004). Até 1985 foram relacionadas
119 drogas provenientes de pouco mais de 80 espécies vegetais (BALANDRIN et
al., 1985; CORDELL, 2000) e, até 1999, metade dos 20 medicamentos mais
utilizados no mundo eram produtos naturais (NEWMAN et al., 2003; HARVEY,
2000).
No Brasil, há uma grande diversidade de plantas com potencial terapêutico, o
que estimula o estudo de suas possíveis ações terapêuticas e/ou tóxicas, a fim de se
desenvolver medicamentos com garantia de eficácia, segurança e qualidade.
Entretanto, a maioria das plantas comprovadamente reconhecidas como recurso
terapêutico, foi “descoberta” a partir do uso tradicional. A etnofarmacologia consiste
na
exploração
tradicionalmente
científica
interdisciplinar
empregados
por
de
agentes
determinados
biologicamente
agrupamentos
ativos,
humanos.
A
abordagem etnofarmacológica favorece com maior probabilidade a descoberta de
novas substâncias bioativas e é citada na literatura como sendo um dos caminhos
que mais evolui para a identificação de produtos naturais bioativos (MACIEL et al,
2002; HAMMER; JOHNS, 1993; DI STASI, 1996; ROBBERS; SEEDIE; TYLER,
1997).
De acordo com Lorenzi e Matos (2002), para as plantas serem utilizadas com
fins terapêuticos, devem ser selecionadas de acordo com sua eficácia e segurança
de uso, ou seja, cientificamente validadas como medicinais. Para uma planta ser
validada, deve responder positivamente à aplicação de um conjunto de ensaios
biológicos ou farmacológicos capazes de comprovar a existência da propriedade
terapêutica que lhe é atribuída, bem como seu grau de toxicidade nas doses
compatíveis com emprego medicinal.
21
A espécie vegetal Alternanthera brasiliana (Amaranthaceae) é empregada na
medicina tradicional, para o tratamento de infecções e é conhecida popularmente
como “Terramicina” e “Penicilina” (CAETANO et al., 2002). O uso popular difundido
como antimicrobiano, conduz a boas perspectivas quanto ao desenvolvimento de
medicamentos à base da planta. Devido às inúmeras infecções de difícil resolução,
agravadas por fatores tais como a resistência microbiana, toxidade e baixa eficácia
dos fármacos comercialmente disponíveis, há esperaça de que plantas como a
Alternanthera brasiliana.possam ser estudadas a fim de se qualificar o potencial
biológico presente no vegetal.
Por outro lado, visto que a terapia fotodinâmica (PDT – do inglês
Photodynamic therapy) tem grande eficácia em reduzir morte celular em
procedimentos experimentais, muitos estudiosos vêm aplicando esta tecnologia para
induzir a morte de microrganismos patogênicos (MANYAK, 1990). Com a
comprovação da PDT, muitas infecções poderiam ser melhor controladas,
principalmente as infecções tópicas, como as associadas a lesões cutâneas ou
associadas à solução de continuidade.
Assim, uma vez que em aná lises preliminares os extratos de A. brasiliana
absorveram luz na região de 600 a 700 nm (região de aplicação da PDT) e existem
relatos de sua aplicação no tratamento de infecções, no presente estudo procedeuse o preparo de extratos e formulações farmacêuticas de uso tópico (creme e gel
creme) contendo extratos bioativos de A. brasiliana e a avaliação do efeito destas
preparações tópicas como fotossenssibilizadores naturais em PDT antimicrobiana.
Acrecente-se o fato de que, até o momento , não foram encontrados relatos do
emprego de produtos naturais, tais como extratos vegetais, como agentes
fotossensibilizadores em PDT antimicrobiana o que configura em um caráter
inovador.
1.1 Considerações gerais sobre a família Amaranthaceae
A família Amaranthaceae foi estabelecida por A. L. Jussieu em 1789 e,
pertence
à
classe
Magnoliopsida,
ordem
Caryophyllales.
É
omposta
de
22
aproximadamente 1000 espécies e 65 gêneros dos quais 14 ocorrem no Brasil. Está
dividida em quatro tribos: Celosieae, Amarantheae, Braylineae e Gomphreneae
(SIQUEIRA, 1994/1995; SIQUEIRA, 1990; SIQUEIRA, 1989).
O gênero Alternanthera (tribo Gomphreneae) contém cerca de 180 espécies,
das quais 30 ocorrem no Brasil (SIQUEIRA; GUIMARÃES, 1984) e dentre estas se
encontra a Alternanthera brasiliana, objeto do presente estudo.
A família Amaranthaceae possui plantas com relatos de várias atividades
biológicas (antibacteriana, antifúngica, tripanocida, leishmanicida, antiinflamatória,
imunomodulatória etc.) e algumas espécies são utilizadas na medicina popular e
como alimento (SIQUEIRA, 1987a,b), sendo, portanto, fonte potencial para a busca
de novos fármacos ou medicamentos.
1.2 Considerações gerais sobre a espécie Alternanthera brasiliana
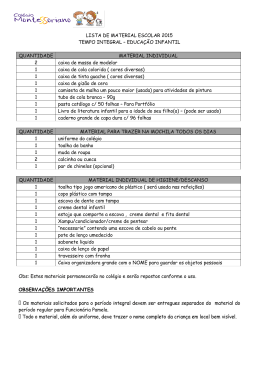
Figura 1: Alternanthera brasiliana (L.) O. Kuntze
A. brasiliana (Figura 1) apresenta ampla distribuição de exemplares na
América do Sul (SOUZA et al., 1998, DELAPORTE et al., 2005). É uma planta
23
herbácea, perene, empregada na medicina tradicional para o tratamento de
infecções (SOUZA et al., 1998, MACEDO et al., 1999, BROCHADO et al., 2003,
DUARTE; DEBUR, 2004, MACEDO et al., 2004). Popularmente é conhecida como
“Penicilina”, “Terramicina” (SOUZA et al., 1998, MACEDO et al., 1999, MACEDO et
al., 2004, SILVA et al., 2005), “Doril”, “Perpétua” (DUARTE; DEBUR, 2004),
“Perpétua do mato” (DELAPORTE et al., 2005) e com relato de aplicação em
eventos de dor, processos inflamatórios (DUARTE; DEBUR, 2004, DELAPORTE et
al., 2005), infecciosos (MACEDO et al., 1999; MACEDO et al., 2004), diarréia, tosse
(BROCHADO et al., 2003) e o pigmento vermelho extraído das folhas é utilizado
para o tratamento de injúrias da pele (SILVA et al., 2005).
Na literatura há o registro de estudos quanto à análise da morfo-anatomia das
folhas e do caule de A. brasiliana a fim de se obter informações relevantes para a
identificação da espécie medicinal (DUARTE; DEBUR, 2004).
Outros
estudos
foram
realizados
a
fim
de
verificar
as
atividades
farmacológicas da planta e seu emprego como suplemento alimentar. Devido à
ampla utilização popular desta planta medicinal e também à facilidade em se
encontrar a espécie na América do Sul, foi realizado um estudo da composição em
termos de cinzas e minerais de A. brasiliana. Como resultado, obteve-se o teor de
cinzas totais das folhas de 13,23% ± 0,47. Percebeu-se que este valor é superior ao
valor médio encontrado para outras drogas vegetais na Farmacopéia Brasileira. Na
determinação de macro e micronutrientes presentes nas folhas e cinzas totais
nitrogênio, cálcio e potássio foram detectados como elementos majoritários, o que
poderia dar certo respaldo ao uso desta planta como suplemento alimentar. Além
disso, elementos como alumínio, cobre e metais pesados (que apresentam risco
tóxico quando presentes em grandes quantidades) foram encontrados em baixa
concentração (DELAPORTE et al., 2005).
Com o objetivo de estudar o desenvolvimento in vitro da espécie A. brasiliana
com vistas a produção de pigmentos, foi realizado estudo in vitro com culturas de
células e tecidos empregando-se diferentes reguladores de crescimento, tirosina e
com ultravioleta longo (UVA; 320-400 nm) como estimulador. A iluminação com luz
branca (tipo luz do dia) foi mais adequada para a micropropagação, pois apresentou
maior produção de betacianinas. Já para as plântulas crescidas sob iluminação com
ultravioleta, observou-se que a produção de biomassa e a relação de Clorofila a/
Clorofila b apresentaram-se diminuídas (SILVA et al., 2005).
24
Quanto à avaliação das atividades farmacológicas de A. brasiliana, poucos
estudos foram realizados. Dentre estes, pode-se citar a avaliação das propriedades
analgésicas de um extrato hidroalcoólico obtido das partes aéreas da planta. Foram
aplicados dois modelos de nocicepção, o teste de contorções (Whriting test) e o
teste da formalina. O extrato demonstrou-se várias vezes mais potente do que as
substâ ncias padrão aspirina, indometacina e dipirona, quando avaliadas pelo teste
de contorção, observando-se uma relação dose dependente para o efeito
analgésico. Os resultados sugerem que o extrato é constituído por diferentes
substâncias que parecem agir sob mecanismos distintos: inibição da ciclooxigenase
e estimulação de receptores opióides. A presença de esteróides (principalmente ßsitosterol) , terpenos e compostos fenólicos poderia estar relacionada com a potente
atividade analgésica observada (SOUZA et al., 1998).
Outro estudo farmacológico e fitoquímico da espécie foi desenvolvido com
extratos metanólicos obtidos da cultura de calos de A. brasiliana. Os tecidos
liofilizados dos calos de A. brasiliana foram macerados com metanol, obtendo-se
extratos com diferentes redimentos de acordo com o meio em que a cultura foi
realizada. Quando avaliados através dos testes de contorção e da formalina
observaram-se resultados aponta ndo para a potencial biossíntese de ß-sitosterol
através de culturas desses tecidos e com isso, a obtenção de melhores respostas
analgésicas in vivo para os extratos de A. brasiliana (MACEDO et al., 1999).
Novamente, um extrato metanólico obtido de plântulas de A. brasiliana
cultivadas sob diferentes qualidades espectrais de luz (a fim de incrementar a
produção de compostos com possível ação analgésica) foi estudado fitoquímica e
farmacologicamente . Os resultados demonstraram maior rendimento da biomassa
nas plântulas desenvolvidas sob o tratamento com luz azul e branca. Além disso, os
extratos foram analisados mediante dois modelos químicos de nocicepção em ratos.
Administrados em concentrações de 10 mg/Kg de peso corporal para avaliação do
efeito antinociceptivo, a atividade dos extratos foi avaliada empregando-se o teste de
contorções abdominais, quando observou-se uma inibição de 51 e 62,5% da
nocicepção, bem como o teste da capsaicina em que a redução da dor observada foi
de 22% e 45%. Quanto à análise fitoquímica, não foi observada presença de ßsitosterol, o principal componente encontrado nos estudos citados anteriormente.
Este esteróide vem sendo responsabilizado por contribuir para a atividade
analgésica de várias plantas. O achado é sugestivo de que outros componentes
25
podem agir como analgésicos nos extratos metanólicos das plântulas de A.
brasiliana (MACEDO et al., 2004).
O primeiro estudo químico para o isolamento de metabólitos secundários de
A. brasiliana foi realizado em 2003. Os bioensaios empregaram a fase hidrossolúvel
de um extrato etanólico das folhas com o objetivo de identificar substâncias
potencialmente responsáveis pelo efeito antiproliferativo dos linfócitos. Neste estudo
foram isolados e identificados 6 flavonóides 0-glicosilados (BROCHADO et al.,
2003). Dentre estes metabólitos inéditos no gênero Alternanthera destacam-se
Kaempferol 3-0-robinobioside e kaempferol 3-0-rutinoside que inibiram a proliferação
linfocitária com atividade duas vezes mais potente que o extrato bruto de A.
brasiliana, sem apresentar efeito tóxico.
Os resultados sugeriram que as
propriedades medicinais antiinflamatórias de A. brasiliana observadas in vivo podem
ser atribuídas à ação destes flavonóides interferindo na atividade de linfócitos T
(BROCHADO et al., 2003).
Além da atividade antiinflamatória, há também relatos da atividade de A.
brasiliana sobre microrganismos. O Vírus Herpes Simplex (HSV) é um dos agentes
comumente responsabilizados por infecções virais no homem e freqüentemente
associadas
com
sintomas
clínicos
sérios,
especialmente
em
pacientes
imunocomprometidos, gestantes e recém nascidos. Apesar disso, na última década
somente 5 fármacos foram aprovados e clinicamente usados para o tratamento
dessas infecções. A emergente resistência dos vírus aos fármacos antivirais
clássicos e os efeitos colaterais são as principais razões para um refinamento no
desenvolvimento dos fármacos anti-virais (PERUSSI, 2007). Haja vista a atividade
antiviral encontrada em algumas espécies da ordem Caryophyllales, foi realizado
estudo a fim de avaliar a atividade de extratos das folhas de A. brasiliana em relação
à propagação do vírus HSV. Inibidores anti-HSV tais como Aciclovir, ácido
fosfonoacético (PAA) e 5-bromo-2, desoxiuridina (Brdurd), foram as substâ ncias
usadas como padrão durante a determinação da atividade anti-HSV. O extrato
aquoso da A. brasiliana
a 0,15% produziu o maior percentual de inibição, 99%
(LAGROTA et al., 1994).
Frente
ao
grave
problema
que
representa
a
multirresistência
do
Staphylococcus aureus e o interesse em estudar tratamentos alternativos aos
antibióticos tradicionais, a atividade antimicrobiana da A. brasiliana foi, brevemente,
estudada. Neste estudo preliminar empregaram-se extratos hidroalcoólicos secos,
26
estudados frente a 7 cepas de S. aureus, duas delas apresentando resistência à
meticilina (MRSA). O antibacteriano padrão utilizado foi o cloridrato de tetraciclina e
os métodos empregados foram a técnica do poço por difusão em ágar. O extrato
estudado mostrou-se ativo com efeito antibacteriano semelhante ao do controle
positivo (inclusive sobre cepas MRSA) (CAETANO et al., 2002). Entretanto este
estudo foi inicial não se determinando, por exemplo, os valores de concentracão
inibitória minima (CIM) para as cepas indicadoras estudadas.
Pereira et al. (2007) relataram moderada atividade antimicrobiana para o
extrato hidroalcoólico das folhas de A. brasiliana frente a S. aureus, P. aeruginosa,
Saccharomyces cerevisae e Prototheca zopffi. Este extrato não se apresentou ativo
frente a Escherichia coli, C. albicans e Candida glabrata. Entretanto os valores de
CIM encontrados foram relativamente altos. Estes fatos encorajam estudos mais
detalhados com extratos deste vegetal e podem justificar a possibilidade do emprego
da associação do extrato/formulações contendo extrato com a iluminação laser com
o intuito de se obter um efeito antimicrobiano em PDT em concentrações
subinibitórias mínimas.
1.3 Considerações gerais sobre formulações farmacêuticas
Para
que
agentes
terapêuticos
sejam
administrados
é
necessário,
primeiramente, incorporá-los em uma forma farmacêutica, constituída pelos
componentes farmacologicamente ativos e adjuvantes farmacêuticos (TOLEDO et
al., 2003).
A escolha da forma farmacêutica mais apropriada para um produto
fitoterápico deve considerar vários fatores a fim de garantir a qualidade do
medicamento. Estes fatores abrangem desde o conhecimento da eficácia e
segurança do componente ativo até a forma de aplicação e a via de administração
pretendida para o produto. Dessa maneira, deve-se prezar pela facilidade de
aplicação do medicamento, avaliando a via de administração mais adequada a fim
de favorecer a biodisponibilidade do(s) ativo(s) da formulação. A forma farmacêutica
deve ser adequada às necessidades fisiológicas da via de administração, direcionar
27
a cedência dos componentes ativos, seja em relação ao local mais apropriado de
absorção ou quanto ao perfil de liberação. É importante também que sejam tomadas
algumas medidas para favorecer a adesão do paciente ao tratamento. A adição de
adequadores organolépticos, por exemplo , conferem características sensoriais
(gustativas, olfativas e visuais) aceitáveis ao produto. Além disso, adjuvantes
primários conservadores, como conservantes, antioxidantes, tamponantes auxiliam
para contornar problemas quanto à estabilidade do produto (TOLEDO et al., 2003).
As formas farmacêuticas de administração tópica são empregadas no
tratamento de afecções da pele, das camadas mais profundas da derme e das
glândulas de secreção que fazem parte dos apêndices cutâneos. Podem, também,
ser empregadas nos tratamentos em que se deseja que o fármaco chegue à
circulação sistêmica através da administração cutânea. Esta via é empregada
largamente para administração de agentes antimicrobianos. Como é a formulação
que determina a liberação dos princípios ativos, no caso de antimicrobianos o
fármaco deve se difundir rapidamente pela pele o que pode se facilitado pela
formulação (DÍAZ et al., 2001).
1.3.1 Formulações farmacêuticas semi-sólidas
Do ponto de vista físico-químico, as formas farmacêuticas podem ter
consistência líquida, sólida ou semi-sólida. Neste trabalho, serão abordados
aspectos relevantes de preparações farmacêuticas semi-sólidas.
De um modo geral, formas farmacêuticas semi-sólidas são formulações
complexas e que, por vezes, se constituem de substâncias cuja estrutura também
apresenta certo grau de complexidade. Freqüentemente são compostas de duas
fases (aquosa e oleosa), uma delas contínua – fase externa – e a outra dispersa –
fase interna. Na maioria das vezes, as substâncias ativas encontram-se dissolvidas
em uma das fases, embora, ocasionalmente, o fármaco não se apresenta
completamente solúvel no sistema, encontrando-se disperso em uma ou em ambas
as fases, dando origem assim a um sistema tri-fásico (PRISTA et al., 2003).
28
1.3.2
Emulsões
Como representantes de preparações farmacêuticas semi-sólidas, podem ser
citadas as emulsões. Estas possuem características de sistema disperso constituído
por duas partes líquidas imiscíveis, no qual um dos líquidos está intimamente
disperso (em gotículas maiores que 0,1 µm) no outro, com ajuda de um
emulsionante, formando um sistema homogêneo (ALLEN JR., 2004, ANTUNES JR.,
2002, FONSECA; PRISTA, 2000).
Geralmente as emulsões contêm três componentes: uma fase lipídica, uma
fase aquosa e um emulsificante (ALLEN JR., 2004, FONSECA; PRISTA, 2000).
As substâncias denominadas de agentes emulsivos, emulsionantes ou
emulsificantes atuam ou por diminuírem a tensão interfacial (tensoativos), ou por
aumentarem a viscosidade da fase externa da emulsão permitindo que ela se
mantenha estável (FONSECA; PRISTA, 2000). Emulsionantes aniônicos e não
iônicos são os mais utilizados nas preparações de cremes e loções (ANTUNES JR.,
2002).
As emulsões podem ter consistências distintas. Emulsões cremosas (cremes),
por exemplo, são misturas termodinamicamente instáveis destinadas à aplicação
externa que podem ter características de sólidos macios ou líquidos viscosos e
opacos. Elas podem conter medicamentos dissolvidos ou suspensos em emolientes
ou evanescentes. O termo “creme” é mais frequentemente aplicado às preparações
do tipo óleo em água (O/A), geralmente empregadas em lesões úmidas ou
exsudativas, por possuírem um efeito secativo, uma vez que os fluidos são miscíveis
com a fase externa aquosa (ANSEL; POPOVICH; ALLEN JR., 2000, ALLEN JR.,
2004; THOMPSON, 2006). No entanto, preparações cremosas do tipo água em óleo
(A/O) também podem ser obtidas.
De acordo com as características almejadas para o creme, deve-se selecionar
o agente emulsificante mais adequado. Como tensoativos empregam-se substâncias
hidrossolúveis, indispensáveis nos cremes de óleo em água, enquanto que para os
cremes tipo água em óleo utilizam-se compostos oleossolúveis. Os produtos que
atuam aumentando a viscosidade da fase externa são hidrossolúveis e, são
aplicáveis aos cremes de óleo em água, enquanto que os lipossolúveis podem
auxiliar a estabilização de cremes de água em óleo (FONSECA; PRISTA, 2000).
29
1.3.3 Incorporação de princípios ativos em emulsões
Em emulsões O/A, pós insolúveis e soluções aquosas podem ser
incorporadas às emulsões O/A por espatulação ou utilizando um almofariz ou um
pistilo. Agentes levigantes como a glicerina e o propilenoglicol podem ser utilizados
como auxiliares na mistura do pó insolúvel. Já, materiais na forma cristalina devem
ser dissolvidos em uma pequena quantidade de água antes de sua adição à
emulsão. Materiais hidrossolúveis podem ser adicionados pela dissolução do pó em
uma pequena quantidade uniforme do óleo no veículo. Geralmente é mais fácil
adicionar componentes hidrossolúveis. Quando se emprega aquecimento para
incorporação, é importante trabalhar com agilidade, visto que a água pode evaporar
rapidamente. Quando isso ocorre, o produto terá seu volume alterado e, no caso de
um semi-sólido, pode ficar muito consistente e com aspecto seroso (ALLEN JR.,
2004).
Em emulsões A/O, os óleos e os pós lipossolúveis podem ser diretamente
incorporados na fase externa ou dissolvidos em pequena quantidade de óleo e então
incorporados à emulsão por espatulação. Algumas vezes é necessário empregar um
agente levigante. Na maioria das emulsões A/O, existe agente emulsificante
suficiente para emulsificar quantidades razoáveis de soluções aquosas de um
fármaco, que podem ser incorporadas, entre outros, com aquecimento suave em
banho-maria (ALLEN JR., 2004).
1.3.4 Conservação de emulsões
Para proceder à conservação adequada das formulações é necessário utilizar
sistemas conservantes adequados e validados, assim como cumprir as Boas
Práticas de Fabricação (ALLEN JR., 2004, AGÊNCIA , 2004). Isso porque, além da
contaminação durante o preparo da emulsão, pode acontecer contaminação durante
o período de armazenamento e, para evitar, deve-se utilizar na formulação
farmacêutica um conservante, que deve ser atóxico, estável, compatível e efetivo
contra um amplo espectro de bactérias, fungos e leveduras (ALLEN JR., 2004).
30
Os produtos que apresentam água em sua composição são mais suscetíveis
à contaminação. O crescimento bacteriano ocorre geralmente na fase aquosa da
emulsão, portanto os conservantes devem estar nessa mesma fase, pois se houver
a migração do conservante para a fase oleosa pode ocorrer a perda de efetividade
do mesmo (ALLEN JR., 2004, AGÊNCIA , 2004). É importante também, que o
conservante não esteja ligado a nenhum dos componentes da formulação, não seja
adsorvido e esteja no estado não-ionizado que é mais efetivo contra as bactérias
(ALLEN JR., 2004).
1.3.5
Potencial hidrogeniônico (pH)
O pH da superfície da pele é regulado pela secreção das glândulas
sudoríparas. Em média, este valor situa -se em torno de 4,5 e contribui de maneira
importante nos mecanismos de defesa da pele. Porém, o valor deste parâmetro
varia de uma região para outro do corpo, podendo alcançar 7,2 nos espaços
interdigitais. Sobretudo os distúrbios cutâneos e variações patológicas conduzem ao
pH no sentido da alcalinização, podendo atingir pH 8,0 em determinadas patologias.
Contudo, as emulsões devem ter um potencial hidrogeniônico final entre 5,5 e 6,5.
Emulsões catiônicas são exceções e o pH deve permanecer entre 3,5 e 4,5 para
favorecer a estabilidade do sistema disperso (ANTUNES JR., 2002).
1.3.6 Atividade dos cremes na pele
A pele humana é composta por três camadas distintas: epiderme (mais
externa, estratificada e avascular), deme ou cório (imediatamente abaixo da
epiderme) e hipoderme ou tecido subcutâneo (liga a derme às estruturas
subjacentes). A pele coberta de pêlos contém folículos pilosos e glândulas
sebáceas; a pele lisa das solas dos pés e palmas das mãos produz uma epiderme
espessa com estrato córneo compacto, mas não contem folículos pilosos e nem
glândulas sebáceas (BARRY, 2001, JACOB; FRANCONE; LOSSOW, 1990).
31
A superfície externa da pele apresenta uma resistência especial à ação dos
agentes externos, constituindo assim, uma barreira muito eficaz, mas que pode ser
ultrapassada por pequenas quantidades de substâncias lipofílicas capazes de
penetrar a camada córnea. Se estas substâncias possuírem também uma
determinada hidrofilia, pode ocorrer uma difusão mais profunda e às vezes uma
absorção sistêmica (ANTUNES JR., 2002).
O mecanismo de penetração dos princípios ativos é muito complexo, e
depende de muitos fatores como a natureza do princípio ativo, propriedades físicas e
mecânicas, solubilidade, a presença ou não de tensoativos e a quantidade de
excipiente que o carrega, bem como a região de aplicação, levando em
consideração a quantidade de folículos pilosos e a camada de queratina; grau de
hidratação da pele e pH da emulsão (ANTUNES JR., 2002, PRISTA; ALVES, 1967).
No caso de feridas, a pele está relativamente destruída e não desempenha
mais o papel de barreira protetora, assim o excipiente não precisa mais ter afinidade
com matérias oleosas (ANTUNES JR., 2002).
Na tentativa de controlar a liberação de ativos na pele e através da pele são
usadas uma das três estratégias seguintes: reduzir a resistência da pele como
barreira de penetração ao romper a bicamada lipídica na qual o estrato córneo está
envolto; provocar a liberação do fármaco a partir do veículo para a pele; acrescentar
um solvente adicional à pele, o qual ofereça um transporte paralelo ao transporte
convencional das moléculas ou que melhore a solubilidade do fármaco no interior da
pele (WAGNER et al., 2004).
1.3.7 Géis
Géis são sistemas semi-sólidos nos quais o movimento do meio dispersante é
restrito por uma rede tridimensional de partículas interlaçadas ou macromoléculas
solvatadas presentes na fase dispersa. Pode estar envolvido um alto grau de
interações físicas ou químicas. O aumento da viscosidade causado pelo
entrelaçamento e conseqüente atrito interno é responsável pelo estado semi-sólido.
Um gel pode consistir de filamentos torcidos e emaranhados que geralmente se
32
mantêm unidos por forças fortes do tipo Van der Waals, formando regiões cristalinas
e amorfas ao longo do sistema (ALLEN JR., 2004).
As resinas de carbopol são os agentes gelificantes mais comumente
utilizados. Existem vários tipos de resinas de Carbopol que atribuem características
distintas ao gel produzido. Quando dispersa em água, a resina de Carbopol umecta
e forma uma dispersão aquosa (resina/água) com valor de pH na faixa de 2,8 a 3,2.
Neste estado pré-dissolvido a molécula de Carbopol está extremamente enrolada e
sua capacidade espessante é limitada. Para obter o espessamento é necessária a
neutralização com bases inorgânicas, como o hidróxido de sódio ou aminas de baixo
peso molecular (trietanolamina, por exemplo). Ao acrescentar trietanolamina ou
hidróxido de sódio, o polímero (Carbopol) “estica”, devido à neutralização dos grupos
carboxilas presentes no polímero (ALLEN JR., 2004).
1.4 Considerações
gerais
Fotossensibilizadores,
sobre
Terapia
LASER,
Terapia
fotodinâmica
Fotodinâmica,
antimicrobiana
e
microrganismos
1.4.1
LASER
LASER, acrônimo para Light Amplification by Stimulated Emission of
Radiation (amplificação da luz por emissão estimulada de radiação) é um aparelho
que gera ou amplifica radiação óptica coerente na região do infravermelho, visível e
ultravioleta do espectro eletromagnético. Os feixes de radiação emitidos pelos lasers
possuem importantes características de direcionalidade, pureza espectral e
intensidade (BRUGNERA JR.; PINHEIRO, 1998).
Construído pela primeira vez na década de 60 pelo cientista Theodore
Mainman (laser de ruby) , o laser começou a ser utilizado na área da médica como
coadjuvante no tratamento de doenças de pele e peque nos tumores. Atualmente o
33
uso da radiação laser pode ser observado em quase todas as áreas de tratamento
de saúde com elevado índice de sucesso.
A laserterapia é dividida em dois sistemas quanto à potência dos aparelhos: a
terapia laser de baixa potência e de alta potência.
Os lasers de alta potência ou lasers cirúrgicos são aqueles que emitem
potências maiores (em relação aos lasers de baixa potência) e são indicados para
procedimentos cirúrgicos, podendo causar danos térmicos ao tecido alvo. Os lasers
de baixa potência utilizados em terapia laser possuem uma potência média de 30 a
100 mW sendo seu modo de emissão contínuo ou pulsátil e comprimentos de onda
que variam entre 630 e 940 nm. Seus efeitos em tecidos não são térmicos, sendo o
aquecimento produzido por eles insignificante, de 0,1 a 0,5°C. Suas aplicações
principais estão baseadas na quantidade de luz absorvida, para desta forma produzir
reações fotoquímicas e/ou fotofísicas. (KURACHI et al., 2002).
A terapia com laser de baixa potência é capaz de promover alterações
celulares e teciduais, geradas pelo processo de biomodulação, ou seja, pode
promover a ativação ou inativação de processos metabólicos sem envolver as
propriedades térmicas do laser (BRUGNERA JR.; PINHEIRO, 1998).
Além da propriedade de biomodulação, o laser de baixa potência pode atuar
como agente regenerador e cicatricial. Porém, quando em associação com um
agente fotossensibilizador, adquire a capacidade de provocar morte celular pela
formação de produtos altamente reativos caracterizando a terapia fotodinâmica
(PDT) (KURACHI et al., 2002).
1.4.2
Terapia fotodinâmica (PDT)
A luz tem sido empregada no tratamento de doenças desde a antiguidade
(ACROYD et al., 2001; KENDALL; MORTON, 2003). Entretanto, é recente o
significativo avanço do seu emprego na medicina e cirurgia. A aplicação se expande
desde o tratamento de icterícia neonatal, à combinação de moléculas de psoraleno e
luz ultravioleta A em dermatologia, até a terapia fotodinâmica e fotodetecção
(ACROYD et al., 2001).
A terapia fotodinâmica – PDT (do inglês Photodynamic Therapy) é uma nova
34
alternativa no tratamento anti-câncer e também de outras condições não
cancerosas, geralmente caracterizadas por um supercrescimento de células
anormais ou indesejáveis (DOUGHERTY et al., 1998, DOUGHERTY, 2002, FUCHS;
THIELE, 1998, SOLBAN; RIZVI; HASAN, 2006). Esta terapêutica requer a presença
de 3 (três) fatores: um fotossensibilizador (do inglês Photosensityzer), uma fonte de
luz e oxigênio (FUCHS; THIELE, 1998, HUANG, 2005, KENDALL; MORTON, 2003,
PERUSSI, 2007, SOLBAN; RIZVI; HASAN, 2006). Dessa forma, a PDT baseia-se na
administração tópica ou sistêmica de um corante ou substâ ncia não tóxica, sensível
à luz, seguida de irradiação em baixas doses com luz visível de comprimento de
onda adequado (BOYLE; DOLPHIN, 1996, FUCHS; THIELE, 1998, KENDALL;
MORTON, 2003, PERUSSI, 2007, SOLBAN; RIZVI; HASAN, 2006). Em outras
palavras, a terapia fotodinâmica é baseada na fotooxidação de um corante ou
substância fotossensível no tecido alvo biológico e utiliza luz para ativar as
substâ ncias empregadas como fotossensibilizadores (FUCHS; THIELE, 1998).
A escolha da fonte luminosa depende primariamente da profundidade que a
luz deve atingir no tecido. Devido à região espectral de absorção dos principais
cromóforos no tecido, hemoglobina e melanina, a profundidade de penetração
aumenta com o comprimento de onda na região do visível e infravermelho próximo.
Além disso, o comprimento de onda escolhido tem de corresponder a uma banda de
absorção do fotossensibilizador empregado na PDT (IANI; MOAN; MA, 1996).
Na presença de oxigênio, encontrado nas células, o fotossensibilizador,
ativado pela luz, pode reagir com moléculas na sua vizinhança por transferência de
elétrons. Isto acarreta a produção de radicais livres intermediários que podem reagir
com oxigênio produzindo radicais peróxido e várias outras espécies reativas de
oxigênio.
Esta
reação
é
caracterizada
como
tipo
I.
Alternativamente,
o
fotossensibilizador em estado triplete pode transferir energia para o oxigênio em
estado basal, gerando oxigênio molecular singlete. Esta forma é altamente reativa e
reage com muitas moléculas biológicas, incluindo lipídios, proteínas e ácidos
nucléicos (reação fotoquímica tipo II) (DOUGHERTY et al., 1998, DOUGHERTY,
2002,
KENDALL;
MORTON,
2003,
PERUSSI,
2007).
A
maioria
dos
fotossensibilizadores aplicáveis em PDT é eficiente na produção de oxigênio singlete
em sistemas químicos simples, e presume-se que, embora seja impossível medir
diretamente, o mecanismo fotoquímico de tipo II é o mecanismo dominante para a
PDT na maioria das circunstâncias em células e tecidos (DOUGHERTY et al., 1998,
35
PERUSSI, 2007).
Ambas as reações podem levar à morte celular e à destruição do tecido
doente. O oxigênio singlete reage com quase todos os componentes celulares uma
vez que os compostos orgânicos insaturados são, de forma geral, suscetíveis à ação
de O2. Como a primeira barreira para o O2 é a membrana celular e esta contém
lipídios insaturados que podem ser danificados, ocorre à inviabilidade celular. Os
hidroperóxidos resultantes podem levar à formação de espécies reativas de oxigênio
(ROS) através de reações catalíticas. Uma vez que a reatividade das ROS com
moléculas orgânicas não é específica, qualquer macromolécula dentro da célula
pode ser um alvo em potencial para PDT. Assim, a multiplicidade de alvos torna
mais difícil para as células desenvolverem resistência celular, sendo essa uma das
vantagens da fotossensibilização, além da morte celular (DOUGHERTY et al., 1998,
PERUSSI, 2007).
Na vasta maioria das aplicações, o papel primário da PDT é matar as células
indesejadas (OLEINICK, 1998). Desde que o termo apoptose foi introduzido em
1972, os mecanismos de morte celular são geralmente classificados como apoptose
ou necrose (KERR; WYLLIE; CURRIE, 1972). A apoptose é um processo fisiológico
essencial para o controle do desenvolvimento tecidual, involução e para a
homeostase tecidual. É considerada como um processo de morte celular
programada, regulado por sinais intra e extracelulares, terminando em uma
seqüência característica de mudanças morfológicas e bioquímicas. Há, então, o
desmantelamento sistemático da célula e a preparação dos componentes residuais
celulares, conhecidos como corpos apoptóticos, para o englobamento por
macrófagos teciduais ou outras células vizinhas. O processo limita a fuga do material
intracelular para o ambiente e assim previne a inflamação tecidual (OLEINICK;
MORRIS; BELINCHENKO, 2002). Quanto à PDT, alguns trabalhos a têm
considerado como indutora de apoptose (DOUGHERTY et al., 1998, PENG; MOAN;
NESLAND, 1996).
Em 1991, por exemplo, foi demonstrado que a PDT causa uma resposta
apoptótica celular e isto contribuiu para a elaboração de explicações para a
eficácia dessa terapia. Como a apoptose é um processo dependente de energia,
que ocorre em células nucleadas correspondendo à morte celular programada,
sugeriu-se, então, que a causa primária do evento seria o dano mitocondrial
(KESSEL; LUO, 1998).
36
Devido a esse possível mecanismo de ação, a terapia fotodinâmica é uma
modalidade
alternativa
para
o
tratamento
contra
vários
tipos
de
câncer
(HENDERSON; DOUGHERTY, 1992). Além disso, apresenta vantagens como
dispensar a especificidade dos agentes quimioterapêuticos e a radiação ionizante.
Comparada com outras terapias citotóxicas, a PDT tem a vantagem de possuir dupla
seletividade: não apenas o fotossensibilizador pode ser direcionado para as células
ou tecido doente, mas também a luz pode ser precisamente focalizada no local da
lesão (SOLBAN; RIZVI; HASAN, 2006). O procedimento pode ser repetido várias
vezes, se necessário, visto que não há efeitos tóxicos cumulativos e é, usualmente,
não invasivo (PERUSSI, 2007). Não obstante, a PDT pode promover alguns efeitos
adversos incluindo longa duração da fotossensibilidade da pele, ocasionalmente
distúrbios sistêmicos e metabólicos e destruição tecidual excessiva do local tratado
(ORENSTEIN et al., 1996).
Quando a PDT é aplicada ao tratamento do câncer, de modo geral, o
fotossensibilizador é injetado na corrente sanguínea e, dependendo do tipo de
corante, é absorvido por células de todo o corpo. O fotossensibilizador é escolhido
pela sua farmacocinética a fim de favorecer sua permanência nas células tumorais
por um período de tempo maior que nas células normais, embora o mecanismo
dessa retenção ainda não seja bem entendido. A ativação com luz é realizada
apenas quando praticamente toda a droga deixou as células normais, mas ainda
está presente nas células cancerosas, levando então à reação fotodinâmica
(PERUSSI, 2007, SOLBAN; RIZVI; HASAN, 2006).
Alguns
fotossensibilizadores
administrados
sistemicamente
tendem
a
acumular-se preferencialmente em tumores quando comparado ao tecido normal
(MOLPUS, 1996). A razão deste acúmulo preferencial não está esclarecida, mas
fatores relacionados à arquitetura tumoral bem como as propriedades do
fotossensibilizador podem desenvolver algum papel. Este alvo passivo pode resultar
dos altos níveis proliferativos das células neoplásicas, pobre drenagem linfática ou
mais específica interação entre a droga fotossensibilizadora e as células
neoplásicas, devido à carga, tamanho e estrutura do fotossensibilizador (SOLBAN;
RIZVI; HASAN, 2006).
A extensão do dano causado pela luz e a citotoxicidade parece ser
multifatorial, envolvendo fatores que incluem a distribuição intracelular e a
concentração do fotossensibilizador empregado na PDT, a intensidade de luz e a
37
disponibilidade de oxigênio. Os principais alvos para PDT são: membrana
plasmática, mitocôndria, núcleo e lisossomos (PENG; MOAN; NESLAND, 1996).
A resposta do tumor à PDT também não está completamente entendida, mas
alguns aspectos já estão bem estabelecidos. A efetividade da PDT depende dos
eventos que estão ocorrendo nas células malignas bem como na vascularidade do
tumor. Esses eventos podem resultar em estase do fluxo sanguíneo, colapso
vascular e, neste caso, a morte celular pode ocorrer por necrose (HENDERSON;
DOUGHERTY, 1992, PERUSSI, 2007).
A PDT já foi aprovada para tratamento de vários tipos de câncer como de
bexiga, pulmão, esôfago, gástrico e cervical, além de degeneração macular
relacionada à idade. Outras aplicações não oncológicas de PDT em estágio menos
desenvolvido incluem tratamento de lesões pré-malignas, psoríase, artrite e
aterosclerose (HAMBLIN; HASAN, 2004).
A pele é o principal órgão alvo para a PDT devido ao aumento da incidência
de câncer de pele e ao acesso fácil das drogas fotossensibilizadoras à luz. A tensão
de oxigênio na pele varia durante e após a PDT e parece ser um importante
parâmetro para o tratamento. A literatura indica que é possível realizar medidas
transcutâneas do oxigênio para adotar o dado como uma medida avaliável da
efetividade clínica da PDT e como predição local da energia requerida para gerar
uma resposta biológica. Conseqüentemente, a efetividade da PDT pode ser
manipulada pela modulação da tensão de oxigênio na pele (FUCHS; THIELE, 1998).
A PDT tem sido reportada por promover algum efeito sobre o sistema imune.
Nesse sentido, ela poderia tanto ativar como suprimir a resposta imunológica. Com
relação ao processo inflamatório, há liberação de mediadores inflamatórios de amplo
alcance com recrutamento de leucócitos e incremento da atividade destes, após a
PDT. A indução de uma resposta inflamatória aguda e a geração de imunidade
tumor-específica também desempenha um papel decisivo no controle em longo
prazo (KORBELIC, 1996).
A PDT parece não promover dor e representa uma técnica mais vigorosa do
que outras técnicas ablativas, entretanto, pode apresentar custo elevado, devido à
combinação necessária de tecnologia laser e substâncias fotossensibilizadoras que
podem ser de alto custo (O’DONNELL et al., 2007).
Nesse contexto, a terapia fotodinâmica vem recebendo atenção dos diversos
países no sentido de regularizar sua aplicação, como também a validação do
38
emprego de vários agentes fotossensibilizadores e aplicadores de luz disponíveis.
Atualmente, progressos têm sido alcançados na ciência básica e na fotodinâmica
clínica, quando se unem forças para discutir o desenvolvimento de investigações
clínicas e a utilidade das técnicas de PDT para o tratamento curativo ou paliativo de
doenças malignas e não-malignas (HUANG, 2005).
1.4.3 Fotossensibilizadores empregados em PDT
Nos
anos
70
(1970)
os
fotossensibilizadores
mais
freqüentemente
empregados foram hematoporfirina (HP) e HpD (uma mistura de porfirinas), tendo
sido denominados fotossensibilizadores de primeira geração. Evidenciado o principal
efeito adverso da HpD – a fotossensibilidade cutânea – os anos 80 (década de
1980) dataram a síntese de diferentes compostos químicos que foram considerados
fotossensibilizadores de segunda geração (JUZENIENE; MOAN, 2007).
Grande parte das moléculas fotossensíveis tem em sua estrutura um anel
heterocíclico similar àquele presente na clorofila e hemoglobina (ACROYD et al.,
2001; HUANG, 2005).
A maioria dos fotossensibilizadores empregados ou que ainda estão em fase
de investigação para aplicação no tratamento do câncer e outras doenças, possui
estrutura fundamental baseada em núcleos tetrapirrólicos. Destes, pode-se citar
compostos tais como porfirinas, clorinas, bacterioclorinas e ftalocianinas. A baixa
toxicidade produzida em células de mamíferos, na ausência de luz e as
propriedades de localização de tumor demonstradas por estes compostos ampliam
as expectativas de aplicabilidade na terapia anti-câncer (DETTY; GIBSON;
WAGNER, 2004, PERUSSI, 2007).
a) Porfirinas
As hematoporfirinas dão origem a inúmeros fotossensibilizadores. O
“Photofrin” (porfimer sodium), disponível no comércio, corresponde a uma mistura
heterogênea de porfirinas, muitas das quais não são ativas como sensibilizantes
tumorais (ACROYD et al., 2001). Este fotossensibilizador foi aprovado para o
tratamento de câncer de pulmão e esôfago nos Estados Unidos da América e tem
39
aplicação em vários outros tipos de câncer nos demais países (DOUGHERTY et al.,
1998, OCHSNER, 1997a). As limitações da droga estão relacionadas à sua
complexidade, à reduzida absorção tecidual da luz vermelha e à tendência de
retenção cutânea, produzindo fotossensibilidade (OCHSNER, 1997a).
Alguns estudos foram realizados com a protoporfirina IX (PpXI) contendo
nanohíbridos, sintetizadas por uma reação simples. Estes nanohíb ridos produzem
oxigênio singlete quando excitados por luz visível, resultando em oxidação de vários
substratos. A hidrofobização dos nanohíbridos os tornou mais ativo contra substratos
hidrofóbicos e provavelmente realçou a localização em ambientes apolares como
micelas ou, possivelmente, membranas biológicas. Estudos in vitro estão agora em
progresso objetivando investigar a habilidade dos nano híbridos de carregar as
células alvo com o fotossensibilizador (PpIX) e O2, facilitando a destruição destas
células pela geração de oxigênio singlete
após a irradiação (KANTONIS;
TRIKEROTIS; GHANOTAKIS, 2007).
b) Ftalocianinas
Estes compostos possuem estrutura semelhante à hematoporfirina (ACROYD
et al., 2001). Ftalocianinas e seus análogos, por exemplo, naftalocianinas,
demonstram enorme potencial como agentes fototerapêuticos para o tratamento de
inúmeras doenças (oncológicas e não-oncológicas) (OCHSNER, 1997b).
Mudanças na estrutura química das ftalocianinas podem modular as
propriedades fotofísicas e afetar a interação com as células e tecidos, promovendo
diferentes efeitos fotobiológicos (SEGALLA et al., 2002). Demonstrou-se que
alumínio cloroftalocianina sulfonada (AlSPc) produz maior fotossensibilização em
relação aos derivados de hematoporfirinas, sendo que a exposição à luz vermelha
intensifica a toxicidade. Porém, se comparada à HpD, a AlSPc desenvolve menor
toxicidade durante a exposição à luz ambiente (ACROYD et al., 2001).
c) Ácido 5-aminolevulínico (5-ALA)
O ácido 5-aminolevulínico (5-ALA) é empregado como precursor de
fotossensibilizadores. É aplicado em PDT com base na acumulação endógena de
PpIX, que pertence à segunda geração de fotossensibilizadores produzida pelo
corpo, induzida pela administração tópica de 5-ALA (KENNEDY; POTTIER; PROSS,
1990, ACROYD et al, 2001). Embora a formação altamente regulada de PpIX exista
40
em quase todas as células nucleadas (que contenham mitocôndrias), o acúm ulo se
dá principalmente em tecidos com alta atividade celular. O fenômeno de acumulação
do fotossensibilizador em tecidos doentes não é específico para doenças
neoplásicas ou pré-neoplásicas. A síntese de 5-ALA é normalmente controlada com
rigor pela enzima ALA sintetase, provavelmente através do nível intracelular de
heme. Quando o ALA é fornecido à célula, subverte esse controle e resulta no
acúmulo da PpIX, que é convertida para heme pela ferroquelatase pela adição de
ferro ao núcleo da PpIX. Uma vez que esse processo é lento, altos níveis de PpIX
são encontrados no tecido, embora, para produzir um efeito fotodinâmico, necessitese de exposição à luz (PERUSSI, 2007).
O diagnóstico fotodinâmico empregando ácido 5-aminolevulínico (5-ALA) tem
sido largamente realizado durante os últimos anos em muitos institutos do Japão e
da Alemanha, objetivando detectar, entre outros, tumores cerebrais tipo gliomas. O
procedimento não é complexo e o cuidado pós-operatório do paciente é mais fácil
em relação ao uso de outros agentes fotossensibilizadores (YAMAGUCHI;
TAKAHASHI; TERAMOTO, 2007).
Há várias vantagens na fotossensibilização por PpIX induzida pelo ALA, uma
delas é que o organismo elimina PpIX rapidamente, o que limita o risco da
fotossensibilidade a 1-2 dias (PERUSSI, 2007).
Estudos clínicos têm envolvido a aplicação tópica de ALA para o tratamento
de lesões de pele. O efeito em longo prazo do ALA no tratamento de queratoses
solares tem se demonstrado benéfico em estudo in vivo, eliminando a doença em
71% dos ratos testados. Em estudos aplicando-se ALA (em PDT) em verrugas de
mãos e pés, os resultados foram significantemente melhores do que aqueles obtidos
pelo tratamento padrão (crioterapia) (ACKROYD et al., 2001).
d) Clorinas
São porfirinas reduzidas, que têm como principal representante a N-aspartil
clorina e6 (e6). Esta forma apresenta duas importantes propriedades: maior
rendimento quântico de formação de oxigênio singlete e banda de absorção intensa
em comprimentos de onda maiores (650-660 nm) que as porfirinas (610-630 nm),
onde os tecidos biológicos são mais transparentes à luz (PERUSSI, 2007). Alguns
estudos vêm sendo realizados aplicando e6 como fotossensibilizador em PDT e
resultados encorajadores estão sendo alcançados. Esta clorina demonstrou-se
41
efetiva e segura e não apresentou efeitos colaterais além da fotossensibilidade
transitória da pele. A droga permanece no plasma por período maior que 6 (seis)
semanas (ACROYD et al., 2001).
e) Hipericina
A hipericina é um pigmento fotoativo natural produzido por plantas do gênero
Hypericum da família Guttiferaceae. Esta substância é indicada em quadros de
distúrbios psicovegetativos, estados depressivos leves a moderados, medo e
agitação
emocional.
Além
disso,
possui
propriedades
antiinflamatórias,
antiinfecciosas, entre outras, exibindo uma potente atividade fototóxica antitumoral in
vitro e in vivo. A hipericina é provavelmente o mais potente fotossensibilizador
encontrado na natureza. A produção sintética deste fotossensibilizador para
aplicação em PDT tem se demonstrado promissora e alguns resultados indicam a
indução tanto da apoptose quanto da necrose de células tumorais (PERUSSI, 2007).
Um estudo in vitro empregando células humanas cancerosas comparou a ativação
da droga fototóxica – hipericina – quando submetida à irradiação com laser pulsado
e contínuo. Observou-se que a resposta fototóxica da hipericina aumentou
linearmente quando exposta ao laser pulsado de comprimento de onda de
514-593 nm, durante 5-120 segundos, sugerindo-se a aplicabilidade como droga
anti-tumoral (BUBLIK et al., 2006).
f) Xantenos
Os xantenos são compostos aromáticos cíclicos, com três anéis aromáticos
em arranjo linear com um átomo de oxigênio no centro do anel, que absorvem luz na
região do visível. Esses corantes não se ligam à membrana celular e localizam-se no
citoplasma. São representantes desta classe os seguintes compostos: Rosa de
Bengala, Eosina Y, Fluoresceína e Eritrosina B. Rosa de Bengala é um haleto,
derivado da fluoresceína, que tem sido usado em oftalmologia como um corante
para diagnóstico de várias patologias. Quando aplicado em inativação fotodinâmica
pode matar microrganismos tais como vírus, bactérias, protozoários, além de
promover efeitos fotodinâmicos in vitro sobre células epiteliais, cardiomiócitos, entre
outros. Quando exposto à radiação de 532 nm promove basicamente reação do tipo
II, gerando 80% de oxigênio singlete e 20% de ânion superóxido. A
eosina
Y
é
derivada do tetrabromo de fluoresceína e pode ser usada para corar o citoplasma, o
42
colágeno e as fibras musculares para exames de microscopia. Já a eritrosina
apresenta atividade antimicrobiana contra bactérias da cavidade oral. Este corante
foi aprovado para uso bucal, o que representa uma vantagem sobre os demais
fotossensibilizadores (PERUSSI, 2007).
g) Fenotiazínicos
Os corantes fenotiazínicos exibem intensa absorção entre 600 e 660 nm,
região do espectro útil em PDT, por estar na “janela terapêutica” requerida para a
eficiente penetração da luz nos tecidos (PERUSSI, 2007).
O Azul de Metileno é um corante fenotiazínico aplicado primeiramente como
medicamento antimalárico. O cátion azul de metileno intercala na estrutura do ácido
nucléico devido à carga positiva e suficiente área de superfície planar do
fotossensibilizador. Entretanto, este cromóforo é facilmente reduzido por sistemas
biológicos e assim, sua atividade antibacteriana , por exemplo, é reduzida. O azul de
metileno vem sendo amplamente empregado como fotossensibilizador. Em função
de cepas resistentes a múltiplos antibióticos serem sens íveis a este tipo de corante
fotossensível, há a possibilidade de seu uso como agente quimioterapêutico
(PERUSSI, 2007).
O alaranjado de acridina é bioisóstero do azul de metileno, diferindo somente
pela ausência do enxofre no anel central sem alterar a planaridade da estrutura e
mantendo o valor de pKa elevado, propriedades necessárias para intercalar no DNA.
Foi relatado que a metilação cromofórica do azul de metileno diminui a tendência à
redução. Após estudo descrito com azul de metileno em tumores colorretais,
concluiu-se que há uma dose limiar para prevenção do efeito oxidativo tecidual. Os
corantes fenotiazínicos, em geral, têm apresentado a desvantagem de toxicidade
inerente (no escuro), o que causa uma diminuição da eficiência terapêutica. Assim, a
síntese de análogos vem sendo incentivada (PERUSSI, 2007).
A acridina é um composto com efeito inibidor seletivo sobre as bactérias,
sendo mais efetivo contra as espécies gram-positivas. Possui pouca atividade
antifúngica (TAPPEINER, 1903 apud MACHADO, 2000).
43
1.4.3.1 Fotossensibilizadores
antimicrobiana
aplicáveis
em
terapia
fotodinâmica
Os fotossensibilizadores estudados para a erradicação de microrganismos
pertencem a diferentes grupos de substâ ncias, tais como os xantenos halogenados
(Rosa de Bengala), fenotiazínicos (Azul de orto-toluidina, Azul de Metileno),
acridinas e conjugados de clorina (e6 ) (PERUSSI, 2007).
A habilidade de um componente em absorver uma luz incidente não significa
necessariamente que ele possa atuar como um fotossensibilizador com aplicação
em terapia fotodinâmica antimicrobiana. Outros requisitos importantes são que ele
não apresente características tóxicas para as células do hospedeiro, além de
permanecer em estado excitado por tempo suficiente para permitir a sua interação
com as moléculas vizinhas e produzir espécies citotóxicas capazes de causar a
morte bacteriana (ACROYD et al., 2001, MACROBERT et al., 1989).
1.4.4
Terapia Fotodinâmica (PDT) Antimicrobiana
De modo semelhante às células tumorais, microrganismos tais como
bactérias, fungos filamentosos, leveduras, vírus e protozoários também podem ser
mortos aplicando-se luz visível depois do tratamento com um fotossensibilizador
apropriado, em um processo denominado “inativação fotodinâmica” (GAD et al.,
2004) ou quimioterapia fotodinâmica antimicrobiana (PACT – Photodynamic
Antimicrobial Chemotherapy) (WAINWRIGHT, 1998). Embora atue de acordo com os
mesmos princípios fotoquímicos, na inativação fotodinâmica ou terapia fotodinâmica
antimicrobiana os alvos celulares e a estrutura dos fotossensibilizadores são
diferenciados da PDT aplicada ao tratamento de câncer (PERUSSI, 2007).
O primeiro experimento descrito em terapia fotodinâmica antimicrobiana data
de 1900, quando Raab descreveu a ação de corantes acridina e luz solar sobre
Paramecium caudatum, observando que este organismo unicelular poderia morrer
sob estas condições. Ele percebeu que a exposição do corante à luz incrementava o
44
efeito biocida sobre o protozoário quando comparado ao corante não exposto à
irradiação (RAAB, 1900).
No entanto, foi somente em 1904 que Von Tappeiner empregou pela primeira
vez o termo “fotodinâmica”, ao descrever as reações químicas com consumo de
oxigênio induzidas pela fotossensibilização (FRITSCH; GOERZ; RUZICKA, 1998).
Uma vez que fotossensibilizadores agem via produção de oxigênio singlete,
não existe resistência microbiana natural, assim, não importa se a cepa é resistente
a uma ou muitas classes de agentes antibacterianos (por ex. Staphylococcus aureus
resitentes à meticilina), dado que o cromóforo (fotossensibilizador) é capturado pelo
microrganismo. Desta maneira, a PDT tópica pode ser usada para infecções em
tecidos não perfundidos, tais como queimaduras, úlceras de compressão e pode ter
menor toxicidade quando comparado com outros tratamentos antimicrobianos
tópicos (PERUSSI, 2007).
A
ação
microbicida
da
PDT
tem
microrganismos tais como Porphyromonas
Actinobacillus
actinomycetemcomitans,
Streptococcus
pneumoniae,
sido
evidenciada
diferentes
gingivalis, Prevotella intermedia,
Bacteroides
Enterococcus
em
faecalis,
forsythus,
Hemophilus
S.
aureus,
influenzae,
Escherichia coli, Candida albicans, Pseudomonas aeruginosa, Fusobacterium
nucleatum e Streptococcus sanguis, apresentando resultados superiores nas
bactérias pigmentadas de preto, pois apresentam cromóforos naturais (ALMEIDA et
al., 2006).
A utilização de um cromóforo (fotossensibilizador), que se fixe à parede
bacteriana atraindo para si a luz laser no momento da irradiação, é essencial para
que os lasers de baixa potência tenham ação antimicrobiana sobre as bactérias
(WILSON; DOBSON; HARVEY, 1993). Deste modo, quando as bactérias coradas
com um fotossensibilizador específico são irradiadas por uma luz laser de
comprimento de onda complementar, ocorre absorção de fótons pelo corante, que é
convertido para um estado excitado caracterizado pela passagem de elétrons
para níveis de energia superiores. A seguir, a energia transferida para moléculas
vizinhas pode resultar na formação de moléculas reativas (reação tipo I ou tipo II)
que podem danificar e, em último caso, matar as células bacterianas (DOBSON;
WILSON, 1992).
A ação antimicrobiana dos lasers de baixa potência só começou a ser
efetivamente estudada na última década, quando a terapia fotodinâmica,
45
inicialmente idealizada para o tratamento do câncer, foi aplicada na odontologia.
Enquanto no tratamento do câncer o alvo da terapia fotodinâmica é promover a
morte seletiva das células tumorais, no caso da odontologia surgiu uma nova
perspectiva para a utilização da terapia fotodinâmica tendo como alvo as células
bacterianas envolvidas nas lesões de cárie e na doença periodontal (ZANIN et al.,
2003).
As vantagens da PDT aplicada à atividade antimicrobiana vêm sendo
descritas
em
relação
ao
uso
dos
agentes
antimicrobianos
tradicionais.
Primeiramente, a morte da célula bacteriana pode ser rápida, não sendo necessária
a manutenção do agente químico em altas concentrações sobre as lesões por
longos períodos de tempo, como ocorre com o uso de antibióticos. Outro aspecto
relevante, é que o uso de fotossensibilizador ou da radiação laser, sozinhos, não
apresentam efeito significativo sobre a viabilidade das bactérias, de modo que a
terapia pode ser confinada à área da lesão pela aplicação tópica, cuidadosa, do
corante e restrição da irradiação por meio de fibra ótica (WILSON, 1993).
Várias cepas têm sido investigadas para avaliação da aplicabilidade da PDT
em inativação microbiana. Candida albicans e outras Candida spp., responsáveis
pela candidose associada ao HIV, foram estudadas a fim de verificar se poderiam
ser sensibilizadas até a morte pela luz laser de baixa potência. Suspensões de C.
albicans foram tratadas com alguns fotossensibilizadores potentes, sendo expostas,
posteriormente, à radiação laser He -Ne ou GaAlAs por 120 s e as unidades
formadoras de colônias sobreviventes foram enumeradas. Pôde-se observar que os
fotossensibilizadores azul de orto -toluidina, tionina e cristal violeta foram capazes de
sensibilizar as leveduras até a morte após irradiação com laser He-Ne (0,876 J,
densidade de 66,36 J/cm2). Os valores de redução (morte) obtidos pela aplicação
dos fotossensibilizadores foram de 6,8·106 UFC/mL, 3,1·106 UFC/mL e 1,3·106
UFC/mL, respectivamente. O azul de orto -toluidina também foi capaz de sensibilizar
(até a morte) várias outras espécies do gênero Candida quando combinado com
radiação laser He-Ne. Diematoporfirina éster não foi efetiva como fotossensibilizador
sob as condições empregadas. Já o azul de metileno foi capaz sensibilizar Candida
albicans (até a morte) quando irradiado com laser de GaAlAs (1,32 J, densidade de
2,04 J/cm2 ), no entanto, apresentou toxicidade às cepas na ausência de luz. A
viabilidade das leveduras não foi afetada pela exposição ao laser de baixa potência
por curtos períodos de tempo. Estes resultados sugerem a potencial aplicação
46
terapêutica da PDT na candidose associada ao HIV, com a ressalva da necessidade
de mais estudos serem realizados (WILSON; MIA, 1993).
Suspensões de S. aureus foram irradiadas empregando-se laser He-Ne, na
presença e ausência de azul de orto-toluidina, a fim de determinar se este corante
seria efetivo, sensibilizando os microrganismos até a morte. Após a irradiação com
0,88 J da luz laser He-Ne na presença de uma concentração de 12,5 µg/mL do
corante , os microrganismos viáveis foram enumerados, observando-se uma redução
de 95% (9·107 UFC) do valor inicial. Quando as suspensões foram expostas à
irradiação,
nessas
mesmas
condições
da
luz
laser,
na
ausência
do
fotossensibilizador, a redução das células bacterianas viáveis foi insignificante. Já,
com doses maiores de energia (3,5 J), na ausência do azul de orto-toluidina, foram
obtidos valores estatisticamente significantes de microrganismos inviabilizados
(3·107 UFC), o que permitiu observar a possível presença de um fotossensibilizador
endógeno nos microrganismos (WILSON; PRATTEN, 1994).
Os efeitos fotodinâmicos do azul de orto-toluidina foram, também, estudados
in vitro para queratinócitos orais, fibroblastos humanos e S. sanguis, observando-se
citotoxicidade do corante, mesmo em baixas concentrações
(5,0
µg/mL).
A sensibilização de queratinócitos e fibroblastos com as concentrações de 2,0 e
5,0 µg/mL do fotossensibilizador, respectivamente, por 5 minutos e exposição à luz
de um laser He-Ne (com potência de 7,3 mW durante um tempo maior q ue 2 minutos
0,876 J) não reduziu a viabilidade celular. Entretanto, a morte de Streptococcus
sanguis foi alcançada seguindo a exposição à luz de He -Ne por 75 segundos
(0,547 J) na presença do azul de orto-toluidina na concentração de 2,5 µg/mL.
Assim, o desenvolvimento de um sistema para fotossensibilização letal de bactérias
responsáveis pela doença periodontal pode ser possível empregando-se este
fotossensibilizador (SOUKOS et al., 1996).
Biofilmes naturais de placa oral, formada in vivo, foram alvos de estudos de
PDT realizados in vitro objetivando alcançar uma alternativa terapêutica para a placa
dentária quando outras terapias não podem ser empregadas (tal como em casos de
resistência a antibióticos ou quando a remoção mecânica da placa não é tolerada).
Os autores concluíram que os biofilmes naturais da cavidade oral humana podem
sofrer disrupção e as bactérias seriam, então, danificadas pela PDT empregando-se
uma ftalocianina catiônica. Os resultados foram promissores quanto à aplicação da
47
ferramenta fotodinâmica como tratamento alternativo para a placa dentária (WOOD
et al., 1999).
Sabendo-se que certas bactérias são capazes de sintetizar compostos
fotossensibilizadores foi realizado estudo com algumas cepas patogênicas grampositivas. Inicialmente, os microrganismos Propionibacterium acnes, Actinomyces
odontolyticus e Porphyromonas gingivalis foram submetidos à espectroscopia
sensível de autofluorescência, que revelou a síntese natural de PpXI, uma
substância empregada como fotossensibilizador, que exibe fluorescência. Outra
etapa do trabalho foi realizada com amostras de placas bacterianas, obtidas de
pacientes portadores de periodontite. As colônias bacterianas foram expostas à luz
vermelha de um laser de He-Ne a 632.8 nm, densidade de potência 100 mW/cm2,
densidade de energia de 360 J/cm2. As taxas de sobrevivência encontradas para as
gram-positivas testadas, após fototratamento único com luz vermelha, foram de:
0,58±0,09 para Propionibacterium acnes, 0,30±0,04 para Actinomyces odontolyticus
e 0,59±0,10 para Porphyromonas gingivalis em relação às suspensões de bactérias
não expostas à luz. Não foi encontrado fotoefeito para Streptococcus mutans que
exibiu porfirina autofluorescente não detectável. As amostras de placas bacterianas,
obtidas de pacientes com periodontite, expostas à luz vermelha, mostraram
significante redução de unidades formadoras de colônias (50%), bem como um
fotoefeito pronunciado para a espécie pigmentada Prevotella intermédia. Esses
resultados sugerem que o tratamento com luz vermelha poderia ser empregado
como método terapêutico por inativar certas cepas bacterianas patogênicas,
produtoras
de
porfirinas,
sem
necessidade
de
emprego
de
agentes
fotossensibilizadores externos (KÖNIG et al., 2000).
Um estudo de comparação entre o azul de metileno e azul de orto-toluidina foi
desenvolvido para determinar o corante com atividade bactericida mais efetiva. Em
condições de claro (luz) e escuro, supensões (em salina) dos microrganismos
Staphylococcus
aureus,
Streptococcus
pneumoniae,
Enterococcus
faecalis,
Hemophilus influenzae, Escherichea coli e Pseudomonas aeruginosa foram
testadas. Como fonte de luz empregou-se um laser pulsado de argônio e um diodo
laser emitindo luz a 630 nm e 664 nm, respectivamente. Foram comparados: o efeito
da concentração do corante, o tempo de incubação no escuro, a fluência e a
intensidade da luz laser, para a destruição das diferentes bactérias. Ambos os
corantes erradicaram totalmente as bactérias examinadas sob as condições de
48
irradiação. A completa fotodestruição de microrganismos foi alcançada em
concentrações menores para o azul de orto-toluidina do que para o Azul de metileno.
Assim o primeiro corante (azul de orto-toluidina) exibiu uma atividade bactericida
melhor do que aquela apresentada pelo azul de metileno contra a maioria das
bactérias, tanto no escuro quanto em condições de iluminação. Esses resultados
são compatíveis com os respectivos coeficientes de partição dos corantes
(USACHEVA; TEICHERT; BIEL, 2001).
Outro estudo empregando o azul de metileno como fotossensibilizador e luz
visível, objetivou avaliar a aplicação da PDT em espécies de microrganismos
cutâneos.
Foram
empregadas
amostras
de
espécies
de
microrganismos
encontrados na pele saudável e doente. As condições de luz foram padronizadas
empregando-se um projetor de slides a 25 cm de distância do alvo e densidade de
potência de 42 mW/cm². O corante foi aplicado na concentração de 100 µg/mL e as
taxas de morte celular foram determinadas para Staphylococcus aureus,
Staphylococcus
epidermidis,
Streptococcus
pyogenes,
Corynebacterium
minutissimum, Propionibacterium acnes e Candida albicans. Os efeitos da
intensidade de luz na morte de S. epidermidis demonstraram que as taxas de morte
são proporcionais à intensidade de luz, sendo que a maior taxa de mortalidade
celular foi obtida usando a luz natural do Sol. Foi possível observar que C. albicans
foi menos sensível ao tratamento devido à presença de membrana nuclear, que
possivelmente, atua como uma barreira adicional para o Azul de metileno ou para os
produtos de alta energia provenientes da reação do Azul de metileno com a luz.
Além disso, devem ser consideradas as diferenças no tamanho/volume celular da
levedura em relação às bactérias. Concluiu-se que a PDT foi efetiva contra células
procarióticas, o que sugere a potencial aplicação dessa modalidade terapêutica para
tratamento seguro e efetivo ou para o controle de uma variedade de microrganismos
associados a doenças cutâneas. Com a aplicação de PDT e azul de metileno em
doenças
da
pele,
pode-se
inibir
o
desenvolvimento
de
resistência
dos
microrganismos desta flora às drogas antimicrobianas de uso convencional (ZEINA
et al., 2001).
Os efeitos de fatores fisiológicos e ambientais de algumas bactérias
associadas a infecções orais em pacientes imunocomprometidos foram observados
a fim de verificar a suscetibilidade destes microrganismos à PDT (empregando-se
azul de orto-toluidina como fotossensibilizador). Suspensões de Pseudomonas
49
aeruginosa, Escherichia coli, Klebsiella pneumoniae feitas em saliva humana, soro
de cavalo ou salina, foram irradiadas com luz de um laser He-Ne. No experimento,
as três espécies demonstraram-se suscetíveis à fotossensibilização letal sob as
condições empregadas. O efeito bactericida foi reduzido em pHs ácidos, mas não foi
afetado pela fase de crescimento dos microrganismos. Pôde-se perceber que a
composição e o pH do fluido em que as bactérias foram suspensas influenciaram a
efetividade da fotossensibilização letal mediada pelo corante azul de orto-toluidina
(KÖMERIK; WILSON, 2002).
Cepas de Candida albicans resistentes ao tratamento convencional da
candidíase, foram coletadas de pacientes HIV -positivo e inoculadas na cavidade oral
de ratos, que, posteriormente, foram submetidos à aplicação tópica de 1 mL de azul
de metileno , nas concentrações de 250, 275, 300, 350, 400, 450 e 500 µg/mL. Após
10 minutos da aplicação do corante foi aplicado o laser de diodo com comprimento
de onda de 664 nm e potência de 400 mW, por 687,5 segundos (resultando em uma
densidade de energia de 275 J/ cm2). Após esta única aplicação de luz, foi realizada
cultura microbiana de amostras coletadas da cavidade oral dos ratos e os animais
foram sacrificados para realização de análise histológica da língua. Os resultados
obtidos mostraram uma completa eliminação dos microrganismos quando utilizadas
as concentrações de 450 e 500 µg/mL do corante. Na análise histológica, os ratos
tratados com terapia fotodinâmica não apresentaram candidíase e observou-se
resposta inflamatória mínima. As línguas dos ratos do grupo controle (não
irradiados) apresentaram-se com elevada taxa de candidíase, restrita às camadas
de queratina. Os autores concluíram que a terapia fotodinâmica é uma alternativa
em potencial para o tratamento da candidíase e apontaram como vantagens da
técnica, o fato de ser uma terapia realizada topicamente, de simples execução e
inespecífica, ou seja, que abrange um grande número de microrganismos. Além
disso, esta terapia pode ser repetida sem o risco da seleção de cepas resistentes
(TEICHERT et al., 2002).
Um estudo de revisão bibliográfica foi realizado para observar o emprego da
terapia fotodinâmica na redução de bactérias bucais e as perspectivas de aplicação
desta técnica na odontologia. No contexto, observou-se que a utilização de Lasers
capazes de matar microrganismos patogênicos surge como terapia auxiliar ao
tratamento odontológico preventivo e restaurador (ZANIN et al., 2003).
Um estudo piloto avaliou a efetividade da fotossensibilização letal para o
50
tratamento microbiológico da região de implante dental em cachorros. Amostras
microbianas foram tratadas com 100 µg/mL de azul de orto-toluidina na superfície de
implante, e foram expostas, por 80 s, à luz de comprimento de onda de 685 nm de
um laser diodo de GaAlAs. Os autores concluiram que a fotossensibilização resultou
em uma redução estatisticamente significativa na contagem bacteriana, sendo a
eliminação total de microrganismos conseguida em algumas amostras. Os
microrganismos encontrados na região sensibilizada foram Prevotella intermédia,
Prevotella nigrescens, Fusobacterium spp. e Streptococcus beta-hemolíticos (SHIBLI
et al., 2003).
Um estudo in vitro foi realizado a fim de avaliar a atividade antibacteriana de
fotossensibilizadores tetraaril-porfirina (dois comerciais e cinco sintéticos) frente a
bactérias gram-positivas (S. aureus) e gram-negativas (E. coli e P. aeruginosa).
Observou-se que os fotossensibilizadores catiônicos foram mais ativos do que os
comerciais e a porfirina não iônica foi a menos ativa frente às bactérias. Além disso,
a cepa gram-positiva demonstrou-se mais sensível aos fotossensibilizadores do que
as gram-negativas, sendo P. aeruginosa a mais resistente delas. Os resultados
obtidos confirmam que a presença de grupamentos com carga positiva na estrutura
das
porfirinas
são
fundamentais
para
a
atividade
antibacteriana
dos
fotossensibilizadores estudados. Entretanto, sugere-se que um moderado grau de
lipofilicidade conseguido pela introdução de cadeias de hidrocarbonetos aromáticos
nas
moléculas
de
piridil,
pode
aumentar
a
eficiência
dessa
classe
de
fotossensibilizadores (BANFI et al., 2006).
Sabe-se que os corantes fenotiazínicos azul de metileno e azul de ortotoluidina formam complexos metacromáticos com lipopolissacarídeos (LPS). A
melhor
efetividade
bactericida
do
azul
de
toluidina
(através
do
efeito
fotossensibilizador) em relação ao azul de metileno pode ser explicada pela maior
afinidade deste corante pelo LPS. Almejando elucidar a diferença na eficácia
fotobactericida dos corantes supracitados, realizou-se um estudo usando Ca2+ como
um competidor pelos sítios de ligação na membrana bacteriana externa. Para tanto,
foram empregadas soluções dos corantes em concentrações fixas com bactérias
gram-negativas, aumentando gradativamente a concentração do CaCl2 com
simultânea exposição à luz vermelha de um laser. A sobrevivência bacteriana e a
espectrofotometria foram empregadas para descrever o efeito do Ca2+ na interação
do corante com a bactéria e com o LPS. Como resultado observou-se que o azul de
51
metileno teve sua ação fotobactericida inibida mais significativamente em relação ao
azul de orto-toluidina. Além disso, o CaCl2 foi capaz de suprimir a reação
metacromática entre os corantes e o LPS, especialmente a do azul de orto- toluidina,
comportando-se como um inibidor do efeito fotobactericida por ligar-se com o LPS.
Assim, o LPS parece estar mais envolvido com o efeito fotobactericida do azul de
orto-toluidina enquanto as proteínas da membrana externa das bactérias gramnegativas estão mais provavelmente envolvidas com a morte bacteriana fotoinduzida
mediada pelo azul de metileno (USACHEVA et al., 2006).
Suspensões de Candida albicans, Candida dubliniensis, Candida krusei e
Candida tropicalis contendo 106 células viáveis por mL foram irradiadas com diodo
laser (685 nm) e densidade de energia de 28 J/cm2 na presença do
fotossensibilizador azul de metileno (0,1 mg/mL). A irradiação com luz laser na
presença deste fotossensibilizador foi capaz de reduzir em 88,6% o número de
UFC/mL para C. albicans, 84,8% para C. dubliniensis, 91,6% para C. kruzei, e
82,3% para C. tropicalis. Apesar disso, somente a irradiação ou azul de metileno,
isoladamente, não reduziram significativamente o número de UFC/mL das amostras
de Candida (exceto para C. tropicalis que apresentou redução no número de
UFC/mL no grupo tratado somente com laser. Pôde-se concluir que a fotoativação
do azul de metileno pela luz vermelha em 685 nm apresenta um efeito fungicida em
todas as espécies de Candida estudadas (SOUZA et al., 2006).
Um estudo avaliou o efeito bactericida da luz de comprimento de onda de 405
e 470 nm, in vitro, para cepas de S. aureus, P. aeruginosas e Propionibacterium
acnes. Está bem documentado que a radiação ultravioleta produz efeito bactericida,
no entanto, estudos recentes sugerem que a luz azul também pode promover um
efeito similar. Os efeitos da luz azul parecem variar de acordo com o comprimento
de onda, densidade de energia e natureza da bactéria. Empregando doses de
energia de 1, 3, 5, 10 e 15 J/cm2 , fornecidas por um diodo super luminescente com
pico de emissão em 405-470 nm, os microrganismos previamente citados, foram
irradiados e a contagem de colô nias foi comparada com o grupo controle não
irradiado. Como resultado observou-se que a luz 405 nm produziu um efeito
bactericida dose dependente para os microrganismos aeróbios, obtendo-se taxas de
morte de 95,1% para S. aureus e 90% para P. aeruginosa. A luz a 470 nm
apresentou efeito bactericida para P. aeruginosa sob qualquer dose de energia,
enquanto que os S. aureus necessitaram das maiores doses de energia (10 e
52
15 J/cm2) para serem sensibilizados até a morte. Já Propionibacterium acnes não
foram suscetíveis a nenhum dos comprimentos de onda testados (GUFFEY;
WILBORN, 2006).
Um estudo foi realizado a fim de comparar a efetividade da terapia
fotodinâmica antimicrobiana e o tratamento endodôntico convencional. Bactérias
gram-negativas bioluminescentes estáveis, P. aeruginosa e Proteus mirabilis, foram
inoculadas em canais radiculares de dentes humanos recém extraídos, formando
biofilmes. Posteriormente a PDT foi empregada utilizando-se um fotossensibilizador
conjugado de polietilenimine e clorina (e6) irradiado com um diodo laser 600 nm
conduzido por fibra ótica. Este tratamento reduziu em 95% a bioluminescência
bacteriana enquanto o tratamento convencional reduziu o índice a 90%. Os dois
métodos conjugados (tratamento convencional mais PDT antimicrobiana) reduziram
em 98% a bioluminescência, o que indica que a PDT antimicrobiana pode ser uma
forma eficiente de monitorar a terapia endodôntica, com um papel importante para a
otimização do tratamento (GARCEZ et al., 2007).
Os vírus estão entre os mais perigosos contaminantes infecciosos em
doadores de sangue e dos derivados do sangue. Sabendo-se da importância do
controle
destes
agentes
foi
realizado
estudo
investigativo
analisando
as
propriedades de inativação do vírus influenza empregando suspensões de fullerene
C60 através de PDT. Observou-se que os fullerenos insolúveis em água podem ser
considerados como uma alternativa para a inativação de vírus envelopados
presentes em materiais biológicos, incluindo os produtos derivados do sangue
(ZARUBAEV et al., 2007).
Considerando que as leveduras de C. albicans são as principais causadoras
da candidíase mucocutânea orofarígea e que o emprego de fotossensibilizadores na
região colorem os dentes, lábios e mucosa bucal, realizou-se um estudo a fim de
desenvolver e caracterizar um mucoadesivo patch contendo azul de orto-toluidina.
Nesta forma, o fotossensibilizador seria administrado apenas no local alvo e
causaria uma fotodestruição seletiva das células microbianas, quando da aplicação
da luz. Além disso, o estudo concluiu que curtos períodos de aplicação de
mucoadesivo patches contendo azul de orto-toluidina poderiam ser úteis para tratar
candidíase orofarígea recentemente adquirida, causada somente por células
planctônicas. Longos períodos de aplicação são requeridos para doença em que há
presença de biofilmes (DONNELLY et al., 2007).
53
Outro estudo envolvendo C. albicans foi realizado a fim de avaliar o efeito da
terapia fotodinâmica antimicrobiana como tratamento potencial impedindo a
formação do tubo germinativo desta espécie. Considerando-se que a formação do
tubo germinativo representa um fator de virulência para a cepa, induziu-se a
formação dessa estrutura empregando-se soro de cabra como indutor, depois de
diferentes tratamentos com azul de metileno e laser (683 nm). Demonstrou-se que
a PDT, empregando azul de metileno como fotossensibilizador, foi capaz de inibir
o crescimento e a formação do tubo germinativo de C. albicans. Este achado
sugere a possibilidade do azul de metileno, em associação com luz de um
comprimento de onda específico, ser empregado como um novo agente antifúngico
(MUNIN et al., 2007).
1.4.5 Considerações gerais sobre os microrganismos empregados no
estudo: Staphylococcus aureus, Staphylococcus epidermidis e Candida
dubliniensis
A pele é um órgão que atua como barreira de proteção contra agentes
químicos, físicos e microbiológicos e, no adulto, recobre, em média, mais de
7.500 cm2 de área de superfície (JACOB; FRANCONE; LOSSOW, 1990). Quando a
integridade cutânea é rompida, os indivíduos ficam mais suscetíveis aos
microrganismos, possibilitando a ocorrência de infecções. Se o paciente encontra-se
em nível hospitalar, a exposição aos microrganismos torna-se ainda mais crítica.
Este fato é atribuído, especialmente, ao aumento do número de cepas resistentes
aos antibióticos. Estes microrganismos acometem, freqüentemente, pacientes com
doença de caráter prolongado, hospitalizados por longos períodos ou, ainda,
àqueles submetidos a internações freqüentes, sujeitos a uma alta taxa de
mortalidade (HOLMBERG; SOLOMON; BLAKE, 1987).
O aumento da prevalência da resistência aos antibióticos em meio hospitalar
tem sido atribuído às alterações na freqüência relativa de bactérias resistentes, ao
elevado número de doentes imunodeprimidos e às variações nas práticas de
administração de antibióticos (McGOWAN, 1987).
54
Dentre os gêneros de microrganismos responsáveis por causarem infecções
de pele e mucosas podem ser destacados Staphylococcus e Candida, bactérias
gram-positivas e fungos leveduriformes, respectivamente.
Quanto
ao
gênero
Staphylococcus,
responde
por
várias
infecções
dermatológicas de prevalência. São bactérias esféricas que aparecem como cachos
de uva quando observadas à microscopia. Anaeróbias facultativas podem crescer
pela fosforilação oxidativa ou pela fermentação do ácido lático (TRABULSI;
ALTERTHUM, 2004/2005). Estas bactérias não formam esporos e podem sobreviver
em muitas condições não fisiológicas. Em 20% a 30% dos adultos saudáveis são
encontradas nas narinas e na pele. Com menor freqüência, podem ser encontradas
na boca, glândulas mamárias, sistema genito-urinário, intestinal e respiratório
superior. As infecções estafilocócicas são geralmente supurativas (com produção de
pus) (LEVINSON; JAWETZ, 2005, NISENGARD; NEWMAN, 1994).
A espécie S. aureus é uma das mais importantes dos Staphylococcus, sendo
responsável por provocar uma variedade de infecções. É o membro mais virulento e
mais bem conhecido do gênero (MURRAY et al., 2002). S. aureus é diferenciado das
outras espécies do gênero principalmente pela produção de coagulase (uma enzima
que coagula o plasma por ativação da protrombina). Ainda, pode fermentar o manitol
e hemolisar o sangue, o que não ocorre com as outras espécies (LEVINSON;
JAWETZ, 2005).
S.aureus pode causar lesões superficiais na pele tais como furúnculo,
foliculite, impetigo, carbúnculos e infecções de ferimentos. Outras mais sérias podem
ser observadas: endocardite, mastite, flebite, meningite, osteomielite, infecções do
trato urinário, das vias aéreas superiores, pneumonia e septicemia (TORTORA;
FUNKE; CASE, 2005, MURRAY et al., 2002). Além disso, S. aureus pode provocar
doenças mediadas por toxinas (intoxicação alimentar, síndrome do choque tóxico)
(MURRAY et al., 2002).
Das infecções de pele que podem ter como agente causal microrganismos do
gênero Staphylococcus pode-se citar o impetigo. Uma infecção bacteriana superficial
da pele, mais freqüentemente encontrada em crianças, que não apresenta terapia
padrão. O manejo clínico, desta forma, se dá com antimicrobianos orais e tópicos,
além de anti-sépticos. Ao isolar-se Staphylococcus aureus de lesões bolhosas e
erodidas, diagnosticadas como impetigo, o tratamento tópico com tetraciclina
(agente antimicrobiano de amplo espectro) foi instaurado e demonstrou efetividade
55
para 22 de 28 pacientes. Este resultado foi comparado a um grupo controle que
usou tratamento via oral empregando outros antibióticos e, com a análise dos
resultados, observou-se que não houve diferença significativa entre os dois grupos,
o que permitiria o uso tópico de antimicrobianos para o tratamento de impetigo, sem
ocorrência de prejuízos clínicos (KUNIYUKI et al., 2005).
Outras infecções, como celulite, causadas comumente por S. aureus e
Streptococcus pyogenes, despertam interesse quanto ao desenvolvimento de um
tratamento tópico eficiente. A erisipela, uma forma de celulite com pronunciada
inflamação superficial que afeta, tipicamente, a face e membros inferiores é uma
infecção com potencial recorrência, que gera inúmeros desconfortos aos pacientes
(MORRIS, 2007).
S. aureus, há tempos, são reconhecidos como agentes freqüentes de
infecções cutâneas. O potencial patogênico deste microrganismo está associado à
diferenciada capacidade de mutação para formas resistentes, o que tem sido o
maior problema para o tratamento de infecções causadas por este microrganismo.
Esta variação exige a realização de avaliações periódicas do perfil de sensibilidade
aos antimicrobianos demonstrado pela espécie S. aureus (BARRAVIERA, 1994).
Neste sentido o conhecimento da epidemiologia desse microrganismo contribui para
o controle, prevenção e tratamento de infecções. As técnicas moleculares são
importantes ferramentas nas investigações de surtos e no estudo da epidemiologia
global, não somente para S. aureus, mas também, para muitos outros patógenos
(VIVONI; MOREIRA, 2005).
Outra espécie clinicamente importante do gênero Staphylococcus é S.
epidermidis. Ao contrário dos S. aureus, S. epidermidis não produzem toxinas.
Dessa maneira, não são capazes de causar envenenamento alimentar ou síndrome
do choque tóxico. No entanto, podem causar infecções piogênicas mobilizando uma
resposta neutrofílica. S. epidermidis são referidos como estafilococos coagulasenegativa e estão regularmente presentes na pele normal e nas membranas mucosas
(HENNIN; WAI; ZIEBUHR, 2007, LEVINSON; JAWETZ, 2005).
Dispondo das características morfológicas típicas do gênero, S. epidermidis
são importantes agentes em infecções nosocomiais. Por estarem presentes na flora
normal da pele, estes microrganismos podem causar uma infecção oportunista
durante ou após o desenvolvimento de procedimentos invasivos (VON EIFF;
PETERS; HEILMANN, 2002). A espécie adere-se à superfície de dispositivos e é
56
capaz de formar biofilmes. Isto é um importante fator de virulência sendo
considerado o principal responsável pela patogênese do S. epidermidis (HENNIN;
WAI; ZIEBUHR, 2007). Bactérias em biofilmes são mais resistentes a antibióticos e à
defesa do sistema imune do hospedeiro, sugerindo que células em biofilmes podem
ter seu metabolismo alterado (CERCA et al., 2005). A forte resistência requer a
remoção regular do biomaterial infectado e conduz a uma morbimortalidade
substancial (MACK et al., 2004).
As infecções causadas por S. epidermidis são quase sempre de origem
hospitalar, observadas como a principal causa de sepse em recém-nascidos,
peritonite em pacientes com falência renal que sofreram diálise peritoneal, além de
que algumas cepas produtoras de glicocálice são mais propensas a aderir
biomateriais (próteses) (LEVINSON; JAWETZ, 2005).
Não
obstante
à
evidência
de
inúmeras
patologias
causadas
por
microrganismos, o presente fato do imunocomprometimento de pacientes portadores
do vírus HIV preocupa profissionais das ciências médicas e biológicas, que buscam
promover o controle de patógenos que, nestes pacientes, podem causar sérias
infecções (NEIDLE; YAGIELA, 1991).
As leveduras do gênero Candida são importantes por colonizarem e
infectarem o hospedeiro humano (ODDS; BERNAERTS, 1994). A espécie C.
dubliniensis, descrita em 1995 (SULLIVAN; COLEMAN, 1998), foi primeiramente
associada à candidíase oral em pacientes imunocomprometidos infectados com o
vírus HIV. Mais recentemente tem sido reconhecida como causa de doença
superficial e sistêmica em pacientes imunocomprometidos não infectados pelo vírus
da imunodeficiência humana (BRANDT et al., 2000, MEIS et al., 1999). A ocorrência
de alterações nos mecanismos de defesa dos hospedeiros e o comprometimento de
barreiras anatômicas por queimadura ou procedimentos invasivos favorecem a
mudança de condição destas leveduras e o aparecimento de infecções é facilitado
(DIGNANI; SOLOMKIN; ANAISSIE, 2003).
O diagnóstico da espécie C. dubliniensis tem se demonstrado complexo
especialmente devido à similaridade demonstrada em relação ao fenótipo observado
para a espécie C. albicans. Além disso, a presença de leveduras deste gênero como
microrganismos comensais na flora vaginal, por exemplo, gera imprecisão na
interpretação clínica. Há dúvidas se estes microrganismos estão presentes em
quantidades de significância patológica ou apenas correspondem a agentes da
57
microbiota normal. Neste caso, é imprescindível combinar várias provas micológicas
para realizar a discriminação entre as cepas de C. albicans e C.dubliniensis, a fim de
estabelecer a significância clínica e epidemiológica da Candida dubliniensis
(patógeno oportunista) (LANCHA et al., 2006).
Inúmeras
metodologias
vêm
sendo
estudadas
buscando
facilitar
a
identificação da espécie C. dubliniensis. Ágar suco de tomate (ágar V8) foi
empregado na identificação presuntiva desta cepa, baseando-se na produção de
clamidoconídeos. Foram incluídos no estudo 93 isolados de C. albicans e 26 de C.
dubliniensis, sendo que 100% de C. dubliniensis formaram clamidoconídeos e 92,
5% de C. albicans não evidenciaram estas estruturas. Pôde-se sugerir que este
meio de cultura poderia ser empregado como recurso alternativo na identificação
presuntiva de C. dubliniensis (ALVES et al., 2006).
Além das semelhanças fenotípicas à C. albicans, C. dubliniensis é um
microrganismo de interesse médico devido à resistência demonstrada frente aos
azóis. Primariamente associada com a colonização oral e infecção em indivíduos
infectados com o vírus HIV, os isolados de C. dubliniensis foram suscetíveis e estes
agentes antifúngicos. Entretanto, têm sido observadas amostras clínicas resistentes
aos antifúngicos convencionais tais como fluconazol e itraconazo. Além disso, a
resistência já foi observada para cepas expostas in vitro às drogas. Os mecanismos
moleculares de resistência incluem aumento do efluxo da droga, modificações das
enzimas alvo e alterações na via biossintética do ergosterol (PINJON et al., 2005).
58
2 OBJETIVOS
Foram objetivos deste estudo:
•
Avaliar a atividade antimicrobiana in vitro dos extratos brutos hexânico e
etanólico de A. brasiliana (planta total);
•
Proceder o preparo de formulações tópicas contendo os extratos bioativos
de A. brasiliana e avaliar a atividade antimicrobiana das formulações
obtidas;
•
Estudar o efeito antimicrobiano in vitro dos extratos e das formulações
tópicas contendo A. brasiliana em associação com Laser de baixa
potência, avaliando o efeito destas preparações farmacêuticas como
fotossensibilizadores naturais em PDT antimicrobiana.
59
3 MATERIAL E MÉTODOS
3.1
Coleta, classificação e obtenção do material vegetal
O material vegetal de Alternanthera brasiliana (L.) O. Kuntze planta in natura
foi coletado em seu hábitat natural – no Jardim Recreio, Ribeirão Preto, São Paulo,
pelos Professores Doutores: Diones Aparecida Dias (FCFRP/USP) e Marcos José
Salvador (Curso de Farmácia/IB/UNICAMP), sendo a identificação botânica efetuada
pelo professor Dr. Josafá Carlos de Siqueira da PUC (Pontifícia Universidade
Católica) do Rio de Janeiro (RJ). Uma amostra do material foi depositada no
herbário da Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto/USP
(número de registro DAD 0027).
3.2
Preparação dos extratos brutos
Para a preparação dos extratos brutos o material vegetal (planta total) passou
por secagem em estufa de ar circulante à temperatura de 40°C, em seguida foi
pulverizado em moinho de faca. O pó obtido foi, então, submetido ao processo de
maceração com solventes orgânicos (Figura 2) em ordem crescente de polaridade
(hexano para baixa polaridade e etanol para alta polaridade), na proporção massa de
pó/solvente 1:20 (massa/volume). Das soluções obtidas, foram removidos os
solventes (sob pressão reduzida), obtendo-se assim, os extratos brutos em hexano
(AbptH) e em etanol (AbptE).
60
Vegetal estabilizado e seco
(planta total)
extração com hexano à
quente, temperatura = 50ºC
Extrato em hexano (Abpth)
Resíduo
extração com etanol
Extrato em etanol (Abpte)
Figura 2: Esquema da preparação dos extratos brutos extraídos em solventes orgânicos.
3.3
Elaboração de formulações farmacêuticas semi-sólidas para uso
tópico
Os experimentos para a elaboração de formulações farmacêuticas semisólidas contendo os extratos vegetais bioativos foram realizados na Farmácia Escola
da UNOCHAPECÓ – Chapecó, SC.
Inicialmente foram elaborados procedimentos para o preparo de formulações
tópicas compatíveis à incorporação dos extratos de A. brasiliana seguindo o
protocolo experimental descrito por Georgetti et al. (2006) e Agência (2004), com
adaptações. Outras referências bibliográficas também foram empregadas no
delineamento do desenvolvimento do protocolo experimental de preparo das
formulações (ANSEL; POPOVICH; ALLEN, 2000; FARMACOPÉIA BRASILEIRA,
1988; PRISTA; ALVES, 1967).
61
3.3.1 Procedimento geral de manipulação
Seguindo as exigências das boas práticas em farmácia magistral, realizou-se
antissepsia das mãos e paramentação (retirada de adornos, seguida de uso de
equipamentos de proteção individual tais como jaleco de mangas longas, touca,
máscara, pro-pés, luvas para procedimentos) adequadas.
Antes de iniciar o preparo das formulações farmacêuticas, foi realizada
desinfecção das embalagens plásticas não transparentes, onde posteriormente
foram armazenadas as formulações finais (empregou-se sabão neutro e álcool a
70%). A assepsia das bancadas foi realizada empregando-se álcool a 70%. Foram
selecionadas as matérias primas necessárias (armazenadas em almoxarifado sob
condições controladas de temperatura e umidade) sendo possível iniciar o
desenvolvimento das formulações semi-sólidas para uso tópico.
3.3.2 Preparação da base creme (formulação controle – sem
extrato)
Para o preparo da base creme foram realizados cálculos a fim de definir a
quantidade de cada substância a ser pesada, realizando-se posteriormente o
procedimento de pesagem em balança analítica.
Os componentes da emulsão foram pesados separadamente e classificados
em duas fases distintas: fase aquosa e fase oleosa (Tabela 1). Em dois beckers,
ambas as fases foram aquecidas até 70°C, em Banho Maria. Em seguida, a fase
interna (fase oleosa) foi vertida sobre a fase externa (fase aquosa), sob agitação e o
produto foi retirado do aquecimento.
Como as emulsões não se formam espontaneamente quando as duas fases
líquidas são misturadas, a efetivação do procedimento requer o fornecimento de
energia adicional ao sistema, e, neste caso, um agitador mecânico foi empregado.
Sob agitação periódica e suave, o creme foi perdendo calor até alcançar uma
temperatura adequada (35°C – 40°C) e começou a adquirir consistência. Neste
62
momento, foram adicionados o ciclometicone, o conservante, o óleo de macadâmia
e, com auxílio de um bastão de vidro, a base foi homogeneizada.
Ao final do procedimento, mediu-se o pH (com fita indicadora de pH) e,
posteriormente, uma amostra (30 g) do creme foi embalada em bisnaga plástica não
transparente, e rotulada, enquanto o restante do produto foi empregado para a
incorporação dos extratos de A. brasiliana.
3.3.3 Preparação da base gel creme base (formulação controle –
sem extrato)
a) Preparo do gel
Inicialmente foi preparada, em um becker, uma solução de carbopol,
dispersando-se o agente gelificante em água destilada. Após o acréscimo de EDTA,
o pH da dispersão foi ajustado para 7,0 empregando-se uma substância basificante
(AMP), que auxiliou para o ganho da consistência característica de gel. Muitos géis
não favorecem o crescimento de bactérias e fungos, mas também não o evitam.
Assim, eles necessitam a adição de conservantes (ALLEN JR., 2004). O Phenonip®,
uma mistura de parabenos conservadores, foi dissolvido em propilenoglicol e
posteriormente misturado, cuidadosamente, ao gel, evitando a incorporação de ar.
b) Preparo da loção não-iônica
A loção não-iônica foi preparada empregando-se os mesmos componentes e
a mesma metodologia adotada para o preparo do creme base. No entanto, as
concentrações do polawax e do álcool cetoestearílico foram reduzida em 40%, o que
conferiu à loção uma consistência menor àquela observada para o creme. Os outros
componentes tiveram sua proporção mantida. A diferença do pecentual de base
auto-emulsificante e do doador de consistência foi compensada pelo veículo (Tabela
1).
63
c) Preparo final da base gel creme
Após a conclusão de ambas as etapas de preparo (do gel e da loção nãoiônica), verteu-se o gel sobre a loção, com homogeneização adequada, obtendo-se
o produto final desejado – a base gel creme.
Ao término da manipulação, verificou-se o pH da formulação e uma amostra
(30 g) foi embalada em bisnaga de plástico não transparente e rotulada. O restante
da base foi reservada para incorporação dos extratos bioativos de Alternanthera
brasiliana.
Tabela 1: Composição percentual das formulações base Gel Creme e Creme (q.s.p. 30 g)
Emulsão
Fase oleosa
Componentes
Creme
%
%
Base autoemulsionante
6
10
Vaselina líquida
Emoliente
3
3
BHT
Antioxidante
0,05
0,05
Álcool
cetoestearílico
Doador de
consistência
3
5
Óleo de
macadâmia
Emoliente
2
2
Ciclometicone
volátil
Doador de brilho/
formador de
película
2
2
EDTA
Sequestrante
-
0,19
Conservante
0,04
0,1
2,4
6
71,66
®
Propilenoglicol
Umectante
Água destilada
Veículo
21,32
AMP
Basificante
0,01
Sequestrante
0,19
EDTA
Carbopol
Gel
Gel creme
Polawax
Phenonip
Fase aquosa
Função
farmacotécnica
®
Espessante
1
Umectante
3,6
ultrex 10
Propilenoglicol
Phenonip
®
Água destilada
Conservante
0,06
Veículo
55,33
64
3.3.4 Incorporação dos extratos bioativos às bases creme e gel
creme
Inicialmente, foram pesados os extratos etanólico (AbptE) e hexânico (AbptH)
de A. brasiliana planta total, almejando obter a proporção de 5, 50 e 100 mg de
extrato a cada grama de base creme ou gel creme, da formulação preparada.
Após a pesagem, os extratos foram micronizados (levigados) em um gral,
com auxílio de um pistilo, empregando-se o solvente propilenoglicol. De acordo com
a quantidade de extrato a ser incorporada nas bases, a quantidade necessária do
agente levigante foi variável. Continuando o processo, vagarosamente, uma parte da
base foi acrescentada ao gral onde o extrato estava contido e, aos poucos, foi
incorporando-o mediante constante homogeneização. Até que toda a base (q.s.p.
30g ou 10g) recebesse uniformemente o extrato, foi necessário continuar a
homogeneização da mistura, com auxílio de uma espátula. Ao final das
incorporações de todas as frações de extratos, verificou-se o pH das formulações
empregando-se fita indicadora.
Para conservação, as formulações foram embaladas em bisnagas plásticas
não transparentes, e rotuladas. Foram manipuladas, 6 formulações farmacêuticas
com base creme contendo 0,5%, 5% e 10% dos extratos AbptE ou AbptH e 6
formulações gel creme contendo 0,5%, 5% e 10% dos extratos AbptE ou AbptH
(Tabela 2).
Foram elaboradas também formulações creme e gel creme base com e sem a
adição de agentes conservantes (metilparabenos, Phenonip®) e sem a adição dos
extratos para servirem como formulações controle negativo.
65
Tabela 2: Composição das formulações farmacêuticas contendo extrato AbptE ou AbptH de
Alternanthera brasiliana
Formulação
AbptE
AbptH
Creme
Gel Creme
(g)
Quantidade
de extrato
(%)
01
0,15
-
29,85
-
0,5
02
1,5
-
28,5
-
5
03
1,0
-
9,0
-
10
04
-
0,15
29,85
-
0,5
05
-
1,5
28,5
-
5
06
-
1,0
9,0
-
10
07
0,15
-
-
29,85
0,5
08
1,5
-
-
28,5
5
09
1,0
-
-
9,0
10
10
-
0,15
-
29,85
0,5
11
-
1,5
-
28,5
5
12
-
1,0
-
9,0
10
3.3.5
Análises organolépticas das formulações farmacêuticas
tópicas
As análises organolépticas consistiram na avaliação dos parâmetros de cor,
odor, textura das formulações tópicas, utilizando-se dos sentidos da visão, olfato e
tato.
66
3.4 Análise físico-química das formulações
3.4.1 Análise do potencial hidrogeniônico (pH)
A análise do pH das formulações foi realizada após o término do
procedimento de manipulação, empregando-se o método colorimétrico (fita
indicadora de pH).
3.4.2 Análise de estabilidade
A avaliação da estabilidade das formulações tópicas foi realizada de acordo
com Agência (2004), em ensaio de centrifugação.
Para o ensaio de centrifugação 50 mg das amostras foram diluídos em 1mL
de água e posteriormente centrifugados a 2800 rpm por um período de 5 min.
Foram avaliadas as seguintes amostras:
•
Extrato etanólico
•
Extrato hexânico
•
Base creme
•
Base gel creme
•
Creme contendo 5% de extrato etanólico (Formulação 2)
•
Creme contendo 5% de extrato hexânico (Formulação 5)
•
Gel creme contendo 5% de extrato etanólico (Formulação 8)
•
Gel creme contendo 5% de extrato hexânico (Formulação 11)
A leitura do teste de centrifugação se deu observando-se a separação de
fases nas amostras avaliadas, bem como a ausência desta característica. A
presença de precipitado serviu de parâmetro para comprovar o fenômeno da
instabilidade.
67
3.5 Avaliação da absorção na região visível do espectro eletromagnético
O espectro de absorção (400 a 700 nm) foi obtido no Laboratório de
Biofotônica e Óptica Não Linear do IP&D/UNIVAP, determinando-se a região de
absorção dos extratos hexânico e etanólico e das formulações creme e gel creme
contendo os extratos (Figura 3) (Formulações preparadas em menor concentração 0,5% - Formulações 1, 4, 7 e 10). Foram realizados dois experimentos isolados, um
deles visando observar o perfil de absorção dos extratos e sua aplicabilidade como
fotossensibilizadores aplicáveis em PDT; o outro almejando excluir a possibilidade
das bases farmacêuticas apresentarem em sua composição substâncias capazes de
absorver luz na região visível do espectro eletromagnético.
Como controles foram utilizados:
•
Controle positivo para PDT: Azul de metileno 50 mg/mL;
•
Controle negativo: Solvente - Água: propilenoglicol (95:5);
•
Controle negativo: Formulações base com conservante - Creme e Gel creme,
sem extratos.
Figura 3: Amostras analisadas por varredura na região visível do espectro
eletromagnético
68
Para a medida dos espectros de absorção, a luz transmitida pela amostra foi
acoplada a um espectrômetro de ¼ m (Oriel Instruments, modelo MS257), com
grade de difração de 300 linhas /mm. Um detector tipo CCD (Charge Coupled
Device) intensificado com 256 x 1024 pixels foi conectado à saída de detecção do
monocromador (Figura 4). Cada medida foi realizada com a acumulação de 100
aquisições e foram realizadas 10 medidas para cada amostra.
Figura 4: Equipamentos empregados nas medidas espectrofotométricas, na região visível do
espectro eletromagnético
69
3.6 Avaliação da atividade antimicrobiana in vitro
Os ensaios biológicos in vitro frente a bactérias (Gram positivas) e fungos
leveduriformes foram realizados no laboratório de Produtos Naturais e Bioensaios e
de Microbiologia da UNIVAP.
A ação antibacteriana e antifúngica foi determinada pelo método de difusão
em ágar pela técnica de poço em camada dupla e pelo método de microdiluição
(ESPINEL-INGROFF et al., 1995, GROVE; RANDALL, 1955, OKEKE et al., 2001;
NCCLS, 1993, NCCLS, 1998,) seguindo a adequação de metodologia como descrita
por Salvador (2005), Salvador et al. (2004) e Salvador et al. (2003).
a) Cepas bacterianas
Para a execução dos ensaios foram utilizadas bactérias gram-positivas, cepas
padrão, cultivadas por 24 horas a 37ºC em Müller Hinton (Difco) - MHb:
•
Staphylococcus aureus – ATCC 14458
•
Staphylococcus epidermidis – ATCC 12228
b) Cepas fúngicas
Foram empregados fungos leveduriformes, cepas padrão, cultivadas por 24
horas a 37ºC em ágar Sabouraud dextrose - ASD.
•
Candida dubliniensis – ATCC 777
•
Candida dubliniensis – ATCC 778157
Na etapa de triagem empregou-se o método de difusão em Ágar, técnica do
poço, determinando quais os extratos apresentavam ou não efeito antimicrobiano.
Para tanto, procedeu-se o plaqueamento das bactérias em que foram utilizados 20,0
mL de meio Müller Hinton (Difco) - MHa, a cerca de 50°C, inoculados (5x106 ufc/mL),
independentemente, com as cepas de bactérias em placas de 20 x 150 mm. A
seguir foram confeccionados poços com 5,0 mm de diâmetro. Para o plaqueamento
das leveduras foi empregada uma mistura contendo 20,0 mL de ágar base glicosado
duas vezes concentrado e 20,0 mL da solução contendo meio RPMI 1640 (Gibco BRL) duas vezes concentrado e tampão MOPS, a cerca de 50°C, inoculados
70
(5.106 ufc/mL), independentemente, com as cepas de leveduras em placas de
20 x 150 mm. Em seguida foram confeccionados poços com 5,0 mm de diâmetro.
Em cada poço foram aplicados 20 µL das soluções controle (positivo e
negativo) e drogas-teste, soluções estas preparadas em propilenoglicol/água estéril
(5:95) nas concentrações de 100 mg/mL para os extratos brutos no screening. Como
controle positivo para as bactérias foi utilizada bacitracina (20 UI/mL) e para as
leveduras cetoconazol (200 µg/mL); e como controle negativo propilenoglicol/água
destilada esterilizada (5:95).
As placas-testes foram mantidas à temperatura ambiente por cerca de 2
horas e, depois, incubadas a 37ºC por cerca de 24/48 horas para as bactérias e
leveduras, respectivamente. Decorrido o período de incubação, as zonas de inibição
do desenvolvimento microbiano foram mensuradas em termos de diâmetro (halo) e
aro da borda do poço a início do desenvolvimento, em milímetros. Os valores de
halos de inibição observados variaram de 8 a 14mm, enquanto os aros variaram de
2 a 8 mm.
Para os extratos que se mostraram ativos na concentração de 100 mg/mL,
procedeu-se a determinação da Concentração Inibitória Mínima (CIM), realizada
pelo método de microdiluição em placa de 96 poços, seguindo o protocolo
preconizado pela ANVISA (AGÊNCIA, 2004).
Em uma placa de microdiluição estéril de 96 poços, em poços individuais foi
aliquotado 50 µL dos caldos Sabouraud-Dextrose (ASD), 50 µL das drogas teste em
diferentes concentrações (100 a 0,050 mg/mL), controles e 5µL da suspensão de
microrganismos com turvação equivalente ao padrão 0,5 da escala de Mc Farland, o
que corresponde aproximadamente a 107 UFC/mL (foi realizada a contagem do
inoculo para cada cepa estudada).
Ao término do período de incubação a 37°C por cerca de 24/48 horas,
procedeu a leitura visual da turvação nos poços correspondente a cada uma das
concentrações testadas e quando em dúvida quanto à presença de inibição total, o
material foi inoculado (estrias) em placas contendo meio Ágar Sabouraud-Dextrose
(ASD) e incubadas a 37°C por cerca de 24/48 horas para a verificação se o efeito era
biocida ou não, ou seja, verificou-se o crescimento ou não do microrganismo. Foi
considerada como CIM, com valores expressos em mg/mL, a menor concentração
onde se observo u a presença de inibição do desenvolvimento microbiano
71
(SALVADOR et al., 2002; OKEKE et al., 2001). Os experimentos foram realizados
pelo menos em duplicata, para cada cepa indicadora utilizada.
3.7 Avaliação
dos
extratos
e
de
formulações
tópicas
contendo
Alternanthera brasiliana como fotossessibilizadores naturais
Os ensaios foram realizados no laboratório de Produtos Naturais e Bioensaios
da UNIVAP, seguindo o protocolo experimental descrito por Souza et al. (2006) com
modificações.
Quanto ao laser, foram estudadas as condições de operação (tipo de laser,
comprimentos de onda, dentre outros parâmetros) e avaliou-se
o
efeito
antimicrobiano da associação laser/extratos e/ou laser/formulações tópicas contendo
os extratos.
3.8 Equipamento Laser
Foi utilizado o equipamento laser diodo InGaAlP (meio ativo fosfeto de índiogálio-alumínio) modelo Photon Lase (DMC equipamentos), que opera com
comprimento de onda de emissão de 685 nm, localizado na faixa de luz visível,
região do vermelho do espectro eletromagnético (Figura 5).
72
Figura 5: Equipamento laser Photon Lase®
Em uma placa de microdiluição estéril de 96 poços, em poços individuais, foi
aliquotado 50 µL dos caldos Tryptone Soy Broth -TSb (para as cepas de bactérias)
ou Sabouraud dextrose-ASD (para as cepas de Levedura), 50 µL das drogas teste
(extratos vegetais ativos avaliados na concentração final sub-inibitória mínima (25 ou
2,5 mg/mL, dependendo do extrato) das formulações (5 mg de creme ou gel
creme/mL, contendo os extratos a 5%, o que corresponde a 0,25 mg de extrato/mL)
ou dos controles foram adicionados. Posteriormente, foi acrescentado 5 µL da
suspensão de microrganismos com turvação equivalente ao padrão 0,5 da escala de
McFarland, o que corresponde aproximadamente a 107 UFC/mL (foi realizada a
contagem do inóculo para cada cepa estudada). Quando da adição do inóculo
homogenizou-se o conteúdo do poço e as drogas testes foram deixadas interagir
com os microrganimos por 2 minutos para dar seqüência à irradiação.
Como controles positivos foram utilizados o fotossensibilizador corante azul
de metileno (50 µg/mL) diluído em salina estéril, bacitracina (20 UI/mL) e
cetoconazol (200 µg/mL). Como controles negativos foi utilizado o diluente
propilenoglicol/água (5:95), além do controle do inóculo, do controle do meio de
cultura e das formulações controle (creme base e gel creme base, com ou sem
conservantes).
73
Os experimentos foram realizados em duplicada para cada droga teste (intraensaio), sendo realizados três experimentos em três dias diferentes (n=6 por
amostra no total dos resultados inter-ensaios). Em cada ensaio foram prepraradas
duas placas de 96 pocos com as drogas-teste e controles, sendo que uma das
placas foi submetida à irradiação laser (λ=685 nm), grupo irradiado (L+) e a outra
não (placa controle, grupo não irradiado (L-), a qual não ficou exposta sequer à luz
ambiente).
Feito isto, procedeu-se a irradiação das placas do grupo irradiado. A
irradiação das amostras foi realizada em condições assépticas em fluxo laminar
(Figura 6) com laser (λ=685 nm) operando com densidade de energia de 28 J/cm2
por 5 min e área irradiada de 0,38 cm2 por amostra. Depois da irradiação, as placas
irradiada e controle foram incubadas a 37°C por cerca de 24/48 horas (para
bactérias e leveduras, respectivamente). Decorrido o período de incubação
procedeu-se a diluição seriada de 10-2 e 10-3 para cada uma das amostras em
solução fisiológica esterilizada e alíquotas de 10 µL foram plaqueadas em duplicata
no meio TSa ou ASD e incubadas. Após o período de incubação a 37°C por cerca
de 24/48 horas o número de unidades formadoras de colônias por mL (UFC/mL) foi
estimado e a porcentagem de redução de UFC/mL para cada microrganismo foi
calculada.
Figura 6: Ilustração da capela de fluxo laminar e aparato de irradiação
74
3.9 Análise estatística
Os resultados foram analisados estatisticamente, utilizando-se o teste
estatístico ANOVA, teste de Tukey, procedendo-se a comparação entre os valores
médios iniciais e finais de ufc/mL para cada droga teste bioativa frente a respectiva
cepa indicadora susceptível. As drogas testes que não apresentaram redução no
desenvolvimento microbiano não foram analisadas estatisticamente. Os resultados
foram apresentados como média (coeficiente de variação, %CV).
75
4 RESULTADOS
4.1 Preparação dos extratos brutos de Alternanthera brasiliana
Inicialmente foram obtidos os extratos brutos de A. brasiliana planta in natura,
para os quais foram calculados os rendimentos em massa (Tabela 3).
Tabela 3: Rendimento em massa dos extratos brutos obtidos de Alternanthera brasiliana
Alternanthera brasiliana
Extratos
Código
massa (g)
Planta total
Hexânico
AbptH
72,00 g
Etanólico
AbptE
165,00 g
Material vegetal estabilizado e seco
(11500 g)
Os extratos hexâ nico (AbptH) e etanólico (AbptE) foram submetidos à
avaliação da atividade antimicrobiana e determinou-se o valor de CIM para os
extratos ativos. Além disso, AbptH e AbptE foram incorporados em formulações
farmacêuticas
(creme
e
gel
creme)
para
posterior
avaliação
como
fotossensibilizadores naturais.
4.2 Elaboração de formulações farmacêuticas semi-sólidas para uso
tópico
As formulações farmacêuticas creme e gel creme foram preparadas e
acondicionadas em embalagens plásticas, não transparentes, que não influenciaram
na estabilidade do produto (Figura 7). Este material (opaco) foi preferido em relação
às demais opções, almejando proteger o produto da luminosidade ambiente. Além
disso, foram adicionadas substâncias antioxidantes (BHT) às formulações a fim de
retardar o processo oxidativo.
76
Figura 7: Embalagem final e rótulo das bases creme e gel creme
4.2.1 Avaliação
das
características
organolépticas
das
formulações farmacêuticas
A avaliação das características organolépticas ocorreu logo após o preparo
das formulações, observando-se coloração branca para as formulações base creme
e gel creme sem extratos (que não receberam corantes) e coloração verde clara
para as preparações em que foram incorporados os extratos. Foi observado odor
característico para as formulações em que os extratos foram incorporados. A textura
de todas as formulações demonstrou-se agradável ao toque .
77
4.2.2 Análises físico-químicas das formulações farmacêuticas
a) Potencial hidrogeniônico (pH)
O pH dos cremes e gel cremes desenvolvidos permaneceu na faixa de 5,0 e
5,5.
b) Ensaio de estabilidade
Teste de centrifugação
Quanto à avaliação da estabilidade das formulações, foi realizado o teste de
centrifugação, submentendo-se as preparações farmacêuticas a 2800 rpm durante 5
minutos, não sendo observada separação de fases para nenhuma das formulações.
Desta maneira, as formulações foram consideradas estáveis do ponto de vista físicoquímico (Figura 8, Figura 9, Figura 10, Figura 11 e Figura 12). Entretanto, os
extratos brutos mostraram-se instáveis no ensaio de centrifugação, conduzindo à
separação de fases. Portanto a incorporação dos extratos hexânico e etanólico à
formulação creme e gel creme estabilizou este sistema disperso.
Figura 8: Formulação 2 – creme contendo extrato AbptE 5% e formulação 8 – gel creme
contendo extrato AbptE 5% submetidas ao ensaio de centrifugação
78
Figura 9: Formulação 5 – creme contendo extrato AbptH 5% e formulação 11 – gel creme
contendo extrato AbptH 5% submetidas ao ensaio de centrifugação
Figura 10: Bases creme e gel creme após teste de centrifugação a 2800 rpm.
79
Figura 11: Creme contendo 5% do extrato AbptE, gel creme contendo 5% de extrato AbptE
e extrato AbptE após teste de centrifugação a 2800 rpm. A seta indica o precipitado
decorrente da separação de fases.
Figura 12: Creme contendo 5% do extrato AbptH, gel creme contendo 5% de extrato AbptH
e extrato AbptH após teste de centrifugação a 2800 rpm. A seta indica o precipitado
decorrente da separação de fases.
80
Posteriormente ao ensaio de estabilidade, procedeu-se a obtenção do
espectro de absorção dos extratos e formulações na região do visível.
4.3 Avaliação da absorção na região visível do espectro eletromagnético
A espectroscopia óptica revelou o perfil absortivo do controle positivo
fotossensibilizador
azul
de
metileno;
do
controle
negativo
solvente
propilenoglicol:água, dos extratos etanólico (AbptE) e hexânico (AbptH) e das
formulações creme e gel creme contendo estes extratos (0,5%) e formulações base
controles. Tanto AbptE quanto AbptH absorveram luz na região espectral entre 600
e 700 nm (Figura 13).
Creme base
Gel creme base
Azul de metileno
Água: Propilenoglicol
AbptE
AbptH
Creme AbptH
Gel creme AbptH
Creme AbptE
Gel creme AbptE
3,5
Densidade Óptica (OD)
3,0
2,5
2,0
1,5
1,0
0,5
0,0
550
600
650
700
750
Comprimento de Onda (nm)
Figura 13: Espectroscopia de absorção: perfil dos extratos AbptE, AbptH, das formulações
creme contendo os extratos AbptE ou AbptH, gel creme contendo os extratos AbptE ou
AbptH, do controle positivo da PDT Azul de metileno, do controle negativo solvente
(Água:Propilenoglicol, 5:95, v/v) e do controle negativo das formulações sem extratos
(creme e gel creme).
81
As formulações contendo os extratos (5%) não demonstraram picos definidos
de absorção quando vistos na escala da Figura 13, no entanto, conhecendo-se o
perfil de absorção dos extratos, pode-se sugerir que este comportamento é
dependente da concentração. As formulações (amostras) empregadas para este
ensaio continham apenas 5% dos extratos. Quando se analisa em escala expandida
os espectros de absorção das formulações contendo os extratos, observa-se a
presença de picos de absorção de pequena intensidade na região de 650 e 700 nm
(Figura 14) atribuídos à presença dos extratos.
0,10
Creme AbptH
Gel creme AbptH
Creme AbptE
Gel creme AbptE
Densidade Óptica (OD)
0,08
0,06
0,04
0,02
0,00
550
600
650
700
750
Comprimento de Onda (nm)
Figura 14: Espectroscopia de absorção: perfil das formulações creme e gel creme contendo
os extratos AbptE ou AbptH.
Nos experimentos subseqüentes, apenas as preparações a 5% (50 mg de
extrato/g de formulação, p/p) foram empregadas.
82
4.4
Avaliação da atividade antimicrobiana in vitro
4.4.1 Determinação da concentração inibitória mínima (CIM)
A determinação da concentração inibitória mínima (CIM) foi realizada pelo
método de microdiluição em placa de 96 poços. Com isso pôde-se determinar a CIM
dos extratos frente aos microrganismos estudados (Tabela 4).
Tabela 4: Concentração Inibitória Mínima (CIM) dos extratos hexânico (AbptH) e etanólico
(AbptE) de Alternanthera brasiliana utilizando o método de microdiluição em placas de 96
poços.
Microrganismos
AbptH (mg/mL)
AbptE (mg/mL)
2,5
50,0
Staphylococcus epidermidis ATCC 12228
25,0
2,5
Candida dubliniensis ATCC 777
25,0
50,0
Candida dubliniensis ATCC 778157
25,0
50,0
Staphylococcus aureus ATCC 14458
A CIM foi considerada a menor concentração do extrato de A. brasiliana que
inibiu o crescimento visível dos microrganismos ensaiados após incubação. A partir
deste parâmetro, estabeleceu-se um protocolo do estudo utilizando concentrações
iguais a CIM ou inferiores (subinibitórias). O desenvolvimento de formulações
farmacêuticas semi-sólidas para uso tópico levou em consideração este princípio.
4.5
Avaliação dos extratos e de formulações tópicas contendo
extratos de Alternanthera brasiliana como fotossessibilizadores
naturais
Considerando a habilidade dos extratos AbptE e AbptH de absorverem luz na
região entre 600 e 700 nm, procedeu-se o ensaio de avaliação dos extratos e
83
formulações de A. brasiliana como fotossensibilizadores naturais em PDT
antimicrobiana.
Observou-se que o fotossensibilizador azul de metileno empregado neste
estudo como controle positivo da PDT não demonstrou efeito tóxico às cepas S.
aureus, S. epidermidis, C. dubliniensis ATCC 777 e C. dubliniensis ATCC 778157
quando não irradiado. No entanto, após a irradiação o corante foi capaz de inibir o
crescimento de todos os microrganismos indicadores estudados.
O solvente (propilenoglicol: água destilada esterilizada, 5:95, v/v), empregado
como controle negativo, não inibiu o crescimento dos microrganismos em nenhuma
das placas (não irradiada e irradiada). Já os antimicrobianos padrões utilizados
como
controles
positivos
(bacitracina
e
cetoconazol)
inviabilizaram
os
microrganismos nas condições de irradiação e de ausência de luz.
Quanto ao controle do inóculo, a luz laser sozinha não foi capaz de inibir o
crescimento microbiano . Quando inoculados na ausência de luz e de quaisquer
outras substâncias (exceto do meio de cultura), os microrganismos exibiram
crescimento padrão (Tabela 5).
A análise das formulações base creme e gel creme controle com e sem
conservantes (Phenonip®) não apresentaram comportamento inibitório quanto ao
crescimento microbiano seja na presença ou ausência de luz, não apresentando
comportamento diferente entre si e sendo possível verificar que os conservantes, na
concentração empregada na formulação, não apresentaram efeito antimicrobiano
frente às cepas indicadoras estudadas (Tabela 5).
84
Tabela 5: Resultados da contagem de microrganismos das amostras controles antes e após a irradiação
Microrganismos
Grupo não irradiado (L-)
Média do número de microrganismos expresso em ufc/mL*
Inóculo Inicial
Candida dubliniensis
ATCC 778157
Candida dubliniensis
ATCC 777
Staphylococcus
epidermidis
ATCC 12228
Saphylococcus aureus
ATCC 14458
Microrganismos
Controle
Inóculo, L-
7
b
> 10
6
b
> 10
1,14.10 (0,15)
7
b
> 10
7
b
> 10
1,14.10 (0,30)
1,70.10 (0,10)
1,09.10 (0,22)
Controle
negativo, L-
7
> 10
6
> 10
7
> 10
7
> 10
Controle
positivo PDT, L-
Controle
positivo, L-
Controle base
creme com
conservante, L-
7
0
a
> 10
6
0
a
> 10
7
0
a
> 10
> 10
7
0
a
Controle
positivo PDT,
L+
Controle
positivo, L+
7
> 10
6
> 10
7
> 10
7
Controle base gel
creme com
conservante, L-
7
> 10
7
6
> 10
7
> 10
> 10
7
> 10
Controle base
creme com
conservante, L+
Controle base gel
creme com
conservante, L+
6
7
7
Grupo irradiado (L+)
Média do número de microrganismos expresso em ufc/mL*
Inóculo Inicial
7
Controle
Inóculo, L+
b
Controle
negativo, L+
a
a
7
7
7
7
Cândida dubliniensis
1,14.10 (0,30)
0
0
> 10
> 10
> 10
> 10
ATCC 778157
6
b
a
a
6
6
6
6
Cândida dubliniensis
1,70.10 (0,10)
0
0
> 10
> 10
> 10
> 10
ATCC 777
7
b
a
a
7
7
7
7
Staphylococcus
1,14.10 (0,15)
0
0
> 10
> 10
> 10
> 10
epidermidis
ATCC 12228
7
b
a
a
7
7
7
7
Staphylococcus
1,09.10 (0.22)
0
0
> 10
> 10
> 10
> 10
aureus
ATCC 14458
*: dados expressos como média, n=6, (Coeficiente de Variação, CV%), onde CV (%)= (desvio padrão/média)x100); Controle positivo: cetoconazol (200µg/mL)
para os fungos ou bacitracina (0,2UI/mL) para bactérias; Controle positivo PDT: Azul de metileno (0,05mg/mL); Controle negativo: diluente – propilenoglicol/água
destilada esterilizada (5:95, v/v); Controle base creme com conservante; Controle base gel creme com conservante; Inóculo inicial: número de ufc/mL do inóculo.
Estatística: a ? b, Teste de Tukey, P<0,05.
85
Após o período de incubação, na ausência de luz, o extrato etanólico (AbptE)
a 25 mg/mL, reduziu o número de UFC/mL das duas cepas bacterianas estudadas
(S. aureus ATCC 14458 – 99,86% de redução e S. epidermidis ATCC 12228 – 100%
de redução), não afetando o crescimento das leveduras. Já as formulações creme e
gel creme contendo AbptE na ausência de irradiação não demonstraram atividade
antimicrobiana (Tabela 6).
Na placa irradiada, AbptE inibiu total ou parcialmente o crescimento de todos
os microrganismos estudados (S. aureus ATCC 14458 – 100% de redução, S.
epidermidis ATCC 12228 – 100% de redução, C. dublinienesis ATCC 778157 –
100% de redução e C. dubliniensis ATCC 777 – 24,71% de redução) (Tabela 7). A
formulação gel creme contendo o extrato AbptE reduziu o número de UFC/mL das
cepas de C. dubliniensis ATCC 778157 (99,8% de redução) e ATCC 777 (98,57% de
redução) e S. aureus (100% de redução), não demonstrando atividade frente a S.
epidermidis ATCC 12228. A formulação creme contendo o extrato AbptE teve
atividade apenas frente S. aureus ATCC 14458 com 100% de redução das UFC/mL
(Tabela 8, Figura 1, Figura 16, Figura 17 e Figura 18).
O extrato hexânico (AbptH) e as formulações contendo este extrato não
demonstraram atividade biocida na ausência de irradiação (Tabela 6). Quando
irradiado, o extrato AbptH não foi ativo apenas frente à cepa de C.dubliniensis
ATCC 777, demonstrando atividade para às demais indicadoras (Tabela 7). Quando
incorporado na formulação creme, após a irradiação, demonstrou atividade apenas
sobre S. aureus, inibindo totalmente o crescimento do microrganismo (redução de
100% das UFC/mL). Os demais microrganismos apresentaram-se inertes ao
tratamento (Tabela 9). A formulação gel creme contendo AbptH mostrou atividade
em PDT antimicrobiana frente a S. aureus ATCC 14458 (redução de 100% das
UFC/mL), S. epidermidis ATCC 12228 (redução de 99,54%), não sendo bioativa
frente às cepas de leveduras (Tabela 9, Figura 15, Figura 16, Figura 17 e Figura 18).
86
Tabela 6: Resultados da contagem de microrganismos das amostras teste antes e após a irradiação.
Microrganismos
Candida dubliniensis
ATCC 778157
Candida dubliniensis
ATCC 777
Staphylococcus
epidermidis
ATCC 12228
Saphylococcus aureus
ATCC 14458
Microrganismos
Candida dubliniensis
ATCC 778157
Candida dubliniensis
ATCC 777
Grupo não irradiado (L-)
Média do numero de microrganismos
Inóculo Inicial
AbptH
2,5mg/mL
L7
1,14.10 (0.30)
b
7
> 10
6
7
0
7
1,47.10 (1,50)
> 10
6
b
> 10
7
b
> 10
7
b
> 10
1,70.10 (0,10)
1,14.10 (0,15)
1,09.10 (0,22)
7
b
3,80.10 (1,24)
6
b
> 10
7
b
1,70.10 (0,10)
7
> 10
> 10
6
> 10
a
> 10
4
Grupo irradiado (L+)
Média do número de microrganismos
Inóculo Inicial
AbptH
2,5mg/mL
L+
1,14.10 (0,30)
expresso em ufc/mL*
AbptE
Creme
25mg/mL
AbptH 5mg/mL
LL-
3
c
0
a
c
> 10
6
> 10
7
> 10
7
> 10
a
b
> 10
6
> 10
7
> 10
> 10
7
Gel Creme
AbptH 5mg/mL
L+
> 10
6
> 10
> 10
Creme
AbptE 5mg/mL
L-
7
7
> 10
1,28.10 (2,10)
3
7
expresso em ufc/mL*
AbptE
Creme
25mg/mL
AbptH 5mg/mL
L+
L+
6
6
c
Gel Creme
AbptH 5mg/mL
L-
7
> 10
6
> 10
7
> 10
> 10
7
> 10
Creme
AbptE 5mg/mL
L+
Gel Creme
AbptE 5mg/mL
L+
7
> 10
6
> 10
4
c
Gel creme
AbptE 5mg/mL
L7
6
7
7
4
c
4
c
7
2,23.10 (2,00)
6
2,43.10 (1,60)
7
7
7
Staphylococcus
1,14.10 (0,15)
3,60.10 (1,80)
0
5,21.10 (2,50)
> 10
> 10
> 10
epidermidis
ATCC 12228
7
b
a
a
a
a
a
a
Staphylococcus aureus
1,09.10 (0,22)
0
0
0
0
0
0
ATCC 14458
*: dados expressos como média, n=6, (Coeficiente de Variação, CV%), onde CV (%)= (desvio padrão/média)x100); Estatística: a ? b?c, Teste de Tukey, P<0,05.
87
Tabela 7: Percentual de redução de unidades formadoras de colônias por mililitro (UFC/mL)
após irradiação com laser diodo InGaAlP e tratamento com os extratos de Alternanthera
brasiliana.
Microrganismos
AbptH L+
2,5mg/mL
(UFC/mL)*
% de Redução
de UFC/mL*
AbptE L+
25mg/mL
(UFC/mL)*
% de Redução
de UFC/mL*
(Inóculo Inicial,
UFC/mL)*
3
Candida
3,80.10 (1,24)
99.98
0
100
dubliniensis
ATCC 778157
7
[1.14.10 0.30)]
6
6
Candida
0
1,28.10 (2,10)
24,7
> 10
dubliniensis
ATCC 777
6
[1.70.10 0.10)]
3
Staphylococcus
3,60.10 (1,80)
99,97
0
100
epidermidis
ATCC 12228
7
[1.14.10 (0.15)]
Staphylococcus
0
100
0
100
aureus
ATCC 14458
7
[1.09.10 0.22)]
*: dados expressos como média, n=6, (Coeficiente de Variação, CV%), onde CV (% )= (desvio
padrão/média)x100; Inóculo inicial: número de ufc/mL do inóculo.
Tabela 8: Percentual de redução de unidades formadoras de colônias por mililitro (UFC/mL)
após irradiação com laser diodo InGaAlP e tratamento com as formulações creme e gel
creme contendo extrato etanólico (AbptE) de Alternanthera brasiliana.
Microrganismos
Creme
AbptE 5mg/mL
L+
(UFC/mL)*
7
>10
% de Redução
de UFC/mL*
Gel creme
AbptE 5mg/mL
L+
(UFC/mL)*
4
2,23.10 (2,00)
% de Redução
de UFC/mL*
[Inóculo Inicial,
UFC/mL]*
Candida
0
99.8
dubliniensis
ATCC 778157
7
[1.14.10 (0.30)]
6
4
Candida
>10
0
2,43.10 (1,60)
98,57
dubliniensis
ATCC 777
6
[1.70.10 (0.10)]
7
7
Staphylococcus
>10
0
>10
0
epidermidis
ATCC 12228
7
[1.14.10 (0.15)]
Staphylococcus
0
100
0
100
aureus
ATCC 14458
7
[1.09.10 (0.22)]
*: dados expressos como média, n=6, (Coeficiente de Variação, CV%), onde CV (% )= (desvio
padrão/média)x100; Inóculo inicial: número de ufc/mL do inóculo.
88
Tabela 9: Percentual de redução de unidades formadoras de colônias por mililitro (UFC/mL)
após irradiação com laser diodo InGaAlP e tratamento com as formulações creme e gel
creme contendo extrato hexânico (AbptH) de Alternanthera brasiliana.
Microrganismos
Creme
% de Redução
Gel creme
% de Redução
AbptH 5mg/mL
de UFC/mL*
AbptH 5mg/mL
de UFC/mL*
[Inóculo Inicial,
L+
L+
UFC/mL]*
(UFC/mL)*
(UFC/mL)*
7
Candida
>10
0
>107
0
dubliniensis
ATCC 778157
[1.14.107 (0.30)]
Candida
>106
0
>106
0
dubliniensis
ATCC 777
[1.70.106 (0.10)]
Staphylococcus
>107
0
5,21.104
99,54
epidermidis
ATCC 12228
[1.14.107(0.15)]
Staphylococcus
0
100
0
100
aureus
ATCC 14458
[1.09.107 (0.22)]
*: dados expressos como média, n=6, (Coeficiente de Variação, CV%), onde CV (% )= (desvio
padrão/media)x100; Inóculo inicial: número de ufc/mL do inóculo.
UFC/mL
Staphylococcus aureus
(ATCC 14458)
1.0×10 09
1.0×10 08
1.0×10 07
*
1.0×10 06
1.0×10 05
1.0×10 04
**
**
1.0×10 03
1.0×10 02
1.0×10 01
1.0×10 00
**
AbptH L- AbptH L+ AbptE L- AbptE L+
**
**
**
**
CH L+
GCH L+
CE L+
GCE L+
Amostras
Figura 15: Número de unidades formadoras de colônias por mililitro (UFC/mL) das cepas
Staphylococcus aureus ATCC 14458 tratadas com os extratos de Alternanthera brasiliana
(AbptH ou AbptE) e com as formulações Creme contendo AbptH (CH) ou AbptE (CE) e Gel
creme contendo AbptH (GCH) ou AbptE (GCE), na presença (L+) e ausência (L-) de
irradiação com laser diodo InGaAlP. Estatística: * ? **, Teste de Tukey, P<0,05.
89
UFC/mL de
Staphylococcus
epidermidis
(ATCC 12228)
1.0×10 09
*
1.0×10 06
**
**
1.0×10 03
**
1.0×10 00
AbptH L-
AbptH L+
AbptE L-
**
AbptE L+
GCH L+
Amostras
Figura 16: Número de unidades formadoras de colônias por mililitro (UFC/mL) das cepas
Staphylococcus epidermidis ATCC 12228 tratadas com os extratos de Alternanthera
brasiliana (AbptH e AbptE) e com Gel creme contendo AbptH (GCH) na presença (L+) e
ausência (L-) de irradiação com laser diodo InGaAlP. Estatística: * ? **, Teste de Tukey,
P<0,05.
UFC/mL de
Candida dubliniensis
(ATCC 777)
1 . 0 × 1 0 07
*
*
1 . 0 × 1 0 06
1 . 0 × 1 0 05
**
1 . 0 × 1 0 04
AbptE L-
AbptE L+
GCE L+
Amostras
Figura 17: Número de unidades formadoras de colônias por mililitro (UFC/mL) das cepas
Candida dubliniensis ATCC 777 tratadas com o extrato etanólico (AbptE) de Alternanthera
brasiliana e com o Gel creme contendo extrato hexânico (GCH) na presença (L+) e
ausência (L-) de irradiação com laser diodo InGaAlP. Estatística: * ? **, Teste de Tukey,
P<0,05.
90
UFC/mL de
Candida dubliniensis
(ATCC 778157)
1.0×10
09
*
1.0×10
*
06
**
**
1.0×10
03
**
1.0×10
00
AbptH L-
AbptH L+
AbptE L-
AbptE L+
GCE L+
Amostras
Figura 18: Número de unidades formadoras de colônias por mililitro (UFC/mL) das cepas
Candida dubliniensis ATCC 778157 tratadas com os extratos de Alternanthera brasiliana e
com Gel creme contendo extrato AbptE (GCE) na presença (L+) e ausência (L-) de
irradiação com laser diodo InGaAlP. Estatística: * ? **, Teste de Tukey, P<0,05.
91
5 DISCUSSÃO
A resistência aos antibióticos que inicialmente aparentavam ser altamente
efetivos contra microrganismos tais como S. aureus desapontou muitas expectativas
(TUNGER et al., 2000, SIEVERT et al., 2002). Neste sentido, a indústria
farmacêutica produzi u um número considerável de novos antibióticos nas últimas
três décadas. Entretanto , o número de microrganismos resistentes a estas
substâ ncias também aumentou (COHEN, 1992). O problema foi exacerbado por
fatores de natureza social, tais como a inapropriada ou excessiva prescrição de
antibióticos, ou uso inadequado do fármaco, a larga variedade de mecanismos
adotados pelas células microbianas para aumentar a resistência a agressões
externas (em geral, as bactérias têm habilidade genética para transmitir e adquirir
resistência às drogas que são utilizadas como agentes terapêuticos), entre outros
(BOYLE-VAVRA et al., 2001).
Vários estudos estão sendo realizados com bactérias e leveduras
contribuindo ao desenvolvimento de diferentes opções de tratamento para as
infecções promovidas por estes microrganismos. A terapia fotodinâmica, por
exemplo, é uma opção terapêutica recente, em pleno desenvolvimento, e tem se
mostrado efetiva, in vitro, contra bactérias, fungos, vírus e parasitas (WAINWRIGHT,
1998).
O azul de metileno destaca-se como fotossensibilizador sendo largamente
aplicado em PDT antimicrobiana. A forma e o tamanho deste fotossensibilizador
fenotiazínico, permitem que ele se intercale no ácido nucléico. A ação fotodinâmica
do azul de metileno contra os ácidos nucléicos é seletiva para resíduos de
guanosina, conduzindo preferencialmente à formação de 8-hidroxiguanosina
(SCHNEIDER et at., 1990). Além disso, sabe-se que corantes fenotiazínicos são
mais efetivos contra bactérias gram-positivas em relação às gram-negativas
(WAINWRIGHT, 1998). No presente trabalho o corante foi empregado como controle
positivo devido às evidências de sua atividade antimicrobiana contra várias bactérias
e fungos quando associado ao laser de baixa potência (ZEINA et al., 2001,
GIROLDO et al., 2008, USACHEVA et al., 2006; MUNIN et al., 2007).
O pico de absorção obtido neste estudo para o azul de metileno foi o
92
caracteristicamente encontrado para esta substância (região próxima aos 664 nm)
(USACHEVA et al., 2006). Pôde-se observar, também, que os extratos AbptE e
AbptH apresentaram picos de absorção na região entre 650 e 700 nm. Este
comportamento absortivo é interessante do ponto de vista de aplicabilidade em PDT,
já que está na região do espectro eletromagnético conhecida como janela
terapêutica (BOYLE; DOLPHIN, 1996, FUCHS; THIELE, 1998, KENDALL;
MORTON, 2003). Além disso, o laser empregado no experimento emite radiação no
comprimento de onda de 685 nm, o que remeteu à possibilidade destes extratos
absorverem tal comprimento de onda e subseqüentemente, terem aplicabilidade
como fotossensibilizadores naturais.
Alguns estudos sugerem que certos microrganismos podem apresentar
cromóforos, intrinsecamente, e, desta forma, poderiam absorver a luz aplicada
demonstrando comportamento derivado desta característica, respondendo melhor à
terapia fotodinâmica antimicrobiana (WILSON; PRATTEN, 1994, ALMEIDA et al.,
2006, SOUZA et al., 2006). Para tanto, foram analisados os inóculos de S. aureus,
S. epidermidis, C. dubliniensis (ATCC 777 e ATCC 778157) na presença e ausência
de radiação sem adicionar nenhuma substância além do caldo nutritivo. O
comportamento do controle do inóculo demonstrou-se inalterado diante da aplicação
da radiação, o que sugere que as cepas analisadas não possuem cromóforos
naturais, sendo que não houve redução do número de microrganismos diante da
exposição à luz laser.
Devido à facilidade de acesso às substâncias, a pele é um dos alvos mais
explorados em PDT. Sabendo-se dos inúmeros problemas cutâneos relacionados
com
a
presença
de
microrganismos,
buscou-se
desenvolver
formulações
farmacêuticas semi-sólidas para aplicação tópica, contendo extratos de A.
brasiliana, que pudessem ser testadas in vitro a fim de se demonstrar o potencial
antimicrobiano quando associadas à radiação laser de baixa potência.
Como controle empregou-se antimicrobianos convencionalmente utilizados no
tratamento tópico das patologias que envolvem leveduras e bactérias. Para as
bactérias Gram-positivas estudadas, a bacitracina foi empregada como controle
positivo. O mecanismo de ação deste antibiótico polipeptídico cíclico consiste em
impedir a defosforilação do fosfolipídeo que transporta a subunidade do
peptideoglicano pela membrana celular. Assim,
a
bacitracina bloqueia
a
regeneração do lipídeo trasportador e inibe a síntese da parede celular. Como
93
conseqüência, a bactéria fica mais suscetível à pressão osmótica interna e pode
sofrer lise (morte celular) (RANG et al., 2003, LEVINSON; JAWETZ, 2005).
Os resultados demonstraram que o extrato etanólico (AbptE) de A. brasiliana
foi capaz de reduzir o número UFC/mL de bactérias Gram-positivas viáveis na
ausência de luz, numa concentração de 25 mg/mL, concentração subinibitória para
S. aureus (CIM = 50 mg/mL) e concentração superior à CIM para S. epidermidis
(CIM = 2,5 mg/mL). Assim, sugere-se que estas bactérias podem ser suscetíveis aos
compostos polares presentes neste extrato. Novos estudos se fazem necessários
para estas cepas, avaliando-se a atividade dos extratos em uma concentração
menor.
No que diz respeito à atividade antibacteriana dos extratos de A. brasiliana
avaliados são necessários estudos investigativos da composição química destes
extratos bioativos na tentativa de se identificar substâncias fotoativas, podendo esta
atividade não ser atributo de uma única substância, e sim de mais de uma
substância, dado o fato do extrato tratar-se de uma mistura complexa de
substâ ncias (efeito de sinergismo).
Além disso, muitas vezes pode-se tratar de
substâncias minoritárias, quimicamente instáveis quando isoladas, o que poderia
dificultar sua caracterização química (CECHINEL FILHO; YUNES, 2001). Por outro
lado, um extrato bruto vegetal que possui efeito bactericida satisfatório, poderia não
necessitar de processos de isolamento de substâncias ativas, reduzindo etapas
químicas e conseqüentemente custos financeiros, podendo ser utilizado como droga
vegetal ou como um fitocomplexo ou medicamento fitoterápico. Para tanto , deveriam
ser garantidos a segurança, a eficácia e a qualidade do produto (CUNHA, 2006).
De acordo com Brochado et al. (2003), extratos etanólicos de folhas de A.
brasiliana revelaram a presença de flavonóides. Estes metabólitos secundários são
substâncias conhecidas por serem sintetizadas pelas plantas em resposta a
infecções microbianas. A atividade antimicrobiana pode ser devida à presença de
metabólitos secundários como os flavonóides que apresentam capacidade de
formarem complexos com proteínas solúveis extracelulares e com a parede celular,
ou ainda pela ruptura da membrana celular dos microrganismos (TSUCHIYA et al.
1996, COWAN, 1999). Diante disso, sugere-se que a atividade antimicrobiana
observada frente às cepas S. aureus ATCC 14458 (99,86% de redução das
UFC/mL) e S. epidermidis ATCC 12228 (100% de redução das UFC/mL), na
ausência de irradiação, pode estar relacionada à presença de substâ ncias bioativas,
94
tais como polifenóis no extrato etanólico. O extrato etanólico, para estes
microrganismos indicadores, poderia ter sido avaliado no ensaio de PDT
antimicrobiana em concentrações menores do que as utilizadas no presente estudo,
investigando-se seu comportamento antimicrobiano na ausência e presença da
irradição laser.
É importante considerar que o mecanismo de ação de muitos fármacos ainda
está em processo de investigação, o que não desqualifica o efeito final promovido
por ele. No caso de produtos oriundos de plantas, as descrições de mecanismos de
ação são encontradas em pequeno número na literatura. Especificamente para a
atividade antimicrobiana, pode-se citar que alguns extratos vegetais agem
interferindo com a estrutura da parede celular microbiana (ZACCHINO, 2001).
O extrato hexânico, por sua vez, não demonstrou atividade antimicrobiana na
ausência de irradiação. No entanto, os ensaios desenvolvidos empregaram-no na
concentração de 2,5 mg/mL (equivalente à CIM apenas para S. aureus, e, quanto
aos demais microrganismos a concentração utilizada foi inferior à CIM, ou seja em
concentração subinibitória mínima).
Quanto aos fungos leveduriformes empregados no estudo, (cepas do gênero
Candida) estes não se demonstraram suscetíveis aos extratos nas condições de
ausência de irradiação. O controle positivo empregado para estas cepas foi o
cetoconazol que tem como mecanismo de ação a inibição da síntese do ergosterol
ao inibir a enzima fúngica CYP3A do citocromo P-450 que transforma lanosterol em
ergosterol (o principal esterol encontrado na membrana celular dos fungos)
alterando a fluidez da membrana (RANG et al., 2003; LEVINSON; JAWETZ, 2005).
Os fungos possuem parede celular, diferentemente das células dos
mamíferos, o que remete à possibilidade dos sistemas de enzimas envolvidos na
síntese e montagem desta estrutura serem alvos em potencial para o
desenvolvimento de novos fármacos, com maior especificidade. Entretanto, as
células humanas e fúngicas compartilham vias metabólicas intermediárias que
utilizam enzimas muito semelhantes, havendo dificuldades para encontrar alvos que
ofereçam a seletividade requerida (ZACCHINO, 2001).
Esta dificuldade remete,
novamente, ao desenvolvimento de novos fármacos, que ajam localmente, a fim de
se reduzir os efeitos adversos.
Sob esta perspectiva, foram desenvolvidas formulações farmacêuticas com
conteúdo lipídico diferenciado, incorporando-se os extratos hexânico e etanólico de
95
A. brasiliana. Inicialmente, na placa não irradiada, não se observou qualquer
atividade biocida relacionada às formulações, tanto em relação às formulações
bases, formulações controle (creme e gel creme que continham conservantes ou
não) quanto às formulações contendo os extratos AbptE e AbptH.
Durante a avaliação dos extratos e formulações farmacêuticas como
possíveis fotossensibilizadores naturais, observou-se uma modificação no perfil de
resposta dos microrganismos, tanto no caso dos extratos, quanto das formulações.
Na etapa de preparação das formulações considerou-se que veículos tópicos
precisam ser capazes de penetrar na pele. Estes são transportadores dos
ingredientes ativos podendo melhorar a atividade dos princípios ativos, transportálos através dos obstáculos biológicos, aumentar a meia vida e a solubilidade no
meio desejado, proteger o corpo de possíveis efeitos tóxicos do ativo e concentrá-lo
na área biológica alvo (YECHIEL, 2004). Entretanto, o princípio ativo (neste caso o
extrato AbptE ou AbptH) não poderia ter uma afinidade muito grande pelo veículo
(formulação base, o que corresponde a um coeficiente de difusão fraco), pois isso
traria dificuldades à difusão adequada na camada córnea da pele em ensaios in vivo
e na biodisponibilidade dos ativos frente ao alvo terapêutico no sítio de ação
(RENOUX, 1997). Estudos futuros mais abrangentes devem realizados atentando
para estes aspectos.
Além de atuar de maneira determinante na biodisponibilidade dos fármacos,
as formulações farmacêuticas necessitam apresentar estabilidade físico-química
para assegurar que não haverá prejuízos na ação terapêutica. Cada componente,
ativo ou não, pode afetar a estabilidade do produto. Variáveis relacionadas à
formulação, ao processo de fabricação, ao material de acondicionamento e às
condições ambientais e de transporte podem influenciar na estabilidade do produto.
As formulações desenvolvidas nesta pesquisa não demonstraram alterações no
aspecto físico, tais como precipitação, separação de fases, cristalização entre
outras. As embalagens em que as formulações foram envasadas foram previamente
escolhidas a fim de evitar possíveis degradações dos ingredientes pela captação de
iluminação. O pH das preparações manteve -se na faixa de 5,0 a 5,5, o que é
compatível com o uso na pele e que pode evitar a ocorrência de irritações. As
características organolépticas dos fitocosméticos desenvolvidos também se
mostraram adequadas para aplicações em pele humana (AGÊNCIA, 2004).
Variando o conteúdo lipídico das formulações (creme e gel creme)
96
observaram-se alterações no comportamento destes veículos em relação à liberação
dos extratos para ação sobre as células bacterianas e leveduras. No entanto, esta
atividade só foi percebida com a aplicação da radiação laser de baixa potência a
685 nm. Para a formulação gel creme (de menor teor lipídico) em que os extratos
etanólico ou hexânico foram incorporados foi observada ação antimicrobiana em
maior proporção como resultado da PDT. Sugere-se que este comportamento
diferenciado, quando o laser de baixa potência é associado, pode ter relação com o
poder que as ceras em geral (nas formulações aqui desenvolvidas, equivalentes ao
polawax e álcool cetoestearílico) têm de reter compostos, enquanto que o gel
veicularia de maneira mais satisfatória os princípios ativos.
O polawax, uma cera autoemulsionante de caráter não iônico, foi empregado,
pois pode carrear substâncias com uma boa variação na faixa de pH, sendo um
ponto positivo para a estabilidade da emulsão. Além disso, o conteúdo de água
contido na formulação gel creme foi 6,5%, percentagem esta maior do que a
presente na formulação creme. Embora não represente uma grande alteração,
somada à redução do conteúdo lipídico, pode ser que a formulação gel creme tenha
sido solubilizada de modo mais eficiente no poço da placa de microdiluição que
continha os microrganismos estudados, com uma maior biodisponibilidade dos
ativos. Desta maneira, os extratos seriam liberados mais facilmente pela formulação
e poderiam interagir melhor com os microrganismos, que seriam inativados após a
irradiação.
Além disso, deve-se considerar que os veículos podem alterar a
estereoquímica de um ingrediente ativo para promover a compatibilidade deste com
as moléculas alvo do sítio de ação (TOMLINSON, 1987). Para este estudo, este
conceito só foi válido após a presença de energia na forma de luz, com laser
irradiando uma área de 0,38 cm2 por amostra durante 5 minutos e uma densidade
de energia de 28 J/cm2 .
As formulações estudadas no ensaio de fotossensibilização continham
quantidades reduzidas dos extratos (formulações contendo 5% de extratos, o que
equivale a 50 mg de extrato/g de formulação, p/p, em concentração final no poço de
5 mg/mL – conteúdo de extrato no poço = 0,25 mg de extrato/mL). Portanto as
formulações obtidas otimizaram a atividade PDT antimicrobiana dos extratos frente a
alguns
dos
microrganismos
indicadores
quando
associados
à
formulação
farmacêutica tópica, observando-se efeito em PDT antimicrobiana para as
97
formulações em concentração 100 vezes menor do que a observada para o extrato
bruto nas mesmas condições experimentais.
Nas condições de irradiação a formulação gel creme foi a mais efetiva na
interação dos extratos frente aos microrganismos estudados. Os resultados
demonstram à redução de UFC/mL mediada por pelo menos um dos extratos (AbptE
ou AbptH) incorporados nessa formulação frente às 4 cepas avaliadas (todos os
microrganismos avaliados demonstraram-se
sensíveis
a
pelo
menos
uma
formulação gel creme contendo extrato de A. brasiliana (AbptE ou AbptH) e
submetida a irradiação com laser de baixa potência).
Já as formulações creme contendo os extratos AbptE e AbptH demonstraram
atividade antimicrobiana apenas frente às cepas de S. aureus. Este resultado sugere
que as formulações gel creme são mais interessantes do ponto de vista de
aplicabilidade em PDT.
Vários estudos em PDT vêm sendo desenvolvidos empregando cepas de S.
aureus devido, especialmente, à importância epidemiológica das doenças causadas
por este microrganismo (WILSON; PRATEN, 1994, USACHEVA; TEICHERT; BIEL,
2001; ZEINA et al., 2001; BANFI et al., 2006). Além disso, resultados promissores
são associados à aplicação da terapia fotodinâmica antimicrobiana. O presente
trabalho
revelou
a
presença
de
substâncias
fotoativas
nas
preparações
farmacêuticas contendo A. brasiliana e a potencialidade de aplicação destas
preparações como fotossensibilizadores naturais em PDT antmicrobiana.
Deve-se considerar também a importância das infecções nosocomiais
associadas ao patógeno S. epidermidis. Assim, tem relevância a pesquisa que visa
encontrar substâncias efetivas no controle deste agente. Devida existência do
microrganismo na flora normal da pele, a incidência de casos de infecções causadas
por esta espécie não pode ser ignorada (MICHELIM et al., 2005). Os resultados
mostraram que na placa irradiada a atividade antimicrobiana foi otimizada (ambos os
extratos reduziram o número de UFC/mL deste microrganismo).
A parede celular das bactérias gram-positivas contém mais de 100 camadas
de
peptideoglicano compreendendo a uma espessura de 15 a 80 nm,
aproximadamente. O peptideoglicano está intimamente associado com ácidos
lipoteicóicos e negativamente carregado com ácidos teicurônicos. Esta parede
dispõe de um grau de porosidade relativamente alto, uma vez que várias
macromoléculas, como glicopeptídeos e polissacarídeos de peso molecular na faixa
98
dos 30000-60000 Daltons, foram observados se difundindo facilmente para o interior
da membrana plasmática (FRIEDRICH et al., 2000). Então, nesta classe de
bactérias, a parede externa não age como uma barreira de permeabilidade para os
fotossensibilizadores mais comumente empregados. O peso molecular destes
fotossensibilizadores normalmente não excede 1800 Daltons (NIKAIDO, 1994).
Mesmo não dispondo de muitas informações sobre o fotossensibilizador empregado
no presente estudo, já que extratos são compostos por inúmeras substâncias, podese sugerir que para a promoção do efeito fotodinâmico observado, houve influxo dos
extratos através da parede celular e após a ativação pela radiação a
desestabilização da célula bacteriana foi promovida.
Estudos com diversos fotossensibilizadores têm sido realizados, entretanto
não se tem encontrado relato de estudo empregando extratos vegetais como
fotossensibilizadores para emprego em PDT antimicrobiana. O produto natural
hipericina, por exemplo, foi testado apenas como fotossensibilizador em PDT anticâncer (BUBLIK et al., 2006).
Logo, os resultados obtidos sugerem que os extratos de A. brasiliana têm
potencial para aplicação em PDT antimicrobiana, apresentando em sua composição
substâ ncias fotoativas. Portanto, pode-se dizer que o presente estudo aponta para o
potencial dos produtos naturais como fotossensibilizadores aplicáveis em PDT
antimicrobiana e encoraja novas investigações com produtos naturais e seu
emprego em terapia fotodinâmica.
99
6 CONCLUSÃO
Os resultados obtidos, nas condições experimentais e parâmetros estudados,
permitiram concluir que:
•
Foram obtidos extratos em hexano e etanol de A. brasiliana (planta total), que
apresentaram bandas de absorção em 650 e 700 nm compatível com a região
de trabalho da PDT (685 nm);
•
Os extratos hexânico (AbptH) e etanólico (AbptE) de A. brasiliana, em grande
parte, reduziram o crescimento microbiano das cepas de C. dubliniensis
(ATCC 778157 e ATCC 777) após irradiação com laser de baixa potência
(InGaAIP) nas condições experimentais utilizadas;
•
Procedeu-se o preparo de formulações creme e gel creme contendo os
extratos bioativos de A. brasiliana e as preparações farmaceuticas obtidas
mostraram-se estáveis no teste de centrifugação e com pH entre 5,0 e 5,5,
compatível ao de formulações tópicas desenvolvidas para aplicação na pele
humana;
•
As preparações farmacêuticas semi-sólidas desenvolvidas (especialmente a
gel creme) contendo os extratos hexanico e etanolico (50 mg/g de creme ou
gel creme) de A. brasiliana apresentaram efeito antimicrobiano (a 5 mg de
creme ou gel creme/mL, equivalente a 0,25 mg de extrato ativo/mL) quando
submetidos à irradiação com laser de baixa potência, apresentando
fotoatividade frente a microrganismos.
100
7 SUGESTÕES PARA TRABALHOS FUTUROS
Os resultados obtidos neste trabalho encorajam estudos mais detalhados,
dentre eles pode-se citar:
•
Estudos fitoquímicos para a caracterização química dos extratos fotoativos de
maneira a se identificar quais os constituintes presentes nos extratos bioativos
estariam atuando como fotossensibilizadores;
•
Avaliação de efeitos de sazona lidade e da influencia de fatores edaficos
(temperatura, luminosidade, umidade, pH do solo etc) na reprodutividade da
atividade biológica dos extratos;
•
Estudos futuros tanto in vitro como in vivo devem ser realizados, buscando-se
detalhar e pormenorizar os efeitos biológicos dos extratos estudados para um
possível emprego em PDT antimicrobiana e outras, estabelecendo-se abordagens
tais como, determinação de uma curva dose resposta dos extratos bioativos frente
ao laser, estudos variando os tipos de laser e outras condições de irradiação, bem
como estudando outros microrganismos e outros tipos celulares (linhagens de
câncer, por exemplo) e procedendo a realização de estudos de toxicidade, bem
como estudos in vivo.
•
Investigações mais detalhadas das formulações creme e gel creme aqui
empregadas como veículos, visando potencializar o efeito dos extratos de A.
brasiliana associados ao laser de baixa potência para uma possível aplicação em
terapia fotodinâmica antimicrobiana.
•
Para que se possa ter uma margem de segurança para aplicação in vivo, se
fazem necessários novos estudos in vitro e em modelos animais para melhor
fundamentar
os
resultados
obtidos,
bem
como
estudos
desenvolvendo
procedimentos analíticos, incluindo estudos de controle de qualidade das
preparações farmacêuticas desenvolvidas, identificando possíveis substâncias
marcadoras, dentre outras possíveis abordagens.
101
REFERÊNCIAS
ACROYD, R. et al. The history of photodetection and photodynamic therapy.
Photochemistry and photobiology, v. 74, n. 5, p. 656-669, 2001.
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Guia de estabilidade de
produtos cosméticos. Brasília: ANVISA, 2004. 52 p. (Série Qualidade em
cosméticos; v.1).
ALLEN JR., L. V. Manipulando emulsões. International Journal of Pharmaceutical
Compounding, v. 6, n. 3, p. 33-55, 2004.
ALMEIDA, J. M. et al. Terapia fotodinâmica: uma opção na terapia periodontal.
Arquivos em odontologia, v. 42, n. 3, p. 161-256, 2006.
ALVES, S. H. et al. Utilização do ágar suco de tomate na identificação presuntiva de
Candida dubliniensis. Revista de Sociedade Brasileira de Medicina Tropical, v.
39, n. 1, p. 92-93, 2006.
ANSEL, H. C., POPOVICH, N. G., ALLEN JR., L. V. Formas farmacêuticas e
sistemas de liberação de fármacos, 6 ed. Baltimore, EUA: Premier, 2000. p. 9697.
ANTUNES JR., D. Farmácia de manipulação – Noções básicas, 1. ed. São Paulo:
Tecnopress, 2002. p. 63-80.
BALANDRIN, M. F. et al. Natural plant chemical sources of industrial and medicinal
materials. Science, v. 228, n.1, p. 1154, 1985.
BANFI, S. et al. Antibacterial activity of tetraaryl-porphyrin photosensitizers: an in
vitro study o n gram negative and gram positive bacteria. Journal of
Photochemistry and Photobiology B: Biology, v. 85, n. 1, p. 28-38, 2006.
BARRAVIERA, B. Estudo clínico das estafilococcias – revisão: 1993. Jornal
Brasileiro de Medicina, v. 67, n. 2, p. 160-192, 1994.
BARRY, B. Liberação transdérmica de fármacos. In: AULTON, M. E. Delineamento
de formas farmacêuticas. 2. ed. São Paulo: Artmed, 2001. p. 505-536.
BOYLE, R. K.; DOLPHIN, D. Structure and distribution relationships of photodynamic
sensitizers. Photochemistry and photobiology, v. 64, n. 3, p. 469-485, 1996.
BOYLE-VAVRA, S. et al. A spectrum of changes occurs in peptidoglycan
composition of glycopeptide-intermediate clinical Staphylococcus aureus isolates.
Antimicrobial Agents and Chemotherapy, v. 45, n. 1, p. 280-287, 2001.
102
BRANDT, M. E. et al. Candida dubliniensis fungemia: the first four cases in North
America. Emerging Infectious Diseases, v. 6, n. 1, p. 46-49, 2000.
BRITO, A. R. M. S.; BRITO, A. A. S. Forty years of brazilian medicinal plant research.
Journal of Ethnopharmacology, v. 49, n. 2, p. 53-67, 1993.
BROCHADO, C. O. et al. Flavonol robinobiosides and rutinosides from Alternanthera
brasiliana (Amaranthaceae) and their effects on lymphocyte proliferation in vitro.
Journal of the Brazilian Chemical Society, v. 14, n. 1, p. 449-451, 2003.
BRUGNERA JR., A.; PINHEIRO, A. L. B. Lasers na odontologia moderna. São
Paulo: Pancast, 1998. 356 p.
BUBLIK, M. et al. Hypericin and pulsed Laser therapy of squamous cell cancer in
vitro. Photomedicine and Laser Surgery. v. 24, n. 3, p. 341-347, 2006.
CAETANO, N. et al. Determinação de atividade antimicrobiana de extratos de
plantas de uso popular como antiinflamatório. Revista Brasileira de
Farmacognosia, v. 12, supl., p. 132-135, 2002.
CECHINEL FILHO, V.; YUNES, R. A. Estudo químico de plantas medicinais
orientado para a análise biológica: obtenção, determinação e modificação estrutural
de compostos bioativos. In: YUNES, R. A.; CALIXTO, J. B. Plantas medicinais sob
a ótica da química medicinal moderna. Chapecó: Argos, 2001. p. 47-75.
CERCA, N. et al. Comparative assessment of antibiotic susceptibility of coagulasenegative staphylococci in biofilm versus planktonic culture as assessed by bacterial
enumeration or rapid XXT colorimetry. Journal of Antimicrobial Chemotherapy, v.
56, n. 2, p. 331-336, 2005.
COHEN, M. L. Epidemiology of drug resistance: implications for a postantimicrobial
era. Science, v. 257, n. 5073, p. 1050-1055, 1992.
CORDELL, G. A. Changing strategies in natural products chemistry.
Phytochemistry, v. 40, n. 6, p. 1585-1612, 1995.
CORDELL, G. A. Biodiversity and drug discovery - a symbiotic relationship.
Phytochemistry, v. 55, n. 1, p. 463-480, 2000.
COWAN, M. M. Plant Products as antimicrobial Agents. Clinical Microbiology
Reviews, v.12, n.4, p. 564-582, 1999.
CUNHA, L. S. Avaliação da atividade antimicrobiana de extratos brutos de
plantas do cerrado, substâncias isoladas e derivados semi-sintéticos frente a
microorganismos bucais. 2006. 170 f. Dissertação (Mestrado em Ciências) –
Universidade de Franca, Franca. 2006.
CUNICO, M. M. et al. Atividade antimicrobiana do extrato bruto etanólico de raízes e
partes aéreas de Ottonia martiana Miq. (Piperaceae). Revista Brasileira de
Farmacognosia, v. 14, n. 2, p. 97-103, 2004.
103
DELAPORTE, R. H. et al. Estudo mineral das espécies vegetais Alternanthera
brasiliana (L.) Kuntze e Bouchea fluminensis (Vell) Mold. Brazilian Journal of
Pharmacognosy, v. 15, n.2, p. 133-136, 2005.
DETTY, M. R.; GIBSON, S. J.; WAGNER, J. Current clinical and preclinical
photosensitizers for use in photodynamic therapy. Journal of Medicinal Chemistry,
v. 47, n. 16, p. 3897-3915, 2004.
DI STASI, L.C. Plantas medicinais: arte e ciência. Um guia de estudo
interdisciplinar. São Paulo: UNESP, 1996. p. 15-21.
DÍAZ, C. D. L. et al. Elaboración de preparados farmacéuticos y
parafarmacéuticos. Madrid: Mc Graw Hill, 2001. p. 197-203.
DIGNANI, M. C.; SOLOMKIN, J. S.; ANAISSIE, E. Candida. In: ANAISSIE, E;
MCGINNIS, M. R.; PFALLER, M. A. Medical Mycology. 1. ed., Filadélfia: Churchill
Livingstone, 2003. p . 195-239.
DOBSON, J.; WILSON, M. Sensitization of oral bacteria in biofilms to killing by light
from a low-power laser. Archives of Oral Biology, v. 37, n. 11, p. 883-887, 1992.
DONNELLY, R. F. et al. Potential of photodynamic therapy in treatment of fungal
infections of the mouth. Design and characterization of a mucoadhesive patch
containing toluidine blue O. Journal of Photochemistry and Photobiology B:
Biology, v. 86, n. 1, p. 59-69, 2007.
DOUGHERTY, T. J. An update on photodynamic therapy applications. Journal of
Clinical Medicine & Surgery, v. 20, n.1, p.3-7, 2002.
DOUGHERTY, T. J. et al. Photodynamic therapy: review. Journal of the National
Cancer Institute, v. 90, n. 12, p. 889-902, 1998.
DUARTE, M. do R.; DEBUR, M. do C. Characters of the leaf and steam morphoanatomy of Alternanthera brasiliana (L.) O. Kuntze, Amarantaceae. Brazilian
Journal of Pharmaceutical Sciences, v. 40, n. 1, p. 85-92, 2004.
ESPINEL-INGROFF, A. et al. Comparative and collaborative evaluation of
standardization of antifungal susceptibility testing for filamentous fungi.
Antimicrobial Agents and Chemotherapy, v. 39, n. 2, p. 314-319, 1995.
FARMACOPÉIA BRASILEIRA IV. 4. ed., São Paulo: Atheneu, 1988.
FONSECA, A. da, PRISTA, L. N. Manual de terapêutica dermatológica e
cosmetologia. 1 ed., São Paulo: Roca, p. 1 -51, 2000.
FRIEDRICH, C. L. et al. Antibacterial action of structurally diverse cationic peptides
on gram-positive bacteria. Antimicrobial Agents and Chemotherapy, v. 44, n. 8, p.
2086-2092, 2000.
FRITSCH, C.; GOERZ, G.; RUZICKA, T. Photodynamic Therapy in Dermatology.
Archives of Dermatology, v. 134, n. 2, p. 207-14, 1998.
104
FUCHS, J.; THIELE, J. The role of oxygen in cutaneous photodynamic therapy. Free
Radical Biology & Medicine, v. 24, n. 5, p. 835-847, 1998.
GAD, F. et al. E ffects of Growth Phase and Extracellular Slime on Photodynamic
Inactivation of Gram-Positive Pathogenic Bacteria. Antimicrobial Agents and
Chemotherapy, v. 48, n. 6, p. 2173–2178, 2004.
GARCEZ, A. S. et al. Antimicrobial Photodynamic Therapy combined with
convencional endodontic treatment to eliminate root canal biofil infection. Lasers in
Surgery and Medicine, v. 66, n. 1, p. 59-66, 2007.
GEORGETTI, S. R. et al. Evaluation of the antioxidant activity of soybean extract by
different in vitro methods and investigation of this activity after its incorporation in
tropical formulations. European Journal of Pharmaceutics and
biopharmaceutics, v. 64, n. 1, p. 99-106, 2006.
GIROLDO L. M. et al. Photodynamic antimicrobial chemotherapy (PACT) with
methylene blue increases membrane permeability in Candida albicans. Lasers in
Medical Science, 2008. DOI: 10.1007/s10103-007-0530-2.
GROVE, D. C.; RANDALL, W. A. Assay methods of antibiotics: a laboratory
manual (Antibiotics monographs, 2). New York: Medical Encyclopedia Inc ., 1955.
GUERRA, M. P.; NODARI, R. O. Biodiversidade: aspectos biológicos, geográficos,
legais e éticos. In: SIMÕES, C. M. O. et al. Farmacognosia:. 2. ed. Florianópolis/
Porto Alegre: UFSC/ UFRGS, 2001. p. 13-26.
GUFFEY, J. S.; WILBORN, J. In vitro bactericidal effects of 405-nm and 470-nm blue
light. Photomedicine and Laser Surgery, v. 24, n. 6, p. 684-688, 2006.
HAMBLIM, M. R.; HASAN, R. Photodynamic therapy: a new antimicrobial approach
to infectious disease? Photochemical & Photobiological Sciences, v. 3, n. 5,
p.436-450, 2004.
HAMBURGER, M.; HOSTETTMANN, K.; Bioactivity in plants: The link between
phytochemistry and medicine. Phytochemistry, v. 30, n. 12, p. 3864-3874, 1991.
HAMMER, M. L. A.; JOHNS, E. A. Tapping an Amazonian p lethora: four medicinal
plants of Marajó Islands, Pará (Brazil). Journal of Ethnopharmacology, v. 40, n. 1,
p. 53-75, 1993.
HARVEY, A. Strategies for discovering drugs from previously unexplored natural
products. Drug Discovery Today, v. 5, n. 7, p. 294, 2000.
HENDERSON, B. W.; DOUGHERTY, T. J. How does photodynamic therapy work?
Photochemistry and Photobiology, v. 55, n. 1, p. 145-157, 1992.
HENNIG, S.; WAI, S. N.; ZIEBUHR, W. Spontaneous switch to PIA -independent
biofilm formation in an ica-positive Staphylococcus epidermidis isolate. International
Journal of Medical Microbiology, v. 297, n. 2, p. 117-133, 2007.
105
HOLMBERG, S. D., SOLOMON, S. L., BLAKE, P. A. Health and economic impacts of
antimicrobial resistance. Reviews of Infectious Diseases., v. 9, n. 6, p. 1065-1078,
1987.
HUANG, Z. A review of progress in clinical photodynamic therapy. Technology in
Cancer Research & Treatment., v. 4, n. 3, p. 283-293, 2005.
IANI, V.; MOAN, J.; MA, L. W. Measurements of light penetration into human tissues
in vivo. Proceedings SPIE , v. 2625, n. 1, p. 378-383, 1996.
JACOB, S. W.; FRANCONE, C. A.; LOSSOW, W. J. Pele. In: JACOB, S. W.;
FRANCONE, C. A.; LOSSOW, W. J. Anatomia e fisiologia humana. Rio de
Janeiro: Guanabara Koogan, 1990. p. 79-86.
JUZENIENE, A.; MOAN, J. The history of PDT in Norway Part one: Identification of
basic mechanisms of general PDT. Photodiagnosis and photodynamic Therapy,
v. 4, n. 1, p. 3-11, 2007.
KANTONIS, G.; TRIKERIOTIS, M.; GHANOTAKIS, D. F. Biocompatible
protoporphyrin IX -containing nanohybrids with potential applications in photodynamic
therapy. Journal of Photochemistry and Photobiology A: Chemistry, v. 185, n. 1,
p. 62-66, 2007.
KENDALL, C. A.; MORTON, C. A. Phtodynamic therapy for the treatment of skin
disease. Technology in Cancer Research & Treatment, v. 2, n. 4, p. 283-288,
2003.
KENNEDY, J. C.; POTTIER, R. H.; PROSS, D. C. Photodynamic therapy with
endogenous protoporphyrin : IX: Basic principles and present clinical experience
Journal of Photochemistry and Photobiology B: Biology, v. 6, n. 1 -2, p. 143-148,
1990.
KERR, J. F.; WYLLIE, A. H.; CURRIE, A. R. Apoptosis: a biological phenomenon
with wide-ranging implications in tissue kinetics, British Journal of Cancer, v. 26, n.
4, p. 239-257, 1972.
KESSEL, D.; LUO, Y. Mitochondrial photodamage and PDT-induced apoptosis.
Journal of Photochemistry and Photobiology B: Biology, v. 42, n. 2, p.89-95,
1998.
KÖMERIK, N.; WILSON, M. Factors influencing the susceptibility of gram-negative
bacteria to toluidine blue O-mediated lethal photosensitization. Journal of Applied
Microbiology, v. 92, N. 4, p. 618-623, 2002.
KÖNIG, K. et al. Red light kills bacteria via photodynamic action. Cellular and
Molecular Biology, v. 46, n. 7, p. 1297-1303, 2000.
KORBELIK, M. Induction of tumor immunity by photodynamic therapy. Journal of
Clinical Laser Medicine & Surgery, v. 14, n. 5, p. 329-334, 1996.
106
KUNIYUKI, S.; NAKANO, K.; MAKAEWA, N.; SUZUKI, S. Topical antibiotic treatment
of impetigo with tetracycline. The Journal of Dermatology, v. 32, n. 10, p. 788-792,
2005.
KURACHI, C. et al. Implantação clínica da terapia fotodinâmica no Brasil: breve
histórico e resultados avançados. Revista da Sociedade Brasileira de
Cancerologia, v.20, n. 1, p. 33-41, 2002.
LAGROTA, M. H. C. et al. Inhibitory activity of extracts of Alternanthera brasiliana
(Amaranthaceae) against the Herpes simplex virus. Phytotherapy Research, v. 8, n.
6, p. 358-361, 1994.
LANCHA, M. R. P. et al. Candida dubliniensis: necessidad de establecer in
diagnóstico correcto. Revista Cubana de Medicina Tropical, v. 58, n. 3, p. 0-0,
2006. Disponível em:<http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S037507602006000300014&lng=pt&nrm=iso>. Acesso em: 05 maio 2008.
LEVINSON, W.; JAWETZ, E. Microbiologia médica e imunologia, 7. ed. Porto
Alegre: Artmed, 2005. p. 101-104.
LORENZI, H.; MATOS, F. J. A. Plantas medicinais no Brasil – nativas e exóticas.
Nova Odessa: Instituto Plantarum do Estudo da Flora, 2002. 511 p.
MACEDO, A. F. et al. Pharmacological and phytochemical studies of callus culture
extracts from Alternanthera brasiliana. Pharmazie, v. 54, n. 1, p. 776-777, 1999.
MACEDO, A. F. et al. Preliminary phytochemical and pharmacological studies on
plantlets of Alternanthera brailiana cultured under different spectral quality of lights.
Acta Farmacéutica. Bonaerense, v. 23, n. 4, p. 515-519, 2004.
MACHADO, A. E. H. Terapia fotodinâmica: Princípios, Potencial de aplicação e
perspectivas. Química Nova, v. 23, n. 2, p. 237-243, 2000.
MACIEL, M. A. M. et al. Medicinal plants: the need for multidisciplinary scientific
studies. Química Nova, v. 25, n.1, p. 429- 438, 2002.
MACK, D. et al. Mechanisms of biofilm formation in Staphylococcus epidermidis and
Staphylococcus aureus: functional molecules, regulatory circuits, and adaptative
responses. International Journal of Medical Microbiology, v. 294, n. 2-3, p. 203212, 2004.
MACROBERT, A. J.; BOWN, S. G.; PHILLIPS, D. What are the idea properties of a
photosensitizer? In: Photosensitizing compounds: their chemistry, biology and
clinical use. Chinchester: Wiley, 1989. p. 4-16.
MANCINE, B. Obtenção de princípios ativos vegetais. Racine, v. 0, n. 1, p. 54-55,
1996.
MANYAK, M. J. PHOTOD YNAMIC THERAPY PRESENT CONCEPTS AND
FUTURE APPLICATION. Cancer journal, V. 3, N. 2, P. 104-109, 1990.
107
MCGOWAN, J. E. Is antimicrobial resistance in hospital microorganisms related to
antibiotic use? Bulletin of the New York Academy of Medicine, v. 63, n. 3, p. 253268, 1987.
MEIS, J. F. et al. Candida dubliniensis candidemia in patients with chemotherapyinduced neutropenia and bone marrow transplantation. Emerging Infectious
Diseases, v. 5, n. 1, p. 150-153, 1999.
MICHELIM, L. et al. Pathogenicity factors and antimicrobial resistance of
Staphylococcus epidermidis associated with nosocomial infections occurring in
intensive care units. Brazilian Journal of Microbiology, v. 36, n. 1, p. 17-23, 2005.
MOLPUS, K. L. Intraperitoneal photodynamic therapy of human epithelial o varian
carcinomatosis in a xenograft murine model. Cancer Research, v. 56, n. 5, p. 10751082, 1996.
MONTANARI, C. A.; BOLZANI, V. S. Planejamento racional de fármacos baseado
em produtos naturais. Química Nova, v. 24, n. 21, p. 105-111, 2001.
MORRIS, A. D. Cellulitis and erysipelas. BMJ Clinical evidence. London: BMJ
Publishing Group, 2007.
MUNIN, E. et al. Study of germ tube formation by Candida albicans after
photodynamic antimicrobial chemotherapy (PACT). Journal of Photochemistry and
Photobiology B: Biology, v. 88, n. 1, p. 16-20, 2007.
MURRAY, P. R. et al. Microbiologia médica, 4. ed. Rio de Janeiro: Guanabara
Koogan, 2002. p. 188-201.
NATIONAL COMMITTEE FOR CLINICAL LABORATORY STANDARDS. Methods
for dilution in antimicrobial susceptibility tests. Approved standard M2-A5.
Villanova, PA: National Committee for Clinical Laboratory Standard, 1993.
NATIONAL COMMITTEE FOR CLINICAL LABORATORY STANDARDS. Reference
method for broth dilution antifungal susceptibility testing of conidium-forming
filamentous fungi. Proposed standard M38-P. Wayne, Pa: National Committee for
Clinical Laboratory Standard, 1998. 28 p.
NEIDLE, E. A.; YAGIELA, J. A. Farmacologia e terapêutica para dentistas. 3 ed.
Rio de Janeiro: Guanabara Koogan, 1991. p. 483-499.
NEWMAN, T. J., CRAGG, G. M., SANDER, K. M. Natural products as sources of
new drugs over the period 1981- 2002. Journal of Natural Products, v. 66, n. 7, p.
1002, 2003.
NIKAIDO, H. Prevention of drug access to bacterial targets: permeability barrier and
active efflux. Science, v. 264, n. 5157, p. 362-368, 1994.
NISENGARD, R. J.; NEWMAN, M. G. Microbiologia oral e imunologia. Rio de
Janeiro: Guanabara Koogan, 1994, 395 p.
108
OCHSNER, M. Photodynamic therapy: the clinical perspective. Review on
applications for control of diverse tumorous and non-tumorous diseases.
Arzneimittel-Forschung, v. 47, n. 11, p. 1185-1194, 1997a.
OCHSNER, M. Photophysical and photobiological process in photodynamic therapy
of tumors, Journal of Photochemistry and Photobiology B: Biology, v. 39, n. 1, p.
1-18, 1997b.
O’DONNELL, C. A. et al. A cost comparison of photodynamic therapy and metallic
stents in the palliation of oesophageal cancer. Photodiagnosis and Photodynamic
therapy, v. 4, n. 1, p. 65-70, 2007.
ODDS, F. C.; BERNAETS, R. CHROMagar Candida a new diferential isolation
medium for presumptive identification of clinically important Candida species. J. Clin.
Microbiol., v. 32, n. 8, p. 1923-1929, 1994.
OKEKE, M. J. et al. Evaluation of extracts of the root of Landolphia owerrience for
antibacterial activity. Journal of Ethnopharmacology, v. 78, n. 2-3, p.119-127,
2001.
OLEINICK, N. L. Apoptosis in response to photodynamic therapy, Photodynamic
news, v. 6, p. 8-9, 1998.
OLEINICK, N. L.; MORRIS, R. L.; BELICHENKO, I. The role of apoptosis in response
to photodynamic therapy: what, where, why, and how. Photochemical &
Photobiological Sciences, v. 1, n. 1, p. 1-21, 2002.
ORENSTEIN, A. et al. A comparative study of tissue distribution and phodynamic
therapy selectivity of chlorine e6, Photofrin II and ala-induced protoporphyrin IX in a
colon carcinoma model. British Journal of Cancer, v. 73, n. 8, p. 937-944, 1996.
PENG, Q.; MOAN, J.; NESLAND, J. M. Correlation of subcellular and intratumoral
photosensitizer localization with ultrastructural features after photodynamic therapy.
Ultrastructural Pathology, v. 20, n. 2, p. 109-129, 1996.
PEREIRA, D.F. et al. Antimicrobial activity of crude extract and fractions from
Alternanthera brasiliana (L.) O. Kuntze leaves. Latin American Journal of
Pharmacy, v.26, n.6, p.893-896, 2007.
PERUSSI, J. R. Inativação fotodinâmica de microorganismos. Química Nova, v. 30,
n. 4, p. 1 -7, 2007.
PINJON, E. et al. Azole susceptibility and resistance in Candida dubliniensis.
Biochemical Society Transactions, v. 33, n. 5, p. 1210-1214, 2005.
PINTO, A. C. et al. Produtos naturais: atualidade, desafios e perspectivas. Química
Nova, v. 25, n. 1, p. 45-61, 2002.
PRISTA, L. N.; ALVES, A. C. Técnica farmacêutica e farmácia galênica. 1. ed.
Lisboa: Fundação Calouste Gulbenkian, 1967. 786 p.
109
PRISTA, L. N. et al. Tecnologia Farmacêutica. 6. ed. Lisboa: Fundação Calouste
Gulbenkian, 2003. 786 p.
RAAB, O. Uber die wirkung fluoriziender stoffe auf infusorien. Zeitschrift für
Biologie, v.39, p. 524-546, 1900.
RANG, H. P. et al. Farmacologia. Tradução da 5ª Edição Americana. Rio de
Janeiro: Elsevier, p. 704-742, 2003.
RENOUX, R. A via cutânea. In: LE BLANC et al. Tratado de biofarmácia e
farmacocinética, Lisboa: Minerva, 1997. p. 124-129.
ROBBERS, J. E.; SEEDIE, M. K.; TYLER, V. E. Farmacognosia e
Farmacobiotecnologia. São Paulo: Editorial Premier, 1997. 372 p.
SALVADOR, M. J. Estudo químico, biológico e biotecnológico de Alternanthera
maritima e Alternanthera tenella (Gomphreneae, Amaranthaceae). 2005. 410 f.
Doutorado (Doutorado em Ciências - Área Química), Faculdade de Filosofia,
Ciências e Letras de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto.
2005.
SALVADOR, M. J. et al. Bioactivity of crude extracts and some constituents of
Blutaparon portulacoides (Amaranthaceae). Phytomedicine, v. 9, n. 6, p. 566-571,
2002.
SALVADOR, M. J. et al. Comparative study of antibacterial and antifungal activity of
callus culture and adults plants extracts from Alternanthera maritima
(Amaranthaceae). Brazilian Journal of Microbiology, v. 35, n. 1 -2, p. 131-136,
2003.
SALVADOR, M. J. et al. In vitro antimicrobial activity of crude extracts and isolated
constituents of Alternanthera maritima (Amaranthaceae). Pharmaceutical Biology,
v. 42, n. 2, p. 138-148, 2004.
SEGALLA, A. et al. Photophysical, photochemical and antibacterial photosensitizing
properties of a novel octacationic Zn(II)-phtalocyanine. Photochemical &
Photobiological Sciences, v. 1, n. 9, p. 641-648, 2002.
SHIBLI, J. A. et al. Lethal photosensitization in microbiological treatment of ligadureinduced peri-implantitis: a preliminary study in dogs. Journal of Oral Science, v. 45,
n. 1, p. 17-23, 2003.
SCHNEIDER, J. E. et al. Methylene blue plus light mediates 8-hydroxy-2’deoxyguanosine formation in DNA preferentially over strand breakage. Nucleic
Acids Research, v. 18, n. 3, p. 631-635, 1990.
SIEVERT, D. et al. Staphylococcus aureus resistant to vancomycin. Morbidity and
Mortality Weekly Report, v. 51, n. 26, p. 565-567, 2002.
SILVA, N. C. B. et al. Developmental effects of additional ultraviolet a radiation,
growth regulators and tyrosine in Alternanthera brasiliana (L.) Kuntze cultured in
vitro. Brazilian archives of biology and technology, v. 48, n. 5, p. 779-766, 2005.
110
SIQUEIRA, J. C. A família Amaranthaceae nas restingas do Brasil. Acta Biologica
Leopoldensia, v. 9, n.1, p.99-110, 1987a.
SIQUEIRA, J. C. Amarantaceae de Mata Atlântica. Acta Biologica Leopoldensia,
v.12, n.1, p. 165-173, 1990.
SIQUEIRA, J. C. Flora do Estado de Goiás. Goiânia: CEGRAF-UFG, 1989. 44 p .
(Coleção Rizzo. Amarantaceae; v.12).
SIQUEIRA, J. C. Importância alimentícia e medicinal das Amaranthaceaes do Brasil.
Acta Biologica Leopoldencia, v. 9, n.1, p. 5-22, 1987b.
SIQUEIRA, J. C. Phytogeography of brazilian Amarantaceae. Pesquisa Botânica, v.
01, p. 5-21, 1994/1995.
SIQUE IRA, J. C.; GUIMARÃES, E.F. Amaranthaceae do Rio de Janeiro – gênero
Alternanthera Forsskal. Rodriguésia, v. 36, n.58, p. 21-40, 1984.
SOLBAN, N.; RIZVI, I.; HASAN, T. Targeted photodynamic therapy. Laser in
Surgery and Medicine, v. 38, n. 5, p. 522-531, 2006.
SOUKOS, N. S. et al. Photodynamic effects of toluidine blue on human oral
keratinocytes and fibroblasts and Streptococcus sanguis evaluated in vitro. Lasers in
surgery and medicine, v. 18, n. 1, p. 253-259, 1996.
SOUZA, M. M. de. et al. Analgesic properties of a hydroalcoholic extract obtained
from Alternanthera brasiliana. Phytotherapy Research, v. 12, n. 1, p. 279-281,
1998.
SOUZA , S. C. de. et al. Photosensitization of different Candida species by low
power laser light. J. Photochemistry and Photobiology B: Biology, v. 83, n. 1, p.
34-38, 2006.
SULLIVAN, D. J.; COLEMAN, D. Candida dubliniensis: Characteristics and
identification. Journal of Clinical Microbiology, v. 36, n. 2, p. 329-334, 1998.
TEICHERT, M. C. et al. Treatment of oral candidiasis with methylene blue -mediated
photodynamic therapy in na immunodeficient murine model. Oral Surgery, Oral
Medicine, Oral Pathology, Oral Radiology & Endodontics, v. 93, n. 2, p. 155-160,
2002.
THOMPSON, J. E. A prática farmacêutica na manipulação de medicamentos.
Porto Alegre: Artmed, 2006. p. 210-365.
TOLEDO, A. C. O. et al. Fitoterápicos: uma abordagem farmacotécnica. Revista
Lecta, v. 21, n. 1-2, p. 7-13, 2003.
TOMLINSON, E. Theory and practice of site -specific drug delivery, Advanced Drug.
Delivery Reviews., v.1, n. 2, p.87, 1987.
111
TORTORA, G. J.; FUNKE, B. R.; CASE, C. L. Microbiologia . 8. ed. São Paulo:
Artmed, 2005. 894 p.
TRABULSI, L. R.; ALTERTHUM, F. Microbiologia . 4. ed. São Paulo: Atheneu,
2004/2005. 718 p.
TSUCHIYA, H. et al. Comparative study o n the antibacterial activity of phytochemical
flavanones against methicillin-resistant Staphylococcus aureus. Journal of
Ethnopharmacology, v. 50, n. 1, p.27-34, 1996.
TUNGER, O. et al. Evaluation of rational antibiotic use. International Journal of
Antimicrobial Agents, v. 15, n. 2, p. 131-135, 2000.
USACHEVA, M. N. et al. Effect of Ca2+ on the photobactericidal efficacy of methylene
blue and toluidine blue against gram-negative bacteria and the dye affinity for
lipopolysaccharides. Lasers in Surgery and Medicine, v. 38, n. 10, p. 946-954,
2006.
USACHEVA, M. N.; TEICHERT, M. C.; BIEL, M. A. Comparison of the methylene
blue and tuluidine blue photobactericidal efficacy against gram-positive and gramnegative microorganisms. Lasers in surgery and medicine, v. 29, n. 2, p. 165-173,
2001.
VIVONI, A. M.; MOREIRA, B. M. Application of molecular techniques in the study of
Staphylococcus aureus clonal evolution – A review. Memórias do Instituto
Oswaldo Cruz, v. 100, n. 7, p. 693-698, 2005.
VON EIFF, C.; PETERS, G.; HEILMANN, C. Pathogenesis of infections due to
coagulase-negative staphylococci. The Lancet Infectious Diseases., v, 2, n. 11, p.
677-685, 2002.
WAGNER, H. et al. Effects of various vehicles on the penetration of flufenamic acid
into human skin. European Journal of Pharmaceutics and Biopharmaceutics, v.
58, n. 1, p. 121, 2004.
WAINWRIGHT, M. Photodynamic antimicrobial chemotherapy. Journal of
Antimicrobial Chemotherapy, v. 42, n. 1, p.13-28, 1998.
WILSON, M. Photolysis of oral bacteria and its potential use in the treatment of caries
and periodontal disease. Journal of Applied Bacteriology, v. 75, n. 4, p. 299-306,
1993.
WILSON, M.; DOBSON, J.; HARVEY, W. Sensitization of Streptococcus sanguis to
killing by low-power laser light. Lasers in Medical Science, v. 8, n. 1, p. 69-73,
1993.
WILSON, M.; MIA, N. Sensitization of Candida albicans to killing by low-power laser
light. Journal of Oral Pathology & Medicine, v. 22, n. 8, p. 354-357, 1993.
WILSON, M.; PRATTEN, J. Lethal photosensitizaztion of Staphylococcus aureus.
Microbios, v. 78, n. 1, p. 163-168, 1994.
112
WOOD, S . et al. An in vitro study of the use of photodynamic therapy for treatment of
natural oral plaque biofilms formed in vivo. Journal of Photochemistry and
Photobiology B: Biology, v. 50, n. 1, p. 1-7, 1999.
YAMADA, C. S. B. Fitoterapia, sua história e importância. Revista Racine, v. 50, n.
1, p.50-51, 1998.
YAMAGUCHI, F.; TAKAHASHI, H.; TERAMOTO, A. Photodiagnosos for frameless
stereotactic biopy of brain tumor. Photodiagnosis and Photodynamic therapy, v.
4, n. 1, p.71-75, 2007.
YECHIEL, E. Interactive Vehicles in Synergistic Cosmeceuticals: Advances in NanoEncapsulation, Transportation, Transfer, and Targeting. The Journal of topical
formulation, Santo Antonio, Ca., jul. 2004. Disponível em
<http://www.elsomresearch.com> [s.d], acesso em: 28 mar. 2008.
YUNES, R. A.; CALIXTO, J. B. Plantas Medicinais sob a ótica da química
medicinal moderna. Chapecó: Argos, p. 17-47, 2001.
ZACCHINO, S. Estratégias para a descoberta de novos agentes antifúngicos. In:
YUNES, R. A.; CALIXTO, J. B. Plantas medicinais sob a ótica da química
medicinal moderna. Chapecó: Argos, p. 47-75, 2001.
ZANIN, I. C. J. et al. Terapia fotodinâmica na odontologia (T.F.D.). Revista Gaúcha
de Odontologia, v. 51, n.3, p. 179-182, 2003.
ZARUBAEV, V. V. et al. Photodynamic inactivation of influenza virus with fullerene
C60 suspension in allantoic fluid. Photodiagnosis and Photodynamic Therapy, v.
4, n. 1, p. 31-35, 2007.
ZEINA, B. et al. Killing of cutaneous microbial species by photodynamic therapy.
British Journal Of Dermatology, v. 144, n. 1, p. 274-278, 2001.
Download