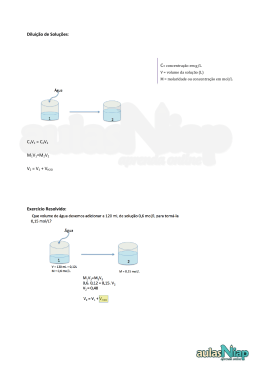
QUÍMICA - 3o ANO MÓDULO 23 UNIDADES DE CONCENTRAÇÃO DE SOLUÇÕES Como pode cair no enem (ENEM) Ao colocar um pouco de açúcar na água e mexer até a obtenção de uma só fase, prepara-se uma solução. O mesmo acontece ao se adicionar um pouquinho de sal à água e misturar bem. Uma substância capaz de dissolver o soluto é denominada solvente; por exemplo, a água é um solvente para o açúcar, para o sal e para várias outras substâncias. A figura a seguir ilustra essa citação. Suponha que uma pessoa, para adoçar seu cafezinho, tenha utilizado 3,42 g de sacarose (massa molar igual a 342 g/mol) para uma xícara de 50 ml do líquido. Qual a concentração final, em mol/L, de sacarose nesse cafezinho? a) 0,02 b) 0,2 c) 2 d) 200 Fixação 1) (ENEM) Determinada Estação trata cerca de 30.000 litros de água por segundo. Para evitar eriscos de fluorose, a concentração máxima de fluoretos nessa água não deve exceder a cerca -de 1,5 miligrama por litro de água. A quantidade máxima dessa espécie química que pode ser utilizada com segurança, no volume de água tratada em uma hora, nessa Estação, é: a) 1,5 kg b) 4,5 kg c) 96 kg d) 124 kg e) 162 kg Fixação Posto Densidade do combustível (g/L) 2) (ENEM) Pelas normas vigentes, o litro do I 822 álcool hidratado que abastece os veículos deve II 820 ser constituído de 96% de álcool puro e 4% III 815 de água (em volume). As densidades desses IV 808 componentes são dadas na tabela. V 805 Um técnico de um órgão de defesa do consumidor inspecionou cinco postos susA partir desses dados, o técnico pôde peitos de venderem álcool hidratado fora das concluir que estavam com o combustível normas. Colheu uma amostra do produto em adequado somente os postos: cada posto, mediu a densidade de cada uma, obtendo: a) I e II b) I e III Substância Densidade (g/L) c) II e IV Água 1000 d) III e V Álcool 800 e) IV e V Um técnico de um órgão de defesa do consumidor inspecionou cinco postos suspeitos de venderem álcool hidratado fora das normas. Colheu uma amostra do produto em cada posto, mediu a densidade de cada uma, obtendo: Fixação 3) (UERJ) Para evitar a proliferação do mosquito causador da dengue, recomenda-se colocar, nos pratos das plantas, uma pequena quantidade de água sanitária de uso doméstico. Esse produto consiste em uma solução aquosa diluída de hipoclorito de sódio, cuja concentração adequada, para essa finalidade, é igual a 0,1mol/L. Para o preparo de 500 ml da solução a ser colocada nos pratos, a massa de hipoclorito de sódio necessária é, em gramas, aproximadamente igual a: a) 3,7 lb) 4,5 c) 5,3 d) 6,1 Fixação 4) A concentração do cloreto de sódio, na água do mar, é, em média, de 2,95 g/L. Assim sendo, a concentração molar deste sal na água do mar é, aproximadamente, de: a) 0,050 b) 0,295 c) 2,950 d) 5,000 e) 5,850 Fixação 5) (UERJ) Uma solução aquosa de cloreto de cálcio (CaCl2), soluto totalmente dissociado, foi preparada pela dissolução de 22,2 gramas do referido soluto, em água suficiente para 500 ml de solução. A concentração de íons cloreto, em mol/litro de solução, é igual a: a) 0,2 b) 0,4 c) 0,6 d) 0,8 e) 1,0 Fixação 6) (UERJ) Numa certa região oceânica, os níveis de mercúrio na água e nos peixes são, respectivamente, de 0,05 e 200 ppb. Sabe-se que 1 ppb corresponde a 1 mg por tonelada. Comparando-se pesos iguais de peixes e 1,0 de água, o fator que expressa a relação entre as massas de mercúrio nos peixes e na água, é: a) 4,0 . 103 b) 2,5 . 10−4 c) 2,5 . 103 d) 4,0 . 10−4 Fixação 7) (UERJ) Certos medicamentos são preparados por meio de uma série de diluições. Assim, utilizando-se uma quantidade de água muito grande, os medicamentos obtidos apresentam concentrações muito pequenas. A unidade mais adequada para medir tais concentrações é denominada ppm: 1 ppm corresponde a 1 parte de soluto em 1 milhão de partes de solução Considere um medicamento preparado com a mistura de 1g de um extrato vegetal e 100 kg de água pura. A concentração aproximada desse extrato vegetal no medicamento, em ppm, está indicada na seguinte alternativa: a) 0,01 b) 0,10 c) 1,00 d) 10,00 Fixação 8) (UERJ) Em uma estação de tratamento de efluentes, um operador necessita preparar uma solução de sulfato de alumínio de concentração igual a 0,1 mol/L, para encher um recipiente cilíndrico, cujas medidas internas, altura e diâmetro da base, estão indicadas na figura abaixo. 10 dm 6 dm Considerando p = 3, a quantidade mínima de massa de sulfato de alumínio necessária para o operador realizar sua tarefa é, em gramas, aproximadamente igual a: a) 3321 b) 4050 c) 8505 d) 9234 Fixação 9) (UFF) Dentre as soluções cogitadas para o problema da seca no Nordeste, pensou-se na perfuração de poços artesianos de grande profundidade e na dessalinização da água do mar, processos considerados economicamente inviáveis para utilização em larga escala. A dessalinização deve remover, entre outros sais, os cerca de 3,5% de cloreto de sódio presentes na água do mar. Esse percentual equivale à seguinte concentração de NaCl: a) 0,2 Mol L–1 b) 0,4 Mol L–1 c) 0,6 Mol L–1 d) 0,8 Mol L–1 e) 1,0 Mol L–1 Fixação 10) (ENEM) Todos os organismos necessitam de água e grande parte deles vive em rios, lagos e oceanos. Os processos biológicos, como respiração e fotossíntese, exercem profunda influência na química das águas naturais em todo o planeta. O oxigênio é ator dominante na química e na bioquímica da hidrosfera. Devido a sua baixa solubilidade em água (9,0 mg/ a 20°C) a disponibilidade de oxigênio nos ecossistemas aquáticos estabelece o limite entre a vida aeróbica e anaeróbica. Nesse contexto, um parâmetro chamado Demanda Bioquímica de Oxigênio (DBO) foi definido para medir a quantidade de matéria orgânica presente em um sistema hídrico. A DBO corresponde à massa de O2 em miligramas necessária para realizar a oxidação total do carbono orgânico em um litro de água. (BAIRD, C. Química Ambiental. Ed. Bookman, 2005. Adaptado). Dados: Massas molares em g/mol: C = 12; H = 1; O = 16. Suponha que 10 mg de açúcar (fórmula mínima CH2O e massa molar igual a 30 g/mol) são dissolvidos em um litro de água; em quanto a DBO será aumentada? a) 0,4mg de O2/litro b) 1,7mg de O2/litro c) 2,7mg de O2/litro d) 9,4mg de O2/litro e) 10,7mg de O2/litro Fixação 11) (ENEM) O álcool hidratado utilizado como combustível veicular é obtido por meio da destilação fracionada de soluções aquosas geradas a partir da fermentação de biomassa. Durante a destilação, o teor de etanol da mistura é aumentado até o limite de 96% em massa. Considere que, em uma usina de produção de etanol, 800 kg de uma mistura etanol/água com concentração 20% em massa de etanol foram destilados, sendo obtidos 100 kg de álcool hidratado 96% em massa de etanol. A partir desses dados, é correto concluir que a destilação em questão gerou um resíduo com uma concentração de etanol em massa: a) de 0% b) de 8,0% c) entre 8,4% e 8,6% d) entre 9,0% e 9,2% oe) entre 13% e 14% Fixação 12) (UERJ) Suponha que, em alguns dos locais atingidos pela radiação, as pastilhas disponíveis continham, cada uma, 5 x 10−4 mol de iodeto de potássio, sendo a dose prescrita por pessoa de 33,2 mg por dia. Em razão disso, cada pastilha teve de ser dissolvida em água, formando 1L de solução. O volume da solução preparada que cada pessoa deve beber para ingerir a dose diária prescrita de iodeto de potássio corresponde, em mililitros, a: a) 200 b) 400 c) 600 d) 800 Fixação 13) (ENEM) A varfarina é um fármaco que diminui a agregação plaquetária, e por isso é utilizada como anticoagulante, desde que esteja presente no plasma, com uma concentração superior a 1,0 mg/L. Entretanto, concentrações plasmáticas superiores a 4,0 mg/L podem desencadear hemorragias. As moléculas desse fármaco ficam retidas no espaço intravascular e dissolvidas exclusivamente no plasma, que representa aproximadamente 60% do sangue em volume. Em um medicamento, a varfarina é administrada por via intravenosa na forma de solução aquosa, com concentração de 3,0 mg/ml. Um indivíduo adulto, com volume sanguíneo total de 5,0 L, será submetido a um tratamento com solução injetável desse medicamento. Qual é o máximo volume da solução do medicamento que pode ser administrado a esse indivíduo, pela via intravenosa, de maneira que não ocorram hemorragias causadas pelo anticoagulente? a) 1,0 ml b) 1,7 ml c) 2,7 ml d) 4,0 ml e) 6,7 ml Fixação 14) (UERJ) Com as chuvas intensas que caíram na cidade do Rio de Janeiro em março de 2013, grande quantidade de matéria orgânica se depositou na lagoa Rodrigo de Freitas. O consumo biológico desse material contribuiu para a redução a zero do nível de gás oxigênio dissolvido na água, provocando a mortandade dos peixes. O volume médio de água na lagoa é igual a 6,2 x 106 L. Imediatamente antes de ocorrer a mortandade dos peixes, a concentração de gás oxigênio dissolvido na água correspondia a 2,5 x 10-4 mol . L-1. Ao final da mortandade, a quantidade consumida, em quilogramas, de gás oxigênio dissolvido foi igual a: Dado: O = 16. a) 24,8 b) 49,6 c) 74,4 d) 99,2 Proposto 1) Qual massa de soluto devemos dissolver, em água, para preparar 60 gramas de solução a 25% m/m? Proposto 2) Qual é a massa de água presente numa solução a 25% m/m que possui 20 g de soluto? Proposto 3) Calcule a molaridade de uma solução de KOH 8,4% em massa, sabendo que a massa específica desta solução é de 1,25 g/cm3. Proposto 4) Uma solução de um sal a 15% em massa, pesa 1200 g. Calcule a massa de sal que deve ser adicionada à solução aquosa para torná-la 20% em massa. Proposto 5) Calcule o volume de solvente presente em 20 ml de uma solução a 2,5% em volume. Proposto 6) Qual massa de soluto dissolvida em 500 ml de uma solução cuja concentração é 80 g/L? Proposto 7) Determine a massa de NaOH presentes em 400 ml de uma solução 0,15 M deste soluto. Dados: (Na = 23; O = 16; H = 1) Proposto 8) Calcule o volume de uma solução aquosa de HNO3 M/2, sabendo que ela contém 126 g de soluto. Dados: (H = 1; N = 14; O = 16). Proposto e9) Determine a concentração comum de uma solução aquosa de etanol a 42% P/V. Proposto 10) 1kg de uma solução de H2SO4 contém 196g desse ácido. Sabendo-se que a massa específica da solução é de 1,6g/cm3, calcule a sua molaridade. Proposto -11) (UNIRIO) Num exame laboratorial, foi recolhida uma amostra de sangue, sendo o plasma separado dos eritrócitos, ou seja, deles isolado antes que qualquer modificação fosse feita na concentração de gás carbônico. Sabendo-se que a concentração de CO2, neste plasma foi de 0,025mol/L, essa mesma concentração, em g/L, é de: a) 1760 b) 6.10-4 c) 2,2 d) 1,1 e) 0,70 Proposto 12) (UFF) O rótulo de uma solução de ácido clorídrico comercial indica HCl 37,4 % em peso e 1,18g.ml-1 em densidade. Determine a molaridade do HCl nesta solução. Proposto o13) (UFF) Uma amostra de nitrato de sódio pesando 0,38g é colocada em um balão volumétrico de 50,0ml. Adiciona-se água até completar o volume. Com base nestes dados e -1 sabendo-se que o peso molecular do composto equivale a 85g.mol , pode-se dizer que a molaridade da solução resultante será: a) 0,0001M b) 0,0010M c) 0,0440M d) 0,0445M e) 0,0890M
Baixar