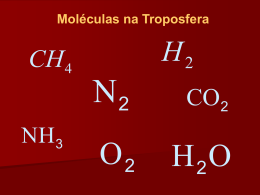
Química Orgânica Cursos: Farmácia, Análises Clínicas e Saúde Pública, Dietética e Nutrição Programa 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. Ligação covalente e formas de moléculas Ácidos e Bases; Alcanos e Cicloalcanos; Alcenos e Alcinos Reacções de alcenos e alcinos Estereoquímica; Haletos de alquilo Álcoois, Éteres, e Tióis Benzenos e seus derivados Aminas Cetonas e aldeidos Ácidos Carboxílicos Derivados funcionais de ácidos carboxilicos Infravermelho e Espectrometria de Massa Ressonância Magnética Nuclear Bibliografia W. Brown, T. Poon, Organic Chemistry, 4th Edition, John Wiley & Sons, Ásia, 1976. L. G. Wade Jr, Organic Chemistry, 5th Edition, Pearson Education Inc, New Jersey, 2003. K. P. C. Volhart, Organic Chemistry, 3rd Ed, McGraw-Hill, 1999. S. H. Pine, Organic Chemistry, 5th Ed, McGraw-Hill, New York,1988. J. Clayden, N. Greeves, S. Warren, P. Wothers, Organic Chemistry, 1st Ed, Oxford University press, 2001. D. G. Morris, Stereochemistry, 1st Ed, Royal Society of Chemistry, 2001. F. D. Gunstone, Guia de Estereoquímica, 1st Ed, Escolar Editora, 1985 Avaliação A avaliação de conhecimentos das aulas teóricas será feita através de duas frequências (70% no total). A avaliação dos conhecimentos das aulas práticas será feita através de um teste escrito que conta com 30% para a nota final. Só serão admitidos a exame final os alunos que tenham tido nota igual ou superior a 10 no teste prático e tenham frequência de prática (2/3 do número de aulas práticas = 8 presenças).. A nota final por frequência = (1ª+2ª notas de frequência)x0,7 + nota das práticas 0,3 A nota final do exame = nota do exame x 0,7 + nota das práticas 0,3. É condição essencial para concluir a cadeira que a nota final seja superior ou igual a 10 e tenha frequência das aulas práticas correspondente a 2/3 do número de aulas dadas. 1- Ligação covalente e formas de moléculas O que é a Química Orgânica? É a química dos compostos de carbono. Contudo os compostos orgânicos podem conter também hidrogénio, oxigénio, azoto, fósforo, enxofre ou halogéneos. Perspectiva Histórica Compostos orgânicos sempre foram utilizados na antiguidade: para fazer chás e poções medicinais; combustão de óleos e gorduras para aquecer ou fazer luz é uma conversão química. 1814 Berzelius determinou o a percentagem de carbono e hidrogénio por combustão de uma quantidade exacta de ácido acético. 1828 Wöhler sintetizou a ureia apartir de cianato de amónio; NH4CNO → H2NCONH2 1832 Wöhler and Liebig usaram o conceito de radical orgânico (C6H5CO-, o benzoil permanece inalterável em numerosas reacções orgânicas). 1895 Kekulé publicou a estrutura do benzeno. A quimica orgânica tornou-se importante economicamente nos fins do sec XIX começo do sec XX com a produção de corantes e explosivos. O começo da era da quimica orgânica ocorreu em meados do sec XX com a produção em larga escala de polímeros, o desenvolvimento da industria farmacêutica, na agricultura os fertilizantes, etc [Pine, p2] Uso de Compostos Orgânicos O N H H N X O acrilatos estireno O Cl cloreto de vinilo indigo; côr dos jeans O OEt N N N Me NH H3 CO N Me S N O O HO baunilha O Viagra OH H O cis- jasmone: componente principal do perfume jasmin mentol Como podemos descrever a estrutura electrónica do átomo Figura esquemática do átomo: Um pequeno núcleo de diâmetro 10-14 - 10-15 m, que contém a carga positiva dos protões, os neutrões, e a maioria da massa do átomo. O espaço extranuclear de diâmetro 10-10 m, que contém a carga electrões. negativa dos Electrões são confinados a regiões do espaço chamados níveis principais de energia (camadas) Cada camada pode ter 2n2 electrões (n = 1, 2, 3, 4......). Camadas são divididas em subcamadas chamadas orbitais, as quais são designadas por letras s, p, d,........ s (uma por camada) p (três por camada com inicio na camada 2) d ( cinco por camada com inicio na 3) ... Configurações Electrónicas Principio de energia minima: colocar os electrões de mais baixa energia primeiro. Regra de Hund: Orbitais de igual energia primeiro são semipreenchidas e só depois são preenchidas. Configuração Electrónica dos elementos da primeira e segunda linha da Tabela Periódica Ligações Químicas Ligação iónica: electrões são transferidos. Ligação covalente: o par de electrões é partilhado. Estrutura de Lewis Gilbert N. Lewis Camada de valência: a última camada de um átomo. Electrões de valência: Electrões na camada de valência de um átomo. Estes electrões são usados para formar as ligações químicas. Estrutura de Lewis de um átomo O símbolo de um átomo representa o núcleo e todas as camadas internas dos electrões. Os pontos representam os electrões de valência. Estrutura de Lewis para os elementos 1-18 da Tabela Periódica Modelo de ligação de Lewis Atoms bond together so that each atom in the bond acquires the electron configuration of the noble gas nearest it in atomic number. Aum átomo que ganha electrões torna-se um anião. Um átomo que perde electrões torna-se um catião. Ligação iónica: é a ligação química que resulta de uma atracção electrostática entre anião e catião. Ligação covalente: é ligação química que resulta de dois átomos partilharem um ou mais pares de electrões. Classificamos uma ligação química como iónica, covalente polar, e covalente não polar baseada na diferença de electronegatividade entre os átomos ligados. Electronegatividade e Polaridade da Ligação Electronegatividade: a medida da força de atracção pelos electrões partilhados na ligação química com outro átomo. Escala de Pauling Aumenta da esquerda para a direita no periodo. Aumenta de baixo para cima no grupo. Classificação das ligações químicas Ligações iónicas Uma ligação iónica forma-se por transferência de electrões de uma camada de valência de um átomo de electronegatividade baixa para a camada de valência para um átomo de mais alta electronegatividade. Na(1s22s 22p 63s1 ) + F(1s 22s2 2p5 ) Na+(1s2 2s22p 6) + F-(1s2 2s2 2p6 ) Mostramos a transferência de um electrão por uma meia seta curva Ligações covalentes A ligação covalente forma-se quando os pares de electrões são partilhados entre dois átomos, cuja diferença de electronegatividades é 1,9 ou inferior. Um exemplo de ligação covalente entre dois átomos de hidrogénio. O par de electrões partilhados completa a camada de valência de cada hidrogénio. Ligações covalentes polares Estruturas de Lewis H O H H 2O (8) Wate r H Cl HCl (8) Hydroge n ch loride H H C H H CH 4 (8) Me th an e H N H H N H 3 (8) Amm oni a Estruturas de Lewis H C C H C 2H 2 (10) Acetylen e H H C C C H H C 2H 4 (12) Ethylene O H O H CH 2O (12) Methanal H C O O H H 2CO 3 (24) Carbonic acid Estruturas de Lewis Em moléculas contêm C, H, N, O, e halogénio Hidrogénio tem uma ligação. Carbono tem 4 ligações electrões não partilhados. Azoto tem 3 ligações e 1 par de electrões não partilhados. Oxigénio tem 2 ligações e 2 pares de electrões não partilhados. Halogénio tem 1 ligação e 3 pares de electrões não partilhados. Carga formal dos átomos Carga formal : é a carga no átomo de uma molécula ou ião poliatómico. Escreva a estrutura de Lewis Determine para cada átomo todos os electrões não partilhados e metade dos electrões partilhados (na ligação). Compare este numero com com o número de electrões de valência em neutro, no átomo não ligado. Se o número é inferior ao determinado ao átomo não ligado, o átomo terá a carga formal positiva. Se o número é maior, o átomo tem carga formal negativa. # of valen ce Fo rmal = electro ns in charge unb ond ed atom on e-half all unshared + of all shared electrons electrons Teoria do VSEPR (Valence-shell Electron-Pair Repulsion) VSEPR é baseada em dois conceitos Átomos são rodeados por regiões de densidade electrónica Regiões de densidade elctrónica repelem-se entre si. Moléculas polares e não polares A molécula é polar se Tiver ligações polares e Se o centro da carga positiva é diferente do centro da carga negativa. Insert elpot of carbon d ioxid e (page 19) + O C O Carbon d ioxid e (n on polar) O H + H Water (polar) Insert elpot of w ater (page 19) Ressonância Ressonância É a forma de descrever moléculas ou iões para as quais não existe uma estrutura única de Lewis com representação adequada. Setas curvas: Um símbolo usado para mostrar a redistribuição de electrões de valência. No uso de setas curvas , há apenas dois tipos de redistribuição electrónica: Apartir de uma ligação para o átomo adjacente. Apartir de um átomo para uma ligação adjacente As setas curvas indicam movimento de electrões Exemplo de ressonância N itrite ion (equivalent contributing stru ctures) O O N N O O Ethan oate ion (equivalent CH3 C contributing stru ctures) O O O CH3 C A estrutura verdadeira é um híbrido de ressonância Todos os comprimentos da ligação são iguais. O Forma de ressonância mais contributiva Todas as estruturas contributivas têm que ter: 1. O mesmo número de electrões de valência. 2. Obedecer às regras da ligação covalente. Não mais de 2 electrões na camada de valência do átomo de H. Não mais de 8 electrões na camada de valência de elementos do segundo periodo. Elementos do 3º periodo podem ter mais de 12 electrões na camada de valência. 3. Diferem sómente na distribuição electrónica dos electrões de valência. 4. Têm o mesmo número de pares de electrões electrões partilhados e não partilhados. Formas das orbitais atómicas Todas as orbitais s têm a forma de uma esfera, com o seu centro no núcleo. Das orbitais s, a orbital 1s é a mais pequena, a orbital 2s é maior, e a orbital 3s ainda é maior. Formas das orbitais átomicas A orbital p consiste em dois lobos dispostos em linha reta com o núcleo. Ligação segundo a teoria das orbitais moleculares A ligação covalente forma-se quando uma porção da orbital átomica de um átomo se sobrepõe à orbital átomica de outro átomo. Na formação da ligação covalente H-H, por exemplo, há a sobreposição de orbitais 1s de cada hidrogénio. Orbitais híbridas O problema: Sobreposição de orbitais atómicas 2s e 2p dará ângulos de ligação de 90º. Em vez disso os ângulos de ligação são aproximadamente de 109.5°, 120°, e 180°. A solução Hibridização de orbitais atómicas. Elementos do 2º periodo usam orbitais hibridas sp3, sp2, e sp para formar ligação. Orbitais híbridas Estudamos 3 tipos de orbitais atomicas hibridas: sp3 (uma orbital s + três orbitais p orbitals dão quatro orbitais sp3). sp2 (uma orbital s + duas orbitais p dão três orbitais sp2). sp (uma orbital s + uma orbital p dão duas orbitais sp). A sobreposição de orbitais hibridas podem formar dois tipos de ligações, dependendo da geometria de sobreposição: Ligações são formadas por sobreposição “directa”. Ligações são formadas por sobreposição “paralela”. Orbitais híbridos 3 sp Cada orbital hibrido sp3 tem dois lobos desiguais. As quatro orbitais hibridas sp3 são direccionadas aos cantos de um tetrahedro regular, em ângulos de 109.5°. Figura mostra orbitais hibridas sp3. Orbitais híbridas 3 sp Figure mostra orbitais moleculares do metano, amónia e água. Orbitais híbridos 2 sp Uma orbital hibrida sp2 tem dois lobos de tamanho desigual. As três orbitais hibridas sp2 são direccionadas para os cantos de um triângulo equilátero formando ângulos de 120°. A orbital 2p é perpendicular ao plano de três orbitais sp2 . Orbitais híbridos 2 sp Figure mostra a ligação covalente no etileno. Etileno é uma molécula planar. Orbitais híbridos 2 sp Figura mostra a ligação dupla de carbono-oxigénio que consiste em uma ligação sigma () e uma ligação pi (). Orbitais híbridos sp Uma orbital hibrida sp hybrid orbital tem dois lobos de tamanho desigual. As duas orbitais hibridas sp alinham numa linha de ângulo de 180°. Orbitais híbridos sp Figura mostra ligação covalente no acetileno. A ligação tripla carbono-carbono consiste em uma ligação sigma () e duas ligações pi (). Orbitais híbridas Table mostra a ligação covalente do carbono Grupos funcionais Grupo funcional: Um átomo ou grupo de átomos dentro de uma molécula que mostra propriedades fisicoquímicas características. Grupos funcionais são importantes por três razões, são elas: São as unidades pelas quais dividimos os compostos orgânicos em classes. São os sítios de reacções químicas caracteristicas. A base para nomear os compostos orgânicos. Grupos funcionais Alcool: composto que contém o grupo -OH (hydroxyl group) ligado ao átomo de carbono tetraédrico. HH H- C-C- O- H H H An al coh ol (Eth an ol ) Grupos funcionais Amina: o composto que contém um grupo amina – o átomo de azoto ligado a um, dois ou três átomos de carbono. Aminas são classificadas como 1°, 2°, e 3° de acordo com o número de carbonos ligados directamente ao átomo de azoto. CH3 N H H (a 1° amine) CH3 N H CH3 N CH3 CH3 (a 2° amin e) CH3 (a 3° amine) Grupos funcionais Grupo Carbonilo (C=O) de aldeídos e cetonas. O CH3 -C-H An aldeh yd e O CH3 -C-CH3 A ketone Grupos funcionais Grupo Carboxilo de ácidos carboxilicos. O CH3 -C-O-H Acetic acid or CH3 COOH or CH3 CO2 H Ácidos e Bases Ácidos e Bases de Arrhenius Ácidos dissociam-se em água para dar iões H3O+. Bases dissociam-se em água para dar iões OH-. Kw = [H3O+ ][OH- ] = 1.0 x 10-14 at 24°C pH = -log [H3O+ ] Ácidos and bases fortes dissociam-se 100%. Com bases, a situação é ligeiramente diferente. Muitas bases são hidróxidos de metal como KOH, NaOH, Mg(OH)2, e Ca(OH)2. Estes compostos são sólidos iónicos e, quando se dissolvem em água, os seus iões simplesmente se separam. NaOH(s) H2 O Na+ (aq) + OH (aq) Outras bases não são hidróxido, estas bases produzem OH- por reacção com moléculas de água. NH3 ( aq) + H2 O(l) NH4 + ( aq) + OH- (aq) Usamos setas curvas para mostrar a transferência do protão apartir da água para a amónia. Ácidos e Bases segundo BrØnstedLowry Ácidos podem dar um protão. Bases podem aceitar um protão. Pares de ácido-base conjugados. con jugate acid-bas e pair con jugate acid-bas e pair HCl( aq) Hydrogen chloride (acid ) + H2 O(l) Water (b ase) Cl-( aq) + Chlorid e ion (conjugate bas e of HCl) H3 O+ (aq) Hydron ium ion (conjugate acid of H 2 O) Força do ácido e da base Constante de dissociação do ácido, Ka Constante de dissociação da base, Kb Pares conjugados, (Ka)(Kb) = Kw Reacções de ácido e base ocorrem espontaneamente do forte para o fraco. O CH3 COH O + NH3 Acetic acid Ammonia pK a 4.76 (stron ger bas e) (s tronger acid) CH3 CO- + NH4 + A cetate ion Ammon ium ion (w eak er b ase) pK a 9.24 (w eaker acid ) Estrutura e acidez Factores que determinam a acidez relativa de um ácido orgânico têm a ver com a estabilidade relativa de anião, A-, formado quando o ácido, HA, transfere o protão para a base. Consideramos 4 factores: Electronegatividade do átomo ligado ao H no HA Ressonância que estabiliza o A- Efeito indutivo O tamanho e deslocalização da carga no A- Electronegatividade À medida que a ligação de hidrogénio se torna mais polarizada, ou seja o átomo (C, N, O, F) é mais electronegativo, o anião é mais estável logo o H torna-se mais positivo e a ligação é mais fácil de quebrar. Ressonância, deslocalização da carga no A- Deslocalização da carga negativa na base conjugada estabiliza o anião, portanto a substância é um ácido forte. Mais estruturas de ressonância significa uma maior estabilidade. Ressonância, deslocalização da carga no A Compare a acidez do ácido carboxilico e do álcool, ambos contêm o grupo hidroxilo. Ácidos carboxilicos são ácidos fracos. Para maioria dos ácidos carboxilicos não substituidos os valores de pKa estão entre 4 e 5. CH3 COOH + H2 O + CH3 COO + H3 O pKa = 4.76 Álcoois são ácidos muito fracos. Valores de pKa para a maioria dos álccois estão entre 15 a 18. CH3 CH 2 O-H + H2 O An alcoh ol CH3 CH2 O- + H3 O+ An alkoxid e ion pKa = 15.9 Ressonância, deslocalização da carga no A Quanto maior a estabilização por ressonância do anião, maior a acidez do composto. Não há ressonância do anião alcóxido. Podemos escrever duas estruturas equivalentes para o anião de carboxilato; a carga negativa está espalhada pelos dois átomos de oxigénio. O O CH3 C + O H H2 O CH3 C O CH3 C O + + H3 O O The carboxylate an ion is stabilized by delocalization of th e negative ch arge Efeito indutivo Efeito Indutivo polarização da densidade electrónica transmitida através da ligação covalente, pela átomo vizinho de elevada electronegatividade,. Tamanho À medida que o tamanho aumenta, o H é menos ligado e a ligação é mais fácil de quebrar. O tamanho maior estabiliza o anião, porque a carga negativa está deslocalizada. Ácidos e Bases de Lewis Ácidos aceitam pares de electrões = electrófilo Bases dão pares de electrões = nucleófilo CH2 CH2 nucleófilo + BF3 electrófilo _ BF3 CH2 + CH2 FIM
Baixar