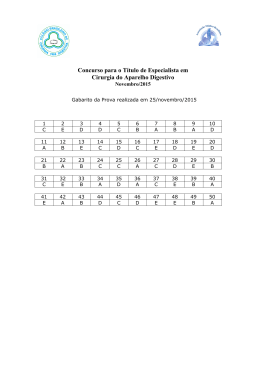
REVISÃO Indicações da cirurgia conservadora no câncer de mama Indications for conservative surgery in breast cancer Luiz Henrique Gebrim1 Jorge Y. Shida2 André Mattar3 Marcelo Madeira4 Palavras-chave Mama Neoplasias Câncer Radioterapia Terapêutica Cirurgia conservadora Linfadenectomia Recidiva Resumo O rastreamento mamográfico aumentou o número de pacientes em estádios iniciais do câncer de mama, que propiciaram a realização de estudos randomizados sobre cirurgia conservadora. Esses estudos demonstraram que a cirurgia conservadora associada à radioterapia, indicada em tumores com até 3 cm de diâmetro, não modifica a sobrevida após 25 anos de seguimento, apesar de acarretar um aumento significativo de recidiva local. Abstract Screening mammography has increased the number of patients in early stages of breast cancer, which led to randomized studies on conservative surgery. These studies demonstrate that conservative surgery combined with radiotherapy, indicated in tumors with up to 3 cm, does not alter survival after 25 years of follow-up, despite a significant increase of local recurrence. Keywords Breast Neoplasms Cancer Radiotherapy Therapeutics Conservative surgery Lymph node excision Recurrence Professor Livre-Docente da Disciplina de Mastologia da Universidade Federal de São Paulo – UNIFESP – São Paulo (SP); Diretor do Centro de Referência da Saúde de Mulher do Hospital Pérola Byington - São Paulo (SP); Editor da Revista Brasileira de Mastologia. Doutor em Mastologia pela Universidade Federal de São Paulo – UNIFESP – São Paulo (SP); Chefe do Núcleo de Mastologia do Hospital Pérola Byington. 3 Pós-graduando da Disciplina de Mastologia da Universidade Federal de São Paulo – UNIFESP – São Paulo (SP); Médico Assistente do Núcleo de Mastologia do Hospital Pérola Byington. 4 Mestre em Mastologia pela Universidade Federal de São Paulo – UNIFESP – São Paulo (SP) Endereço para correspondência: Luiz Henrique Gebrim – Rua Mato Grosso, 366, cj. 1.611 – Higienópolis – CEP 01239-040 – São Paulo (SP), Brasil. 1 2 Gebrim LH, Shida JY, Mattar A, Madeira M Introdução A cirurgia foi, durante muitas décadas, o principal sustentáculo na terapêutica do câncer de mama, fundamentado na maior radicalidade cirúrgica. Pouco se conhecia a respeito da história natural da neoplasia, prevalecendo, desde o século passado, o conceito de que o câncer da mama era uma doença locorregional com propagação linfática. Estudos experimentais fundamentados em achados clínicos mudaram esse conceito. Os linfonodos, antes considerados filtros naturais de células metastáticas, passaram a representar o grau de disseminação da doença e o prognóstico. Considera-se, assim, o carcinoma da mama como doença de complexa etiologia, evolução longa e metastatização precoce, que ocorre tanto por via linfática como hematogênica já na fase pré-clínica. O rastreamento mamográfico permitiu aumentar o número de casos diagnosticados no estádio I de 15% para até 65%, permitindo uma abordagem menos radical no tratamento cirúrgico das formas iniciais da doença. Estudos randomizados, com mais de 20 anos de seguimento clínico, demonstram, em pacientes selecionadas, que a cirurgia conservadora seguida de radioterapia apresenta resultados semelhantes aos da mastectomia1(A). Entende-se por cirurgia conservadora a realização da retirada do tumor circundada por margem de tecido sadio com aceitável resultado estético (setorectomia, ressecção ampliada ou quadrantectomia) seguida de radioterapia. A avaliação cirúrgica da axila é considerada parte da cirurgia conservadora da mama. A presença de comprometimento linfonodal axilar não representa contraindicação à cirurgia conservadora2(A). Atualmente, a maioria das mulheres com tumores T1 e T2 (<3 cm) são potenciais candidatas à cirurgia conservadora. Em pacientes com tumores >3 cm, deve-se avaliar a possibilidade de quimioterapia primária para redução do volume tumoral e excisão com margens cirúrgicas adequadas, sem comprometimento da cosmética. A utilização de técnicas oncoplásticas pode facilitar a obtenção de margens livres nessas situações, mas exige equipe com experiência. Na impossibilidade de obtenção de margens livres, com resultado cosmético adequado, deve-se indicar a mastectomia, assim como no caso de dificuldade de acesso da paciente à radioterapia ou seguimento periódico2(D). Para fins didáticos, a cirurgia e a radioterapia integrantes da terapêutica locorregional são consideradas indispensáveis para o controle local do câncer. Nas formas iniciais, são capazes de promover a cura das pacientes. Nos tumores avançados, são indispensáveis para o controle locorregional, propiciando melhora na qualidade de sobrevida. O rastreamento mamográfico aumentou o número de casos iniciais de câncer e proporcionou 594 FEMINA | Novembro 2010 | vol 38 | nº 11 às pacientes uma menor radicalidade da cirurgia, reduzindose não só a morbidade e o linfedema, mas, principalmente, o impacto da mutilação. Outros fatores que contribuíram para consolidar a cirurgia conservadora foram o número crescente de tumores iniciais diagnosticados nos programas de rastreamento e o aprimoramento da radioterapia. Metodologia Descrição do método de coleta de evidência A revisão bibliográfica de artigos científicos dessa diretriz foi realizada nas bases de dados Medline, Cochrane e SciELO. A busca de evidências partiu de cenários clínicos reais com a utilização de palavras-chaves (MeSH terms) agrupadas nas seguintes sintaxes: Breast Neoplasm OR Breast Cancer AND Antineoplastic Combined Chemotherapy AND Radiotherapy, Adjuvant AND Mastectomy, Radical AND Mastectomy, Segmental AND Mastectomy, Subcutaneous AND Mammaplasty AND Neoplasm Staging AND Neoplasm Invasiveness AND Neoplasm Metastasis AND Neoplasm Recurrence AND Axilla AND Nipples AND Lymph Node Excision AND Sentinel Lymph Node Biopsy AND Carcinoma, Ductal, Breast AND Lymphatic Metastasis AND Disease-Free Survival. Grau de recomendação e força de evidência: A: Estudos experimentais ou observacionais de melhor consis- tência. B: Estudos experimentais ou observacionais de menor consis- tência. C: Relatos de casos (estudos não controlados). D: Opinião desprovida de avaliação crítica, baseada em consensos, estudos fisiológicos ou modelos animais. Objetivo Verificar o prognóstico após o tratamento cirúrgico do câncer de mama, em especial a chance de recidiva, comparando as cirurgias conservadoras e as radicais. Cirurgia conservadora Entende-se por cirurgia conservadora a realização da retirada do tumor circundada por margem de tecido sadio, com aceitável resultado estético (setorectomia, ressecção ampliada ou quadrantectomia), seguido de radioterapia. O tratamento cirúrgico do câncer inicial da mama modificou-se dramaticamente nas últimas décadas. Indicações da cirurgia conservadora no câncer de mama Avaliando-se mulheres com idade média de 50 anos (SD= ±10 anos) portadoras de câncer de mama, com tumor ≤2 cm de diâmetro clínico (T1), sem linfonodos axilares palpáveis (N0), submetidas à mastectomia radical (Halsted) ou à quadrantectomia associada à radioterapia (dose de 50 Gy), ambas combinadas à dissecção axilar completa, observa-se que, no período de seguimento médio de 20 anos, a probabilidade de recorrência do tumor é significativamente maior nas pacientes submetidas à cirurgia conservadora (quadrantectomia): 8,8 versus 2,3% das tratadas pela mastectomia, IC95%: 3% a 10%). Entretanto, considerando-se a incidência de carcinoma na mama oposta (9,7% e 8,2%) e metástases à distância (23,7 e 23,2%), não se observa diferença significativa respectivamente para mastectomia radical e cirurgia conservadora1(A). Outros estudos randomizados, com mais de 15 anos de seguimento clínico, demonstraram em pacientes com tumores de até 3 cm de diâmetro que a cirurgia conservadora seguida de radioterapia apresenta sobrevida global semelhante à da mastectomia, apesar da maior incidência de recidiva local1-3(A). Atualmente, a maioria das mulheres com tumores T1 e T2 (<3 cm) são potenciais candidatas à cirurgia conservadora, a depender do volume mamário, idade, multicentricidade da neoplasia, achado mamográfico, dentre outros. Os tumores com diâmetro inferior a 1 cm são preferencialmente tratados pela ressecção ampliada, por permitirem, em geral, obter margens livres com mais de 1 cm de extensão, com o mínimo de deformidade estética e, consequentemente, maior segurança oncológica1,2(A). Em pacientes com tumores >3 cm e menores que 5 cm, sem comprometimento de pele, deve-se avaliar individualmente a possibilidade de quimio ou hormonioterapias primárias e, caso haja redução do volume tumoral, indica-se a cirurgia conservadora apenas em tumores únicos, bem definidos pela mamografia (mamas gordurosas), sem microcalcificações após a avaliação criteriosa das margens cirúrgicas3,4(B). A utilização de técnicas oncoplásticas pode facilitar a reconstrução mamária após ressecções mais amplas em casos em que haja a necessidade de ampliação das margens cirúrgicas, mas exige equipe com experiência. Na impossibilidade de obtenção de margens livres, com resultado cosmético adequado, deve-se indicar a adenectomia ou a mastectomia. Havendo dificuldade no acesso da paciente à radioterapia complementar ou seguimento periódico, deve-se optar pelo tratamento radical1-4(A). A avaliação cirúrgica dos linfonodos axilares é considerada parte da cirurgia conservadora da mama no carcinoma invasivo. A presença de comprometimento linfonodal axilar não representa contraindicação à cirurgia conservadora, mas sinaliza maior risco de recidiva local e pior prognóstico5(B). A biópsia do linfonodo sentinela (BLS) tornou-se o procedimento padrão para o estadiamento axilar em pacientes com câncer inicial de mama, pela elevada acurácia como preditiva do comprometimento linfonodal axilar5,6(A). Estudos prospectivos randomizados com mais de sete anos de seguimento em mulheres submetidas à BLS e/ou à linfadenectomia, com BLS positiva, não observaram diferença significativa na taxa de recidiva local entre os dois procedimentos5-8(B). Entretanto, é ligeiramente maior o risco de recidiva em linfonodos axilares. Assim, a biópsia do linfonodo sentinela apresenta-se como alternativa segura e efetiva à linfadenectomia, apresentando reduzida morbidade em membro superior em relação ao linfedema e perda sensorial (RR=0,23 com IC95%: 0,23 a 0,60; e RR=0,37) 6-8(A). Pela baixa prevalência de comprometimento metastático do linfonodo sentinela em pacientes com carcinoma ductal in situ (CDIS), a biópsia do mesmo não se justifica quando o diagnóstico de CDIS acontecer após o estudo histopatológico da lesão totalmente removida. Nos tumores multicêntricos em que se indica a mastectomia, há maior risco de se detectar focos de invasão. Nesses casos, recomenda-se pesquisa do linfonodo sentinela9,10(B). As principais contraindicações à realização da cirurgia conservadora são os tumores multicêntricos, mamas pequenas ou dificuldades de se efetuar a radioterapia, como gravidez, tratamento prévio com radioterapia torácica e doenças do colágeno1-4(A). Apesar de haver maior risco de deformidade e encapsulamento, o uso de prótese não contraindica a radioterapia nem a cirurgia conservadora. Inúmeros relatos atestam maior risco (3 a 4 vezes maior) de recidiva local em pacientes jovens submetidas a tratamento conservador. No entanto, não existe contraindicação formal à sua realização1-3,4(B). Adenectomia ou adenomastectomia Embora não seja propriamente uma cirurgia conservadora, a adenectomia, ou adenomastectomia, busca a preservação da pele e complexo aréolo-papilar, sendo uma alternativa nos tumores multicêntricos. Tem como fundamento básico apenas a remoção do corpo mamário, sendo que cerca de 10% da glândula permanece junto ao tecido adiposo. Trata-se de um procedimento com menor risco de recidiva local em tumores multicêntricos, nos estádios I e II, principalmente em jovens com mamas pequenas11(B). O complexo aréolo-papilar (CAP) era removido na adenomastectomia por acreditar-se que seus ductos adjacentes pudessem conter células tumorais que se disseminariam distalmente ao longo dos ductos a partir do tumor primário. Evidências recentes têm FEMINA | Novembro 2010 | vol 38 | nº 11 595 Gebrim LH, Shida JY, Mattar A, Madeira M mostrado que o risco de envolvimento do complexo aréolo-papilar por tumor tem sido superestimado, sendo aceito atualmente um comprometimento variando de 5,6% a 10,6%11(B). Alguns fatores de risco têm sido associados com o comprometimento do complexo aréolo-papilar por células neoplásicas, tais como comprometimento linfonodal axilar, localização subareolar do tumor, distância entre tumor menor que 2,5 cm, multicentricidade e estadiamento tumoral11(B). Avaliandose mulheres pelo período médio de 59 meses, submetidas à adenomastectomia subcutânea e à mastectomia convencional (idade média de 49 e 59 anos, respectivamente) por câncer de mama invasivo ou não-invasivo, observa-se que a preservação do complexo aréolo-papilar nos casos de adenomastectomia subcutânea em que a biópsia de congelação intraoperatória do tecido subareolar apresenta-se negativa demonstra taxas de recorrência na ordem de 5% e 8% respectivamente, não revelando diferença significativa (p=0,666). Com relação às metástases à distância, observa-se ocorrência da ordem de 23% para a adenomastectomia subcutânea e 21% para a mastectomia convencional, não demonstrando diferença significativa (p=0,733)11(B). Radioterapia Trabalhos comparando resultados da mastectomia com a cirurgia conservadora e a radioterapia mostraram que a recorrência local foi de 2,3% no grupo da mastectomia e de 8,8% no grupo da radioterapia, sem diferenças na sobrevida atuarial global e livre de doença em 20 anos1-4(A). Observou-se, após atualização dos resultados do protocolo NSABP-06, em que 1.843 pacientes foram randomizadas para mastectomia ou tratamento conservador com ou sem radioterapia, que a sobrevida global em 20 anos foi de 46%, e a sobrevida livre de doença variou de 35% a 38%. Pacientes submetidas ao tratamento conservador exclusivo apresentaram recidiva local de 39,2%, comparado a 14,3% (p<0,001) naquelas submetidas à radioterapia1,2(A). Além do NSABP-06, outros estudos também avaliaram o papel da radioterapia após o tratamento conservador. Observa-se redução de recorrência local em dez anos de 24% para 8,5% (p=0,0001) com a adição da radioterapia8. Análise de quatro estudos randomizados com pacientes com diagnóstico de câncer de mama, estádio I ou II, concluíram que a radioterapia resultou em um aumento significante no controle locorregional, sobrevida livre de doença e uma redução de 17,5% na taxa de mortalidade1-3,13(A). Os principais fatores de risco para recorrência após tratamento conservador em tumores iniciais de mama são: tamanho 596 FEMINA | Novembro 2010 | vol 38 | nº 11 da lesão, comprometimento de linfonodos, idade, grau histológico, margens cirúrgicas, presença de carcinoma intraductal extenso (EIC) e receptores hormonais negativos1-4(A). Assim, alguns autores sugerem que, em casos de bom prognóstico, como lesões <1 cm, idade ≥50 anos, margens >1 cm , em que o índice de recidiva local é baixo, a radioterapia adjuvante poderia ser evitada1,14(B). Porém, no estudo conduzido pelo NSABP não foi detectada nenhuma condição clínica ou patológica que permitisse a omissão da radioterapia2(B). Outra dúvida em relação ao tratamento de pacientes com diagnóstico de câncer de mama foi esclarecida por meio do estudo NSABP21, que comprovou que a cirurgia conservadora com RT e tamoxifeno era mais efetiva do que o tamoxifeno exclusivo, mesmo no grupo de pacientes com receptores positivos e idade ≥60 anos. Dessa forma, a radioterapia deve ser utilizada como rotina após tratamento conservador2(B). A radioterapia deve ser realizada em toda mama com doses de 45 a 50 Gy, com frações de 1,8 a 2 Gy por dia. A utilização do reforço de dose no leito tumoral, também chamado de boost, se baseia no fato de que 65 a 80% das recidivas ocorrem nessa localização. Geralmente, o boost é administrado com doses de 10 a 20 Gy, com a utilização de elétrons ou braquiterapia, que pode ser de baixa ou alta taxa de dose. No estudo conduzido pelo European Organization for Research and Treatment of Cancer (EORTC) houve uma redução de recorrência local de 6,3% para 4,8% com a administração do boost. A técnica da radioterapia parcial vem sendo empregada. Ela consiste no emprego de uma alta dose por fração à cavidade cirúrgica com 1 a 2 cm de margem utilizando a braquiterapia ou feixe de radiação externo. Uma das vantagens seria a menor duração, em vez das seis semanas da radioterapia externa. As pacientes candidatas a esse tratamento seriam aquelas com tumores ≤3 cm, com linfonodos negativos, com ausência de componente intraductal extenso e margens negativas. Alguns autores também sugerem idade ≥45 anos12(B). Protocolos iniciais mostram o controle local semelhante à técnica convencional, mas maior recidiva (10%) nos demais quadrantes. Relevante crítica à essa técnica de tratamento está nos aspectos radiobiológicos em relação aos parâmetros, redistribuição, reparação e reoxigenação, explorados no fracionamento clássico e anteriormente mencionados. A resposta tardia do tecido normal como pele, tecido adiposo e muscular é também motivo de preocupação. Estudos fase III ainda são necessários para definição da irradiação parcial da mama como rotina no tratamento dessas pacientes. Conclui-se que a radioterapia parcial (intraoperatória) não deve ser indicada na prática clínica12(B). Indicações da cirurgia conservadora no câncer de mama Recidiva local A recidiva local no tratamento conservador ocorre entre 7% e 19%, respectivamente, após 10 e 20 anos. Cerca de 75% das recidivas localizam-se no quadrante operado, sendo diagnosticadas principalmente nos dois primeiros anos do tratamento. O aparecimento em quadrante distinto se relaciona mais com surgimento de novo foco primário, sendo geralmente mais tardias1-,3,13,14,16(A). As pacientes submetidas à mastectomia radical não estão isentas de recidivas, que ocorrem respectivamente entre 4 e 14% após 10 e 20 anos de seguimento1-4,13,16(A). A recidiva local e/ou locorregional estão associadas a elevado risco para o desenvolvimento de metástases em pacientes tratadas tanto por mastectomia quanto por cirurgia conservadora1-4,13(A). A recidiva local associa-se significativamente a um maior risco de morte, sobretudo em tumores negativos para receptores de estrogênio14, 15(B). A conduta cirúrgica depende da localização, do tipo da recidiva (nodu- lar ou linfangítica), do tempo de aparecimento e da forma de tratamento prévio. Em geral, recomenda-se novo ciclo de terapêutica sistêmica e, na ausência de doença sistêmica visceral, indica-se a mastectomia em casos de cirurgia conservadora prévia. Na ausência de radioterapia prévia, indica-se a complementação actínica1-4(A). Conclusões Conclui-se que pacientes com carcinoma de mama com até 3 cm de diâmetro podem ser submetidas à cirurgia conservadora, desde que as margens cirúrgicas estejam livres. A pesquisa do linfonodo sentinela tem alta acurácia e permite diminuir a morbidade do linfedema sem aumento da recidiva regional. A radioterapia complementar de toda mama deve ser indicada. Apesar de haver maior probabilidade de recorrência do tumor quando comparado à mastectomia radical, a sobrevida é semelhante. Nos tumores multicêntricos ou com margens comprometidas, a mastectomia ou adenectomia deve ser indicada. Leituras suplementares 1. 2. 3. 4. 5. 6. 7. 8. Veronesi U, Cascinelli N, Mariani L, Greco M, Saccozzi R, Luini A, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med. 2002;347(16):1227-32. Fisher B, Anderson S, Bryant J, Margolese RG, Deutsch M, Fisher ER, et al. Twentyyear follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med. 2002;347(16):1233-41. Schwartz GF, Veronesi U, Clough KB, Dixon JM, Fentiman IS, Heywang-Köbrunner SH, et al. Consensus conference on breast conservation. J Am Coll Surg. 2006;203(2):198-207. Gentilini O, Intra M, Gandini S, Peruzzotti G, Winnikow E, Luini A, et al. Ipsilateral breast tumor reappearance in patients treated with conservative surgery after primary chemotherapy. The role of surgical margins on outcome. J Surg Oncol. 2006;94(5):375-9 Cody HS 3rd. Clinical aspects of sentinel node biopsy. Breast Cancer Res. 2001;3(2):104-8. Naik AM, Fey J, Gemignani M, Heerdt A, Montgomery L, Petrek J, et al, The risk of axillary relapse after sentinel lymph node biopsy for breast cancer is comparable with that of axillary lymph node dissection: a follow-up study of 4008 procedures. Ann Surg. 2004;240(3):462-8. Canavese G, Catturich A, Vecchio C, Tomei D, Gipponi M, Villa G, et al. Sentinel node biopsy compared with complete axillary dissection for staging early breast cancer with clinically negative lymph nodes: results of randomized trial. Ann Oncol. 2009;20(6):1001-7. Mansel RE, Fallowfield L, Kissin M, Goyal A, Newcombe RG, Dixon JM, et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial. J Natl Cancer Inst. 2006;98(9):599-609. 9. Pendas S, Dauway E, Giuliano R, Ku N, Cox CE, Reintgen DS. Sentinel node biopsy in ductal carcinoma in situ patients. Ann Surg Oncol. 2000;7(1):15-20. 10. Intra M, Rotmensz N, Veronesi P, Colleoni M, Iodice S, Paganelli G, et al. Sentinel node biopsy is not a standard procedure in ductal carcinoma in situ of the breast: the experience of the European institute of oncology on 854 patients in 10 years. Ann Surg. 2008;247(2):315-9. 11. Gerber B, Krause A, Reimer T, Müller H, Küchenmeister I, Makovitzky J, et al. Skin-sparing mastectomy with conservation of the nipple-areola complex and autologous reconstruction is an oncologically safe procedure. Ann Surg 2003;238} (1):120-7. 12. Valachis A, Mauri D, Polyzos NP, Mavroudis D, Georgoulias V, Casazza G. Partial breast irradiation or whole breast radiotherapy for early breast cancer: a metaanalysis of randomized controlled trials. Breast J. 2010;16(3):245-51. 13. Veronesi U, Marubini E, Del Vecchio M, Manzari A, Andreola S, Greco M, et al. Local recurrences and distant metastases after conservative breast cancer treatments: partly independent events. J Natl Cancer Inst. 1995;87(1):19-27. 14. Haffty BG, Fischer D, Beinfield M, McKhann C. Prognosis following local recurrence in the conservatively treated breast cancer patient. Int J Radiat Oncol Biol Phys. 1991;21(2):293-8. 15. Anderson SJ, Wapnir I, Dignam JJ, Fisher B, Mamounas EP, Jeong JH, et al. Prognosis after ipsilateral breast tumor recurrence and locoregional recurrences in patients treated by breast-conserving therapy in five National Surgical Adjuvant Breast and Bowel Project protocols of node-negative breast cancer. J Clin Oncol. 2009;27(15):2466-73. 16. Botteri E, Bagnardi V, Rotmensz N, Gentilini O, Disalvatore D, Bazolli B, et al. Analysis of local and regional recurrences in breast cancer after conservative surgery. Ann Oncol. 2010;21(4):723-8. FEMINA | Novembro 2010 | vol 38 | nº 11 597
Download