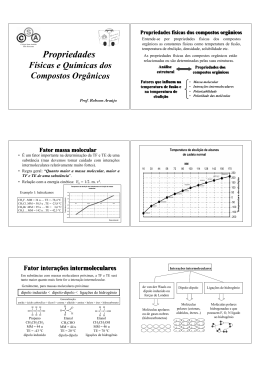
QUÍMICA PRÉ-VESTIBULAR LIVRO DO PROFESSOR Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br © 2006-2008 – IESDE Brasil S.A. É proibida a reprodução, mesmo parcial, por qualquer processo, sem autorização por escrito dos autores e do detentor dos direitos autorais. I229 IESDE Brasil S.A. / Pré-vestibular / IESDE Brasil S.A. — Curitiba : IESDE Brasil S.A., 2008. [Livro do Professor] 832 p. ISBN: 978-85-387-0577-2 1. Pré-vestibular. 2. Educação. 3. Estudo e Ensino. I. Título. CDD 370.71 Disciplinas Autores Língua Portuguesa Literatura Matemática Física Química Biologia História Geografia Francis Madeira da S. Sales Márcio F. Santiago Calixto Rita de Fátima Bezerra Fábio D’Ávila Danton Pedro dos Santos Feres Fares Haroldo Costa Silva Filho Jayme Andrade Neto Renato Caldas Madeira Rodrigo Piracicaba Costa Cleber Ribeiro Marco Antonio Noronha Vitor M. Saquette Edson Costa P. da Cruz Fernanda Barbosa Fernando Pimentel Hélio Apostolo Rogério Fernandes Jefferson dos Santos da Silva Marcelo Piccinini Rafael F. de Menezes Rogério de Sousa Gonçalves Vanessa Silva Duarte A. R. Vieira Enilson F. Venâncio Felipe Silveira de Souza Fernando Mousquer Produção Projeto e Desenvolvimento Pedagógico Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br Propriedades físicas: acidez e basicidade dos compostos orgânicos •• dipolo permanente – dipolo permanente moléculas polares ⇔ (aldeídos, cetonas, haletos e éteres) (dipolo – dipolo) As propriedades físicas dos compostos podem ser interpretadas, e muitas vezes até previstas, a partir do conhecimento das ligações químicas que unem os átomos de suas moléculas e das forças que agem entre elas, chamadas forças intermoleculares. Neste módulo, vamos estudar a influência dessas forças nas seguintes propriedades físicas: solubilidade, ponto de fusão e ponto de ebulição. Temperatura de ebulição Depende diretamente das forças intermoleculares e do tamanho das moléculas. Vamos avaliar a seguir essas influências. a) Forças intermoleculares Ao longo das mudanças de fase pode ocorrer um afastamento (quando aquece) ou uma aproximação (quando resfria) das moléculas, logo: quanto maior a intensidade das forças intermoleculares ⇒ maior será a energia neces sária para a mu dança de fase. ⇒ maior será a temperatura de ebulição. EM_V_QUI_033 Forças intermoleculares: •• dipolo induzido – dipolo induzido (Van der Waals) moléculas apolares ⇔ (Hidrocarbonetos em geral) •• pontes de hidrogênio ⇔ moléculas muito polares (ácidos, álcoois, aminas) b) Tamanho das moléculas Sabe-se que quanto maior forem as moléculas, maior será a sua superfície, facilitando um maior n.° de interações com as moléculas vizinhas, levando a um aumento da temperatura de ebulição. maior será a superfície quanto maior o tamanho das moléculas maior número de interações maior será o ponto de ebulição Concluindo: Levando em conta os fatores citados, podemos estabelecer que: I. Se as moléculas tiverem tamanhos aproximadamente iguais: Quanto maior for a intensidade das forças intermoleculares, maior será o seu ponto de ebulição. dipolo induzido – dipolo induzido < dipolo – dipolo < Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br pontes de hidrogênio 1 Quanto maior for o tamanho das moléculas maior será o seu ponto de ebulição. Polaridade dos compostos orgânicos Como muitas das funções derivam de hidrocarbonetos pela substituição de um ou mais átomos de hidrogênio por outros átomos ou grupos de átomos, e levando em consideração que os hidrocarbonetos são apolares, os compostos formados são, em geral, polares. `` Casos e exemplos: •• Forças de Van der Waals ⇒ Hc. •• dipolo – dipolo ⇒ aldeído, cetona, haletos e éteres •• pontes de hidrogênio ⇒ álcool, ácidos e aminas Concluímos que: I. Os Hc. devem apresentar temperaturas de ebulição menores que as das outras funções. II. Os álcoois, ácidos e aminas devem apresentar temperaturas de ebulição maiores que as outras funções. Logo: etano (– 88°C) < etanal (20°C) < etanol (78,5°C) Por outro lado, em uma mesma função, ou seja, em um mesmo tipo de interação, quanto maior o tamanho da molécula, maior será a temperatura de ebulição. `` Exemplo: metanol (64°C) < etanol (78,5°C) < propanol-1 (97°C) Nos casos de compostos com ramificações, quanto maior a quantidade de ramificações, a estrutura do composto torna-se mais compacta e a sua superfície diminui, logo diminui a temperatura de ebulição. `` Exemplo: pentano (36°C) > metil butano (28°C) > dimetil propano (9,5°C) 2 Solubilidade de compostos orgânicos A solubilidade depende diretamente das forças intermoleculares, assim temos que: Substâncias apolares tendem a se dissolver em solventes apolares • Substâncias polares tendem a se dissolver em solventes polares • Logo: Semelhante dissolve semelhante. Levando em conta que tanto a água, quanto os álcoois são solventes polares e que quanto maior o tamanho menor é a sua solubilidade em água. Temos que , por isto, quando a cadeia aumenta predomina a parte apolar, diminuindo a solubilidade. Pontos de fusão Seguem um raciocínio semelhante ao dos pontos de ebulição, onde: •• Quanto mais fortes forem as interações (forças de atração) entre as moléculas no estado líquido (ou sólido), maiores serão as temperaturas de fusão e de ebulição. Os raciocínios que levam aos conceitos ácidobase são muito importantes para reconhecer a acidez dos compostos, assim como a sua basicidade, este será o estudo do nosso método. Acidez em moléculas orgânicas Conceitos fundamentais Ressonância ou deslocalização de elétrons Se desenharmos a fórmula de Lewis para o composto SO, verificamos estas duas possibilidades. S S O O O O Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 II. Para as moléculas com o mesmo tipo de interação, temos que: Possibilidade A (fórmulas de Lewis) S S O O O O “passeio” acompanhando as setas em vermelho e lembrando que equivale à , uma vez que cada traço (–) representa um par de elétrons: Possibilidade B (fórmulas estruturais) •• No caso A, a dupla ligação está localizada à esquerda e, em B, à direita. •• Tanto em A como em B, os três átomos estão em posição idêntica e obedecem à regra do octeto. Diante disso, poderíamos pensar que o composto SO teria duas fórmulas de Lewis e duas estruturais, simultaneamente. Entretanto, verifica-se a existência de um único tipo de molécula SO, consequentemente, uma única fórmula deve representá-la. A estrutura verdadeira do SO não é A nem B, mas uma intermediária entre os dois casos, que pode ser representada assim: S S O O O O ou S O O EM_V_QUI_033 A seta com as duas pontas ou a linha tracejada indica que a dupla ligação não é fixa entre os dois átomos, mas está distribuída entre os três átomos que dela tomam parte, fenômeno conhecido como ressonância ou mesomeria. A estrutura real da molécula intermediária entre A e B é chamada híbrido de ressonância. Cada uma das estruturas possíveis que originam esse híbrido é chamada forma canônica ou forma contribuinte. No caso do composto SO, as formas canônicas são as representadas por A e B. Já no anel aromático proposto por Kekulé: Essa estrutura conseguiu, afinal, explicar o comportamento químico do benzeno. Foi, sem dúvida, uma ideia genial de Kekulé, que, na época, não conhecia as teorias eletrônicas das ligações químicas. De certa forma, Kekulé antecipou em 65 anos a ideia da ressonância no anel benzênico, que surgiu na Química somente em 1930. É conhecida a história de que Kekulé teria imaginado o anel benzênico, após ter sonhado com uma serpente mordendo a própria cauda. Já dissemos que a dupla ligação é formada por uma ligação , mais forte e uma ligação , mais fraca e mais “solta”. No caso do anel benzênico, temos três ligações duplas (isto é, três pares de elétrons ), que podem se movimentar com muita facilidade, dando origem a várias formas eletrônicas. A figura abaixo nos dá uma ideia dessa movimentação ou “passeio” dos elétrons ao longo do anel benzênico. Siga esse Formas de ressonância O sinal indicativo da ressonância é a seta dupla . Das formas mostradas anteriormente, são predominantes a primeira e a última. No entanto, nenhuma delas representa o benzeno satisfatoriamente. Na verdade, o benzeno é o híbrido (estado intermediário) dessa ressonância toda. É por esse motivo que se costuma dizer que, no anel benzênico, as duplas ligações não estão localizadas ou que são duplas deslocalizadas; assim, temos a melhor e mais simples representação do anel benzênico: ou ou O fenômeno da ressonância foi proposto por Linus Pauling, em 1930, e pode ser assim definido: Ressonância é a existência de várias disposições dos elétrons dentro de uma dada molécula, sem que haja mudança na posição dos átomos. Teorias ácido–base Ácidos e bases de Arrhenius A primeira conceituação mais precisa de ácidos e bases foi dada por Svante August Arrhenius (1859 – 1927), que, por esse motivo, recebeu o Prêmio Nobel de Química de 1903. Segundo Arrhenius: Ácidos são compostos que em solução aquosa se ionizam, produzindo como íon positivo apenas o cátion hidrogênio (H+). É o que acontece no exemplo: HC H+ + C – Bases são compostos que, por dissociação iônica, liberam como íon negativo apenas a hidroxila (OH –). É o que acontece no exemplo: NaOH Na+ + OH – Ácidos e bases segundo Brönsted-Lowry Em 1923, Johannes Nicolaus Brönsted (1879 – 1947) e Thomas Martin Lowry (1874 – 1936) propuseram, Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 3 independentemente, definições para ácidos e bases mais amplas do que as de Arrhenius, dizendo que: Ácido de Brönsted-Lowry é toda espécie química (molécula ou íon) capaz de ceder prótons (H+). Base de Brönsted-Lowry é toda espécie (molécula ou íon) capaz de receber prótons (H+). `` Exemplo: H+ HC + H2O Ácido H3O++ C – C O HH H H O H C Do fato de as reações desse tipo serem reversíveis, surgiu uma definição importante: Ácido e bases conjugados são os que se diferem entre si por um H+. No exemplo anterior: H+ H HC + CH3– OH Ácido CH3 – O – H + C Ácido Base OH O –+ H + R – OH R – OH – + H + c) os álcoois R – OH R – O – + H+ d) os alcinos verdadeiros (alcinos que possuem um hidrogênio ligado diretamente a um carbono de tripla ligação). R–C C–H R – C C + H+ Base Eletronicamente: H a 25°C, tem grau de ionização ( ) igual a 1,35% e constante de ionização (Ka) igual a 1,85.10– 5. b) os fenóis – Base Conjugados Conjugados Além disso, sabemos que um ácido é forte quando tem grande tendência de liberar o H+ (por exemplo, HC H++ C – ). É evidente que, se o HC tem muita tendência para liberar o H+ (reação direta muito intensa), o C – terá pouca tendência para receber o H+ de volta (reação inversa pouco intensa). Em outras palavras: se o ácido é forte, sua base conjugada será fraca e vice-versa. Os principais ácidos e bases da orgânica Verifica-se que o caráter ácido diminui acentuadamente na ordem dos exemplos, a, b, c e d, como podemos ver pela tabela a seguir: ácidos inorgânicos > ácidos carboxílicos > fenóis > água > álcoois > alcinos > alcanos Ka 105 10-5 10-10 10-16 10-18 10-25 10-40 O último valor (10– 40) é tão pequeno que, praticamente não haverá possibilidade de o hidrogênio soltar-se de um alcano, o que equivale a dizer que os alcanos não são ácidos. As principais bases da Química Orgânica são as aminas. As aminas podem ser consideradas como derivadas do NH pela substituição de um, de dois ou dos três hidrogênios por grupos alquila. Note então a semelhança: No amoníaco: NH3 + H+ NH4+ (íon amônio) Na amina: R – NH2 + H+ R – NH3+ (íon de alquil – amônio) Eletronicamente, temos: R – NH + H R – NH2 Os principais ácidos orgânicos são a) os ácidos carboxílicos O R–C 4 OH O R–C O – +H+ Em geral, são ácidos fracos; assim, por exemplo, o ácido acético (CH3 – COOH) em solução 0,1 molar, Veja que o par eletrônico livre do nitrogênio da amina recebeu o próton, caracterizando-se assim a basicidade da amina, segundo o conceito de Brönsted-Lowry. Muitas aminas têm “cheiro de peixe podre”, que desaparece, por exemplo, com vinagre (que contém ácido acético), comprovando a reação anterior. O que caracteriza a acidez nas principais funções orgânicas. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 H+ Fenóis O fenol comum tem caráter ácido fraco (por isso, seu nome antigo é ácido fênico), esse caráter é dado pela ressonância de um par de elétrons livres do oxigênio com o anel benzênico. O–H O–H O–H O–H Observamos que a ressonância facilita a saída do H+ e determina o caráter ácido aos compostos, por O outro lado a ressonância da carbonila ( • C • ) faz com que os ácidos percam as propriedades químicas dos aldeídos e cetonas. No entanto, o caráter ácido dos ácidos é fraco e pode ser medido pelo seu Ka (quanto maior, mais ácido). Vejamos então alguns exemplos: •• ácido fórmico (H – COOH) Ka = 1,77.10– 4 ; pKa = 3,75; •• ácido acético (CH3 – COOH) pKa = 4,75; O oxigênio, que fica parcialmente positivo, procura “expulsar” o hidrogênio que também é positivo, ocorrendo então a seguinte ionização: O–+H+ OH Ânion fenoxi, fenato ou fenolato O caráter ácido do fenol é fraco, como podemos comprovar comparando a ordem de grandeza de sua constante de ionização (Ka) com as de outras substâncias: Ácidos carboxílicos > Fenóis > Água > Álcoois > Alcanos –5 –10 (Ka 10 ) ( 10 ) ( 10–16) ( 10–18) ( 10–40) Ka = 1,76.10– 5; •• ácido propiônico (CH3 – CH2 – COOH) Ka= 1,34.10– 5; pKa = 4,87. É interessante observar que a força dos ácidos diminui com o aumento da cadeia (pois esta empurra elétrons para a carboxila, aumentando a densidade eletrônica e dificultando a liberação de H+). Álcoois Dada as reações feitas pelos álcoois, observamos que eles possuem um caráter ácido fraco. Enfim, suas reações em ordem de reatividade seriam: Álcool 1ário > Álcool 2 ário > Álcool 3 ário `` Exemplos: 1 2 Lembrando que quanto maior for o K, mais forte será o ácido considerado. Ácido carboxílico O caráter ácido é devido à ionização da carboxila. R–C O O R–C O H O– +H+ Ânion carboxilato Ácido A estabilidade do ânion carboxilato é garantida pela ressonância: O R–C O R–C – O – O EM_V_QUI_033 Sendo que o híbrido é melhor representado por: O R C O Porém, como também reagem liberando a oxidrila (OH–) e, com isso, apresentam um caráter básico fraco, concluímos que os álcoois são anfóteros, sendo, neste caso, sua ordem de reatividade a anterior. Álcool primário < secundário < terciário Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 5 `` Exemplos: NH4C sal NaOH NH4OH hidróxido de amonioácido instável NH3 + H2O amoníaco CH3 OH + HBr CH3Br + H2O 3 CH3 OH + PC 3 3 CH3C + P(OH)3 [CH3 – NH3]+C – NaOH [CH3 – NH3]+OH- CH3– NH2 + H2O (isto é, H3PO3) sal hidróxido (instável) amina CH3 OH + HNO3 CH3NO3+ H2O O caráter básico das aminas é devido ao par Em linhas gerais, o caráter dos álcoois é anfóeletrônico livre que existe no nitrogênio, exatamente tero, mas em geral as características ácidas tendem como no amoníaco (NH): a predominar. +1 NH3+ H+ (é o NH4+1) É importante lembrar que a importância maior NH 3 | H da função amina é fazer parte das proteínas vegeamoníaco íon amônio tais e animais. São importantes também as aminas (base de Lewis) cíclicas, existentes em compostos heterocíclicos, tais como os alcaloides. H | + CH – NH + H As amidas também estão relacionadas com o CH3 – NH2 3 2 +1 metabolismo dos seres vivos. Um exemplo importanamina íon metil-amônio te é o da ureia, de fórmula O = C(NH2)2, que é um dos produtos finais do metabolismo dos mamíferos, Logo o amoníaco é uma base fraca. sendo eliminada pela urina. Tanto as aminas quanto as amidas têm largo emNH4+1 + OH–1 , em que: NH3+ H2O prego industrial – na produção de medicamentos, co+ – rantes, plásticos etc. Como exemplos, podemos citar: K = [NH4 ] [OH ] = 1,8 . 10–5 COOH NH COCH3 [NH3] [H2O] NH2 OH ácido p–aminobenzoico (PABA) (protetor solar) acetaminofeno (analgésico e antitérmico) CH3 NH2 CO CH2 N C2H5 C2H5 Sendo assim, as aminas alifáticas primárias são bases mais fortes do que o amoníaco (o grupo alquila “empurra elétrons” para o grupo amino, aumentando a densidade eletrônica no nitrogênio, facilitando a captura de H+) e assim por diante as outras aminas. Por outro lado, as aminas aromáticas são bases fraquíssimas, pois o par eletrônico do N, foge para o anel, dificultando a saída do H+. NH NH CH3 – xilocaína (anestésico local) + + NH Aminas – NH3 + HC base ácido CH3 – NH2 + HC 6 ácido NH+4 C – sal [CH3 – NH3]+ C – sal Os sais são decompostos por bases fortes, pois os hidróxidos das aminas são instáveis, como por exemplo o NH4OH: – (Kb = 4,2 . 10–5) Generalizando, podemos dizer que qualquer grupo que “empurre” elétrons para o nitrogênio aumenta a basicidade da amina; caso contrário, a basicidade diminui. Em ordem decrescente de basicidade, temos, então: R2NH > R – NH2 > R3N > NH3 > Ar – NH2 > Ar2NH > Ar3N Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 As aminas são chamadas bases orgânicas pois, apresentam caráter básico fraco, idêntico ao do amônia (NH). Observe os exemplos: base NH Amidas caráter ácido-base atraem igualmente o par de elétrons, pois são dotados da mesma eletronegatividade. Por essa razão, não há formação de cargas parciais: H: H Como nas amidas existe a ressonância: 1 R—C 2 O R—C NH2 O – A soma de dois vetores de mesma intensidade e sentidos opostos resulta em μ = 0. Portanto, a molécula H2 é apolar. + NH2 Ocasionando a fuga do par eletrônico do nitrogênio, as amidas perdem sua basicidade, podendo ser consideradas como substâncias neutras. 2. Determine se as moléculas deste exercício são polares ou apolares: a) metano. b) tetracloreto de carbono. Éteres - caráter básico c) clorometano. d) diclorometano. Os éteres são bases de Lewis, de caráter básico fraco, por exemplo: C2H5 – O – C2H5 + H2SO4 base + a frio ácido – [C2H5 – O – C2H5] HSO4 H Sulfato ácido de dietil-oxônio (nome usual: sal de oxônio) Por isso, os éteres são solúveis em H2SO4 concentrado e frio (a quente há ruptura do éter). Isso diferencia os éteres dos hidrocarbonetos e dos haletos. e) triclorometano. `` Solução: Todas essas moléculas possuem geometria tetraédrica e, dependendo dos átomos ligados ao carbono, elas podem ser apolar ou polar. Uma molécula será apolar se os quatro átomos ligados ao carbono forem iguais. Isso ocorre com os dois primeiros casos: C H H 1. Determine a polaridade das moléculas HF e H2. `` Solução: As duas moléculas possuem apenas dois átomos cada; portanto, são caracterizadas por uma geometria obrigatoriamente linear. Na molécula HF, o flúor é o átomo mais eletronegativo, razão pela qual o par de elétrons da ligação fica mais próximo dele. Ou seja, o flúor adquire carga parcial negativa ( –), e o hidrogênio, carga parcial positiva ( +). H :F o par de elétrons fica mais próximo do átomo. EM_V_QUI_033 Utilizando vetores, temos: δ+ δ− H F C C H C C C H metano tetracloreto de carbono Observe que, em ambas, a soma dos quatro vetores resulta em μ = 0. Uma molécula será apolar se os quatro átomos ligados ao carbono não forem todos iguais. Isso acontece com os outros três casos: C H H C Cl H C H C H H clorometano diclorometano C C C C triclorometano Em razão de uma maior polarização, observe que o comprimento do vetor na ligação C – C é maior que o da ligação H – C. Assim, somando-se os vetores para cada molécula, obtemos μ ≠ 0. Todas as moléculas são, portanto, polares. 3. Determine a polaridade das seguintes moléculas: Nesse caso, há um só vetor, que corresponde à própria soma vetorial, ou seja, μ ≠ 0. A molécula HF é, portanto, polar. a) cis-1, 2-dicloroeteno. Na molécula H, por sua vez, há dois átomos iguais, que c) eteno. b) trans-1, 2-dicloroeteno. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 7 `` Quando a pressão de vapor for igual a 760mmHg, no nível do mar, ocorre a ebulição das substâncias. Qual delas é mais volátil e qual possui a maior interação intermolecular? Solução: As três moléculas têm em comum uma ligação dupla entre os átomos de carbono. Essa ligação se comporta como se fosse um único par de elétrons. Tudo acontece como se, ao redor de cada carbono, houvesse três pares de elétrons, formando um ângulo de 120° entre si. Portanto, a geometria dessas moléculas é trigonal plana: `` A substância mais volátil é a que possui menor ponto de ebulição: substância B. a) A substância que possui maior interação intermolecular e apresenta maior ponto de ebulição: substância C. C C Solução: C=C H H C H ⇒ cis – 1, 2 – dicloroeteno b) C=C H C H H ⇒ trans – 1, 2 – dicloroeteno c) 6. (Fuvest) Uma das propriedades que determina maior ou menor concentração de uma vitamina na urina é a sua solubilidade em água. H3C CH3 CH3 CH3 C=C OH ⇒ eteno H CH3 Efetuando a soma dos vetores, concluímos que a molécula (a) é polar, enquanto (b) e (c) são apolares. Vitamina A (ponto de fusão = 62°C) 4. Determine a polaridade das seguintes moléculas: O a) etino. HO Solução: As duas moléculas possuem em comum uma ligação tripla entre os átomos de carbono. Essa ligação se comporta como se fosse um só par de elétrons. Tudo se passa como se, ao redor de cada carbono, houvesse dois pares de elétrons. A geometria resultante é, portanto, linear: H C ≡C H ⇒ etino Cl C ≡C H ⇒ cloroetino 5. O gráfico deste exercício relaciona a pressão de vapor com a temperatura. P(mmHg) B 800 A C 600 400 200 8 40 60 80 100 120 t (ºC) OH Vitamina C (ponto de fusão = 193°C) a) Qual dessas vitaminas é mais facilmente eliminada na urina? Justifique. b) Dê uma justificativa para o ponto de fusão da vitamina C ser superior ao da vitamina A. `` Feita a soma dos vetores, concluímos que a molécula do etino é apolar, e a do cloroetino é polar. 0 20 OH O b) cloroetino. `` OH Solução: a)A vitamina C é mais facilmente eliminada pela urina porque apresenta um número maior de grupos –OH na sua molécula, o que favorece a formação de várias pontes de hidrogênio com a água, facilitando a sua solubilidade neste solvente. A vitamina C é hidrossolúvel. Observação: O fato de a vitamina C ser facilmente eliminada na urina foi o maior argumento utilizado contra a teoria de Linus Puling que defendia o consumo de grande quantidade dessa substância diariamente (até 18g/dia) para combater os radicais livres que causam o envelhecimento precoce e a degeneração das células. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 H A vitamina A é predominantemente apolar e, portanto, é lipossolúvel (solúvel em gordura). Isso faz com que a eliminação da vitamina A do organismo seja mais difícil. Assim, se por um lado a falta de vitamina A pode diminuir a resistência do organismo e gerar uma série de distúrbios oculares e cutâneos, o excesso é igualmente prejudicial, devido ao seu poder cumulativo. b)Pontes de hidrogênio são interações intermoleculares fortes. A presença de maior número de grupos –OH na vitamina C favorece o aparecimento de uma quantidade maior de pontes de hidrogênio entre as moléculas dessa substância, o que justifica o seu maior ponto de fusão 7. `` Solução: a) O butanal é polar, formando dipolos permanentes, que são mais intensos que os dipolos induzidos do pentano. b) O HΧ3C – CH2 – C – OH HO – CH2CH2CH2CH3 O H3ΧC – CH2 – C – O – (CH2)3 – CH3 + H2O propanoato de butila Coloque os compostos em ordem crescente de acidez: etanol, hidróxi-benzeno, propanoico `` Solução: etanol < fenol < propanoico 8. (Fuvest) A tabela a seguir mostra os pontos de ebulição de algumas substâncias: Substância etano cloroetano etanol PE (°C) – 88,2 38,0 78,3 Explique por que o ponto de ebulição aumenta quando se substitui um átomo de hidrogênio do etano por um átomo de cloro ou por um grupo OH. `` Solução: Polariza-se a molécula; quanto maior a polarização, maior o ponto de ebulição. 9. (UFRJ) A tabela a seguir apresenta algumas propriedades físicas de quatro substâncias orgânicas. Nome pentano Fórmula Massa Ponto de molecular molecular fusão C5H12 72 – 130 Ponto de ebulição (°C) 36 butanal C4H8O 72 – 99 76 1-butanol C4H10O 74 – 90 118 ácido propanoico C3H6O2 74 – 22 141 EM_V_QUI_033 a) Explique por que o butanal apresenta um ponto de ebulição mais elevado do que o pentano. b) Escreva a equação da reação do ácido propanoico com o 1-butanol e dê o nome do composto orgânico obtido. A revista Superinteressante, de abril de 1995, n.º 4, ano 9, publicou uma matéria de Thereza Venturoli sobre o metanol, da qual destacamos os seguintes trechos: “[...] O metanol entrou no país em 1990 e, até hoje algumas regiões de São Paulo e Minas Gerais vendem álcool enriquecido com 7% de gasolina e, no máximo, 35% de metanol. [...] Agora, veio a dramática surpresa. Uma pesquisa – apresentada em dezembro de 1994 num congresso científico em Gramado, no Rio Grande do Sul, e ainda não publicada –, realizada por biomédicos do departamento de Medicina Legal da Faculdade de Medicina da Universidade de São Paulo (USP), apontou alterações nas células dos frentistas que lidam com metanol. Foram examinadas células da mucosa da boca de 37 frentistas, de 28 postos, em duas rodadas de exames: em 1989, antes da chegada do metanol, e, depois, entre 1991 e 1992. Na primeira etapa, a média dos examinados era normal. Apenas 7 em cada 10 000 células tinham micronúcleos (aberrações nos cromossomos, que podem evoluir para câncer). Depois, o número subiu para 17 em cada 10 000 células. Segundo Gilka Gattás, chefe da pesquisa, infecções, uso de bebida alcoólica e cigarro também aumentam temporariamente a quantidade de micronúcleos. Mas os hábitos de fumo e bebida dos frentistas não se alteraram e, portanto, não estão associados à mudança registrada. [...] Paulo Hilário Nascimento Saldiva, um dos responsáveis pela preparação do Relatório de Impacto Ambiental, em 1990, pondera: ‘Talvez o metanol tenha facilitado a evaporação da gasolina, que entra na mistura’, especula ele. ‘A gasolina, sim, sabemos que tem efeitos mutagênicos’. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 9 c) cadeia homogênea. Outro que se surpreendeu foi o coordenador do Centro de Assistência Toxicológica do Hospital das Clínicas, em São Paulo, Anthony Wong. Ele fez a avaliação clínica dos frentistas um ano depois de o metanol chegar aos postos. ‘Nossa preocupação era a possibilidade de cegueira e de alterações no fígado’. A própria pesquisadora Gilka Gattás sugere cautela. ‘Os dados ainda não são suficientes para culpar diretamente o metanol. Mas são um alerta: os frentistas estão vivendo um problema de saúde ocupacional. E alguma coisa tem de ser feita’.” 10. Em relação ao texto, responda aos itens abaixo. d) cadeia alifática. e) cadeia acíclica. II. O carbono da estrutura da cafeína, assinalando como o (*), apresenta ângulos de ligação, aproximadamente, iguais a: a) 45° b) 75° c) 90° d) 109° a) Forneça o nome usual e o nome segundo Kolbe para o metanol. `` I. Devido a presença da insaturação – insaturado ⇒ Letra b. c) Comente sobre a reatividade e o caráter ácido do metanol. `` Solução: a)Álcool metílico ou carbinol. b)As moléculas do metanol são predominantemente polares e estabelecem pontes de hidrogênio com as moléculas de água. c)O metanol é muito reativo, principalmente porque sua molécula é bastante polar. O caráter ácido do metanol é muito fraco, pois, além de ser uma molécula saturada, existe a forte atração que o oxigênio do grupo –OH exerce sobre o hidrogênio. II. Devido a estrutura presa ao anel, as ligações ocupam 109. 12. (UCB) O tryptanol (Cloridrato de Amitriptilina, MSD) é um composto branco e cristalino, prontamente solúvel em água, usado no tratamento da depressão, por ser um potente antidepressivo com propriedades sedativas. De acordo com informações fornecidas na bula do medicamento, sua fórmula estrutural é: . HC CHCH2CH2N(CH3)2 A partir da fórmula estrutural do cloridrato de amitriptilina, julgue os itens seguintes, assinalando (V) para os verdadeiros e (F) para os falsos (dadas as massas atômicas: C = 12, H = 1, N = 14, C = 35,5). (( ) O número de carbonos secundários no composto é igual a 17. 11. (Uniderp) Use o enunciado abaixo para responder às duas questões seguintes. Apesar de usado como estimulante do sistema nervoso, em casos de dor de cabeça de origem nervosa, de esgotamento físico e intelectual, nas doenças gastrointestinais e ainda como diurético, a pasta de guaraná é mais utilizada na preparação de bebida refrigerante. O H3C (( ) A massa molecular de um mol do composto terá valor igual a 314. (*) N N O (( ) A fórmula empírica é C20H23N • HC . CH3 N (( ) O grupo funcional do cloridrato de amitriptilina é o grupo amida. N (( ) O medicamento é prontamente solúvel em água, pois trata-se de um composto cuja molécula é apolar. CH3 O princípio químico ativo do guaraná é a cafeína, um alcaloide representado pela fórmula estrutural acima. I. A estrutura da cafeína apresenta: a) anel benzênico. b) cadeia insaturada. 10 Solução: d `` Solução: F–V–F–F–F 13. (UFPA) As substâncias X, Y e Z pertencem a diferentes funções orgânicas e estão representadas por suas estruturas a seguir: Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 b) O que justifica a solubilidade do metanol em água, em qualquer proporção? e) 120° a) X b) Y `` CH3 HO Solução: São corretas as afirmações D e F. O CH3 CH2 CH CH C OH CH3 c) Z CH3 NH Escreva a nomenclatura IUPAC para X e para Y, coloque as três substâncias em ordem crescente de acidez e cite quantos isômeros planos são possíveis para Z, mantendo, em suas estruturas, o anel benzênico. `` 15. A adrenalina, cuja fórmula estrutural encontra-se esquematizada a seguir, é um hormônio elaborado pela parte medular das glândulas suprarrenais e liberada pela excitação das fibras nervosas. OH HO Solução: X 1-hidróxi-4-metil-benzeno Y ácido 2-fenil-3-metil-pentanoico HO Há quatro isômeros. 14. (UFPR) O índigo ou anil é, provavelmente, o corante orgânico mais antigo conhecido pelo homem. Usado desde a Pré-História, é extraído de plantas do gênero Indigofera (Leguminosae) que ocorrem, entre outras regiões, na Índia, Indonésia e Guatemala. Sua aplicação mais conhecida é, sem dúvida, como corante na fabricação de tecidos jeans. Em 1878, foi sintetizado em laboratório e, desde 1890, sua produção passou a ser feita em escala industrial. Uma das etapas desta síntese envolve o equilíbrio, não-completo, mostrado a seguir: N H CH3 b) a função química que possui caráter ácido mais acentuado. c) a fórmula molecular de um isômero da adrenalina. d) o número de átomos de carbono assimétricos existentes na molécula. N HO Com base nas informações acima, é correto afirmar: a) na reação acima, é mostrada a oxidação da função amida para a função cetona. b) na reação de redução, dois átomos de carbono do índigo passam de um estado de hibridação sp2 para sp3. c) as duas moléculas acima representadas são isômeros de fórmula C16H10N2O2. d) ambas as moléculas apresentam 16 átomos de carbono com hibridação sp2. EM_V_QUI_033 H O H Oxidação H N N H Redução H N O CH2 A adrenalina levógira atua como um potente vaso constritor e hipertensor. Apresenta um efeito pronunciado sobre o metabolismo corporal, provocando um aumento da frequência cardíaca e da tensão arterial. Em condições normais, a quantidade de adrenalina liberada pelo organismo é constante, mas em situações de estresse emocional, raiva ou medo, ocorre uma descarga extra da substância, elevando temporariamente a atividade metabólica. A adrenalina dextrogira é muitas vezes menos ativa como hormônio. Em relação a essa substância, indique: a) os grupos funcionais presentes na adrenalina. Ordem crescente de acidez: Z < X < Y OH C e) a função orgânica amida pode ser identificada na estrutura do índigo. f) ambos os compostos acima representados formam pontes de hidrogênio com moléculas de água. e) o número de misturas racêmicas obtidas a partir dessa substância. `` Solução: a)Fenol, álcool e amina. b)O fenol apresenta maior caráter ácido. c)É a própria fórmula molecular da adrenalina: C9H12O3N. d)Um carbono assimétrico. e)Uma mistura racêmica. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 11 7. 1. Das moléculas CH4, CH3Cl, CH2Cl2, CHCl3, CCl4 e CCl3F, quais são polares e quais são apolares? Justifique a resposta. 2. (Elite) Em termos de Eletronegatividade, como é possível prever a polaridade de uma ligação química? 3. (Elite) Uma molécula com ligações polares é necessariamente polar? Justifique. 4. (Elite) O que são as forças intermoleculares? Quais são elas? 5. (Cesgranrio) Analise os compostos seguintes quanto à ocorrência de ligações e/ou forças intra e intermoleculares. Em seguida, assinale a opção correta: NaCl (Cesgranrio) Determina-se experimentalmente que, num álcool R-OH, a solubilidade com o tamanho de R, esse fato se deve: a) somente às propriedades hidrófilas do radical hidroxila. b) às propriedades hidrófilas de R, qualquer que seja seu tamanho. c) às propriedades hidrófobas de R, qualquer que seja seu tamanho. d) ao fato de o aumento de R corresponder ao aumento da parte apolar hidrofóbica. e) ao fato de a diminuição de R corresponder a uma diminuição na polaridade da molécula. 8. (PUC) Nas condições ambientes, a substância líquida, volátil, combustível, que dissolve bem a parafina, imiscível com a água deve ser: a) etano. b) heptano. c) etanol. a) Em I, observam-se ligações eletrovalentes e, em IV, ligações covalentes e pontes de hidrogênio. e) metanol. b) Em I, observam-se ligações eletrovalentes, e em III, ligação covalente. 9. (UFES) Com relação aos compostos orgânicos e inorgânicos, é incorreto afirmar que: c) Em II, observam-se pontes de hidrogênio e, em IV, forças de Van der Waals. a) Os compostos orgânicos geralmente apresentam ponto de ebulição maior que os compostos inorgânicos. d) Em II e IV, observam-se ligações covalentes e pontes de hidrogênio. e) Em III, observa-se ligação iônica, e em IV, pontes de hidrogênio. 6. (PUC) Considere as seguintes substâncias: b) os compostos orgânicos geralmente apresentam ponto de fusão menor que os compostos inorgânicos. c) os compostos inorgânicos são geralmente mais solúveis em água que os compostos orgânicos. d) os organismos vivos são constituídos por grande quantidade de compostos orgânicos. I. C12H22O11 II. C12H26 e) nem todo composto que apresenta carbono em sua estrutura é composto orgânico. IV. C6H5COO-Na+ V. C10H8 10. (Elite) As substâncias orgânicas são, em geral, pouco densas. Explique. Considerando a natureza das ligações químicas, podese prever que apresenta maior temperatura de fusão a substância: a) I 11. (Elite) Quais são as características dos ácidos orgânicos? b) II 13. (Elite) Coloque os compostos em ordem crescente de acidez. c) III 12. (Elite) Quais são os compostos ácidos na química orgânica? Coloque-os em ordem decrescente de acidez. d) IV I. e) V II. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 III. C6H5COOH 12 d) C60H122 b) III. 18. Qual o nome IUPAC correspondente à fórmula estrutural abaixo? IV. 14. (Unirio) Por distração, no preparo de um prato foi colocado vinagre e pimenta em demasia, o que o tornou excessivamente ácido. O que pode ser colocado para se diminuir a acidez na comida? a) NaCl 19. (Elite) Sabendo que nossa transpiração contém ácidos carboxílicos, explique por que o leite de magnésio pode agir como desodorante. 20. b) HCl (1)CH3COOH ( ) formol (2)CH3COCH3 ( ) cachaça (3)HCOH ( ) removedor de esmalte (4)CH3CH2CH2CH3 ( ) vinagre a) (5)CH3CH2OH ( ) gás de cozinha b) b) 4, 2, 3, 1, 5 c) NaHCO3 d) H2SO4 e) Na2SO4 15. Dê a nomenclatura aos compostos abaixo: Lendo-se os números da segunda coluna, de cima para baixo, obtém-se: a) 1, 5, 2, 4, 3 c) 3, 4, 1, 5, 2 d) 3, 5, 2, 1, 4 e) 5, 2, 1, 3, 4 c) 21. (Elite) Coloque em ordem crescente de basicidade: I. etilamina. d) II. dietilamina. III. trietilamina. IV. difenilamina. 22. Além da anilina, as toluidinas também são importantes para a fabricação de corantes. Há três toluidinas diferentes, a saber: e) I. orto-toluidina, cujo nome, segundo as regras da IUPAC, é ortometilanilina. 16. “O ácido tricloro-acético, ao contrário do ácido acético, é muito forte”. EM_V_QUI_033 Escreva as fórmulas estruturais e os nomes oficiais das substâncias mencionadas nessa afirmação. 17. Dê nome aos produtos principais das reações abaixo: II. meta-toluidina, cujo nome, segundo as regras da IUPAC, é metametilanilina. III. para-toluidina, cujo nome, segundo as regras da IUPAC, é parametilanilina. Escreva a fórmula estrutural das toluidinas. 23. Escreva a fórmula de: a) etilamina. a) b) isopropilamina. c) anilina. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 13 24. (Elite) Quais são os tipos de forças intermoleculares em moléculas que apresentam ligações N – H? 25. (Elite) As aminas são solúveis em H2O? Justifique. 26. (Elite) Formamida e acetomida são nomes usuais que dão indícios claros da função orgânica e do número de carbonos na cadeia. Escreva as fórmulas estruturais desses compostos e seus nomes oficiais. 27. (Elite) Justifique a seguinte afirmação: “Aminas têm caráter básico e amidas têm caráter neutro”. 28. (UFRE) Analise a estrutura do analgésico e antipirético fenacetina e marque a alternativa que indica a função representada na referida estrutura: a) Mostre, por meio de desenhos semelhantes ao apresentado, como fica a mistura de I e II, identificando cada substância, e como fica a mistura de II e III. b) A graxa lubrificante utilizada em automóveis é uma mistura de hidrocarbonetos pesados derivados de petróleo com aditivos diversos. Indique qual, dentre os três solventes apresentados, é o mais adequado para remover uma mancha de graxa em uma camisa. Justifique sua resposta. 2. (UFRJ) O ponto de ebulição de uma substância depende de sua massa molar e, principalmente, das forças de interação entre suas moléculas. Considere os compostos de fórmulas: a) aldeído. b) fenol. c) amina. d) éter. I. H3C – (CH2)3 – OH e) aminoácido. II. H5C2 – O – C2H5 29. (Elite) Escreva o nome IUPAC da benzocaína, um anestésico local: c) Qual substância tem ponto de ebulição mais elevado? d) Que tipo de isomeria as duas substâncias apresentam? 3. (PUC) A substância orgânica que apresenta maior solubilidade em H2O é: a) propano. 30. (Elite) Qual é a fórmula estrutural da ureia? A que função orgânica esta pertence? b) propeno. c) ácido palmítico. d) hexano. e) butanol-1. Sabe-se que, de uma forma geral, substâncias polares dissolvem substâncias polares e substâncias apolares dissolvem substâncias apolares. Em um laboratório, massas iguais de tetracloreto de carbono, água e etanol foram colocadas em três recipientes idênticos, conforme se vê na figura a seguir: 14 4. (UERJ – adap.) Para as moléculas do etanol, quais os tipos de ligação química e intermolecular existem? 5. (Elite) Entre duas moléculas que possuem o mesmo tipo de força intermolecular, como saber qual terá maior ponto de ebulição? 6. (UFRJ) De um modo geral, o ponto de ebulição cresce com o aumento do peso molecular, o que não acontece com os compostos do quadro abaixo: Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 1. (UFRJ) A solubilidade dos compostos é um conhecimento muito importante em química. Peso molecular Ponto de ebulição (°C) I 62 198 II 76 125 III 90 83 Composto a) Explique a diminuição do ponto de ebulição com o aumento do peso molecular nos compostos mencionados. b) Calcule o número de átomos de oxigênio que existe em 62g do etanodiol. 7. (UERJ - adap.) Em termos de solubilidade em água de dois compostos, o que se pode dizer sobre o tamanho da cadeia carbônica? Indique, entre as afirmações abaixo, a única falsa: a) os compostos I e II são isômeros de posição. b) os compostos II e III são isômeros funcionais. c) o composto V não tem isômeros. d) o composto VI admite isômeros de posição mas tem isômero funcional. e) a fórmula IV pode corresponder a substâncias isômeras por função e também a substâncias isômeras por posição. 11. Qual é a diferença fundamental entre óleos e gorduras? 12. Você seria capaz de dizer por que alguns detergentes são ditos biodegradáveis e outros não-biodegradáveis? 13. (UFRJ) Aminoácidos são monômeros que constituem as proteínas. A estrutura geral dos a-aminoácidos é caracterizada pela presença de um grupo carboxila, de um grupo amino na posição a e de uma cadeia R 8. (Unirio) A substância menos volátil, ou seja, a de maior ponto de ebulição é: a) Estrutura geral dos a-aminoácidos. As propriedades dos diferentes aminoácidos estão associadas à cadeia R, que pode ser classificada como polar ou apolar, ácida ou básica. Algumas cadeias presentes nos aminoácidos são apresentadas a seguir: b) c) d) e) 9. (Elite) Qual das substâncias é mais solúvel em H2O? a) C2H2 b) CH2OH(CHOH)4CHO c) C2H5Br d) e) CCl4 10. (Cesgranrio) Considere as substâncias: I. II. III. CH3(CH2)3 COH EM_V_QUI_033 IV. C6H6O V. CH3OH Entre os aminoácidos apresentados acima, selecione um cuja cadeia R pode ser classificada como ácido de Arrhenius, outro como base de Brönsted-Lowry e outros dois cujas cadeias R podem ser classificadas como apolares. 14. (UFRJ) O sentido do olfato se baseia num mecanismo complexo, no qual as moléculas das substâncias odoríferas são adsorvidas em sítios específicos existentes na superfície dos cílios olfativos. Esses cílios registram a presença das moléculas e enviam a informação para o cérebro. Em muitos casos, pequenas modificações na estrutura de uma substância podem causar grande alteração no odor percebido. Os compostos abaixo, por exemplo, apresentam estruturas químicas semelhantes, mas claras diferenças quanto ao odor. VI. CH3CH2OH Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 15 17. (Elite) Colocar em ordem crescente de acidez: a) H2CClCOOH b) C(Cl)3COOH c) CH3COOH d) CH(Cl)2COOH 18. (Elite) Coloque os álcoois abaixo em ordem crescente de acidez: a) Dê o nome do composto que tem odor de amêndoa. b) O olfato humano é especialmente sensível ao odor de baunilha. Podemos perceber sua presença em concentrações tão pequenas quanto 2 . 10-13 mols de vanilina / litro de ar. Um artista planeja perfumar um estádio com odor de baunilha, durante um show. O estádio apresenta um volume total de 100 000 000 de litros de ar. Calcule a quantidade mínima de vanilina, em gramas, necessária para perfumar o estádio. 15. O conservante benzoato de sódio a) 2-butanol. b) 1-butanol. c) terc-butanol. 19. (Elite) Coloque em ordem crescente de acidez: a) 1-butanol. b) metanol. c) fenol. d) orto-clorofenol. e) C(Cl)3COOH 20. (Elite) Por que a presença de elementos bastante eletronegativos aumenta a acidez? 21. (Elite) Coloque as espécies abaixo em ordem crescente de temperatura de ebulição: I. CH3(CH2)3CH3 é utilizado em certos sucos de frutas engarrafados. A seu respeito, pedem-se: I. a equação da reação que permite a sua obtenção. II. a reação que ocorre entre o ácido presente no estômago e esse conservante. 16. A medida do teor alcoólico no sangue humano pode ser efetuada pela utilização de instrumentos conhecidos como bafômetros. O funcionamento de um bafômetro portátil baseia-se na reação do etanol com dicromato de potássio, em meio ácido, conforme a equação abaixo: II. CH3CH2CH3 III. CH3CH2CH2CH2OH IV. CH3CH2CH2CH2CH2OH 22. (UFF) O benzeno é geralmente usado como solvente de compostos orgânicos, enquanto a água é usada geralmente como solvente de compostos inorgânicos por apresentarem respectivamente: a) molécula apolar e molécula polar. b) molécula polar e molécula apolar. c) molécula polar e ligação polar. Cr2(SO4)3(aq) + 7H2O(l) + 3CH3CHO(g) + K2SO4(aq) (verde) a) Segundo a equação acima, o agente oxidante é o ______. b) Segundo a equação acima, o agente redutor é o ________. c) O nome Iupac do produto orgânico formado é __________. 16 d) molécula apolar e ligação apolar. e) ligação polar e ligação polar. 23. (Elite) A produção de alguns vinhos exige que as garrafas sejam armazenadas durante alguns anos. Por que elas devem ser mantidas deitadas e não de pé? 24. (Elite) Por que não pode existir o ácido metanodioico? 25. Dê os nomes das seguintes aminas: a) b) c) Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 K2Cr2O7(aq) + 4H2SO4(aq) + 3CH3CH2OH(g) (alaranjado) d) a) H2O b) HCl c) KOH e) d) NaCl 26. (Elite) Coloque as aminas em ordem de basicidade: I. II. 30. (UERJ) Assinale, entre as espécies químicas indicadas abaixo, aquela que, por possuir um par eletrônico livre, é capaz de aceitar prótons: a) CH4 III. b) BH3 27. Na treonina, composto de fórmula estrutural, c) NH3 d) SiH4 31. Em relação à estrutura da adrenalina abaixo apresentada, assinale a afirmação correta: identificamos a presença de: a) função amida. b) dois carbonos assimétricos. c) dióxido de carbono e amônia. d) função éster. e) quatro carbono assimétricos. 28. (UFF) A molécula de tirosina é utilizada pelo corpo humano para a formação de várias outras moléculas e, entre elas, algumas responsáveis pela transmissão de sinais de uma célula nervosa à outra. A fórmula da tirosina é: a) temos 1 grupo amino terciário. b) temos 1 grupo álcool primário. c) temos 1 trifenol. d) notamos apenas um carbono(s) assimétrico(s). e) notamos dois carbono(s) assimétrico(s). 32. (UFF) As amidas são classificadas em primárias, secundárias ou terciárias de acordo com: a) o número de radicais alquila ligados ao nitrogênio. b) o número de radicais arila ligados ao nitrogênio. c) o número de átomos de hidrogênio ligados ao nitrogênio. Os grupos funcionais presentes nessa molécula são: a) fenol, anilina e aldeído. b) álcool, amida e cetona. EM_V_QUI_033 c) fenol, amina e ácido. d) o número de grupos carbonila ligados ao nitrogênio. e) o tipo de amina a partir da qual foi formada. 33. (UFV) Qual a ordem crescente das temperaturas de ebulição das substâncias dadas a seguir? d) álcool, amina e ácido. I. (CH3)4 C e) fenol, amina e aldeído. II. C2H5CONH2 29. (UERJ) Uma das substâncias responsáveis pelo odor desagradável em banheiros é o gás amoníaco (NH) resultante da degradação da ureia. Dentre as substâncias abaixo, aquela que poderia ser utilizada na neutralização do NH3 é: III. CH3 – CH2 – CO – CH3 a) I < II < III b) I < III < II c) II < I < III Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 17 d) II < III < I e) III < I < II 34. (Elite) Explique o fato de a amina secundária ser mais básica que a primária e a terciária, nesta ordem. 35. É comum as adolescentes terem vontade de colorir os cabelos. Embora nem sempre tenham o apoio dos pais, elas fazem uma “tinta caseira”. A matéria-prima é o papel crepon, encontrado facilmente em papelarias. Este papel é então posto em água, a fim de retirar dele o seu corante, e proceder então com a coloração dos cabelos usando a solução aquosa resultante. 18 EM_V_QUI_033 Escreva a fórmula deste corante e cite seu modo de obtenção em escala industrial. 36. Sabe-se que o ponto de ebulição da metilamina (CH3NH2), peso molecular = 31 é –6°C. No álcool metílico (CH3OH), peso molecular = 32 é de 65 °C. Explique por que isto acontece. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 7. 1. Polares: CH3Cl; CH2Cl2; CHCl3; CCl3. São apolares: CH4 ; CCl4. 2. A polaridade de uma ligação química será tanto maior quanto maior for a diferença de eletronegatividade entre seus átomos. 3. Não, pois isso dependerá da resultante dos vetores de polarização representados por suas ligações. EM_V_QUI_033 4. As forças intermoleculares surgem em consequência da maior ou menor polaridade das moléculas. → forças dipolo-dipolo: ocorrem quando há uma atração forte entre o pólo positivo de uma molécula e o pólo negativo da molécula vizinha. → Forças de Van der Waals: são forças fracas que atraem entre si as moléculas apolares. → Pontes de hidrogênio: são atrações fortes que aparecem entre o átomo de hidrogênio e átomos fortemente eletronegativos, como F, O e N. 5. C 6. D. Os sólidos iônicos apresentam maior temperatura de fusão. D. Quanto maior a cadeia, menor a solubilidade, pois a parte –OH é bem solúvel, mas R – não. 8. B. A parafina é um hidrocarboneto, então deve ser solúvel em heptano. 9. A. Compostos orgânicos são mais voláteis. 10. As moléculas orgânicas são pouco densas, pois são formadas principalmente por carbono e hidrogênio, (C = 12 ; H = 1) que possuem massas atômicas baixas. Cabe ressaltar as atrações entre as moléculas orgânicas serem, em geral, fracas. 11. São considerados ácidos orgânicos todos aqueles compostos capazes de doar próton (H+). Quanto mais facilmente o próton for liberado, mais ácida será a substância. 12. Ácido carboxílico > fenol > álcool. 13. Lembre-se que: R – OH < fenol < R – COOH. Logo: III < II < IV < I. 14. C. Pois é o único composto básico capaz de neutralizar o ácido. 15. a) ácido benzoico. b) fenilamina (anilina). Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 19 b) c) 3-metilbutanol-1. d) m-hidroxitolueno. e) 4,5-dimetilhexanoico. c) 16. ácido 1,1,1-tricloroetanoico 24. São as pontes de hidrogênio, mas é válido ressaltar que estas ligações são mais fracas que as pontes de hidrogênio O–H. ácido etanoico 17. 25. Sim, pois formam pontes de hidrogênio com a água. 26. a) 27. As aminas são básicas porque o par eletrônico livre do nitrogênio pode reagir com H+ dos ácidos. Nas amidas, ocorre a ressonância, fazendo com que as amidas percam sua basicidade, sendo consideradas neutras. b) 28. D. O grupo R – O – C2H5 é característico da função éter. 29. p – amino benzoato de etila. 18. ácido 2-butenodioico 30. 19. Porque sendo o leite de magnésia uma substância básica, irá neutralizar os odores dos ácidos carboxílicos. amida 20. D 1 – ácido acético (vinagre). 2 – propanona (acetona). 3 – formol (aldeído). 4 – hidrocarboneto (butano). 5 – etanol (álcool). 21. IV < III < I < II 1. a) I – CCl4 apolar, II H2O polar, III – etanol polar. amina secundária > amina primária > terciária > aromática (23 ml) mistura de II e III, uma vez que ambos são polares, elas se misturam. 22. b) sabe-se que os hidrocarbonetos são compostos apolares, logo, só haverá solubilidade no CCl4, pois este é o único solvente apolar. a) 20 a) I - que é um álcool, tem maior ponto de ebulição pois faz interações intermoleculares de ponte de H, Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 2. 23. x mols – 108 litros enquanto II, que é um éter, faz interações dipolodipolo muito fracas. x = 2 . 10-5 mol b) Isomeria de função. mol da anilina: C8H8O3 3. E. É a única substância que apresenta ligações de H, como as que ocorrem na água. 4. Ligação química – ligações covalentes. Ligações intermoleculares – pontes de hidrogênio. 5. A molécula que tiver maior massa molecular terá maior ponto de ebulição. 15. mol = 152g m n= mol m 10-5 = 152 m = 304 . 10-5 g 6. a) Embora haja aumento do peso molecular, as forças intermoleculares diminuem, logo, provocam a diminuição no ponto de ebulição. II. ponte de hidrogênio. III. dipolo e p.H. 16. IV. dipolo. a) K2Cr2O7 pois é quem se reduz. I > II > III b) b) H3C CH2 OH pois é quem oxida. c) etanal 17. c < a < d < b 7. 1 mol = 62g 62g – 2 . 6,02 . 1023 átomos de oxigênio então, há 12,04 . 1023 átomos de oxigênio. Quanto maior a cadeia carbônica, menor será sua solubilidade em água, pois as forças de interação intermolecular ficam menores. 8. C. Pois forma pontes de H e tem massa molecular maior que o composto da opção E. 9. B. Pois forma mais pontes de hidrogênio. álcool primário > álcool secundário > álcool terciário 19. a < b < c < d < e ácido > fenol > álcool 20. Porque esses elementos são elétron-atraentes, e quando estão próximos ao hidrogênio ionizável, aumentam ainda mais a acidez. 21. II < I < III < IV 11. Tanto óleos e gorduras são ésteres. Sendo que os óleos são líquidos (possuem ligações duplas) e as gorduras são sólidas (possuem ligações simples) O ponto de ebulição dos compostos orgânicos cresce de acordo com o aumento do peso molecular. 22. A. No benzeno, as ligações C – H – C são apolares (Van der Walls). Na H2O, existem as ligações –OH que são polares (pontes de H). 12. Biodegradável é aquele que pode ser atacado por micro organismos (geralmente são cadeias sem ramificações). Já os não biodegradáveis possuem cadeias com ramificações e não são degradados por agentes biológicos. 23. Se as garrafas forem mantidas de pé, o apodrecimento das rolhas de cortiça permitirá a entrada de ar, e o vinho irá se estragar. Ficando deitada, a cortiça permanecerá úmida e se conservará durante um tempo maior. 13. Ácido de Arrhenius: aspártico 24. Porque o grupo carboxila faz uma dupla ligação e outra simples. Logo, um único carbono, “metanodioico” não pode fazer duas ligações duplas e outras simples, pois estouraria a valência do carbono. 10. E. Não é possível isômeros de posição com C6H6O. base de Brönsted-Lowry: lisina apolares: Valina e fenilalanina 14. EM_V_QUI_033 o halogênio aumenta a acidez. 18. c < a < b 25. a) benzaldeído ou aldeído benzoico a) etilamina. b) 2 . 10 b) dimetilamina. -13 mols – 1 litro Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 21 c) metiletilamina. d) isobutilamina. e) p-metilfenilamina. 26. II > I > III amina secundária > primária > terciária 27. B. Ambos carbonos centrais possuem quatro ligantes diferentes, sendo então classificados como assimétricos. 28. C. Apresenta os grupos Ar OH, logo é fenol, FIG é ácido carboxílico e FIG é amina. 29. B 30. C. NH3 pois é uma base. 31. D. O carbono ligado ao anel aromático é quiral (C*). 32. D. Pois a carbonila que substituía os hidrogênios do N vem de um radical acila. 33. B I. Van der Waals. II. Pontes de hidrogênio e dipolo. III. Dipolo. 34. A amina secundária é mais básica que a amina primária devido a maior estabilidade da molécula. 35. O corante é a anilina Obtenção: 22 EM_V_QUI_033 36. As pontes de hidrogênio formadas pela amina são mais fracas que nos álcoois. Então, o ponto de ebulição das aminas é menor que o dos álcoois de pesos moleculares próximos. Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br EM_V_QUI_033 Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br 23 EM_V_QUI_033 24 Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A, mais informações www.aulasparticularesiesde.com.br
Download