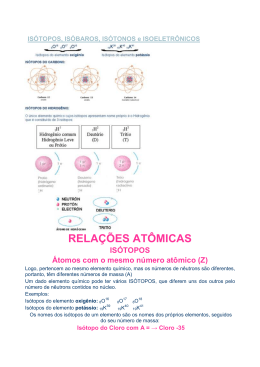
Moderna plus Parte III Unidade I Capítulo 28 M assa atômica, massa molecular e massa de íons química química na abordagem do cotidiano 1 tito canto 1 Respostas Respostas dos exercícios essenciais 1 Alternativa C. Os cientistas escolheram um dos isótopos do elemento químico carbono e atribuíram a ele o valor 12 (exato) para comparar a massa dos átomos. 2 A unidade de massa atômica (u), que é definida 1 (um doze avos) da massa do isótopo do como ___ 12 carbono com número de massa 12 (12C). 3 Li – 6,9 u, O – 16,0 u, N – 14,0 u, C, – 35,5 u, Ca – 40,1 u, Fe – 55,8 u. Ou, arredondando para inteiros, temos: Li – 7 u, O – 16 u, N – 14 u, C, – 36 u, Ca – 40 u, Fe – 56 u 4 Soma: 20 (04 e 16) Y) 5 70,9 Y 69,7 5 ______________________ 68,9(100 2 100 6.970 5 6.890 2 68,9Y 1 70,9Y Y 5 71Ga 5 40% e X 5 69Ga 5 60% 01) Falso: átomos de mesmo Z necessariamente pertencem ao mesmo elemento químico. 02) Falso: átomos isóbaros possuem diferente Z e o mesmo número de massa. 04) Correto: a massa atômica de um elemento químico é a massa média de seus átomos. Por conveniência, essa grandeza é geralmente expressa em unidades de massa atômica (u). 08) Falso: a massa atômica não é exatamente igual à soma das massas de prótons, nêutrons e elétrons. Além disso, quando prótons e nêutrons tomam parte do núcleo de um átomo, a massa total do conjunto é ligeiramente inferior à massa que esses prótons e nêutrons teriam se estivessem separados. Isso se deve a um complexo fenômeno denominado efeito de empacotamento. www.modernaplus.com.br 16) Correto: número de massa (simbolizado por A) corresponde à soma dos números de prótons e de nêutrons de um átomo. O número de massa é, portanto, inteiro, maior que zero e desprovido de unidade. 6 Alternativa C. 7 Alternativa D. Seja P1 a porcentagem de X1 e P2 a porcentagem de X2. P1 1 P2 5 100%, então: P1 5 (100 2 P2) 1 35,4P 35,8(100 2 P2) 2 35,5 5 ______________________ 100 3.550 5 3.580 2 35,8P2 1 35,4P2 P2 5 75% e P1 5 25% 8 Alternativa C. Dados: Massa atômica do elemento Ga 5 69,7 u, 69 Ga 5 68,9 u, 71Ga 5 70,9 u X 5 % 69Ga e Y 5 % 71Ga V X 1 Y 5 100%, então: X 5 100 2 Y 9 O valor 64 u está bem “no meio” entre 63 u e 65 u, ou seja, corresponde exatamente à média aritmética simples entre 63 u e 65 u. Como a porcentagem do isótopo de massa 63 u é maior, a média ponderada resultará num valor mais próximo de 63 u do que de 65 u. Essa média será, portanto, menor de que 64 u. (Professor: de fato, se calcularmos a média ponderada, chegaremos a 63, 62 u.) 79 ? 24 u 1 10 ? 25 u 1 11 ? 26 u 10 ______________________________ 5 24,3 u 100 11 a) 12C corresponde ao isótopo do carbono de número de massa igual a 12. 13C corresponde ao isótopo do carbono de número de massa igual a 13. 98,9 ? 12 1 1,10 ? 13 b)MC 5 ___________________ 5 12,01 u 100 12 Alternativa A. C 5 12 u ? 2 5 24 u; H51u?656u m(C2H6) 5 24 u 1 6 u 5 30 u 15 Alternativa B. Na 5 23 u ? 2 5 46 u; S 5 32 u ? 1 5 32 u; O 5 16 u ? 4 5 64 u; H2O 5 18 u ? 3 5 54 u m(Na2SO4 ? 3 H2O) 5 46 u 1 32 u 1 64 u 1 54 u 5 5 196 u 16 Alternativa E. C 5 12 u ? 6 5 72 u; H 5 1 u ? 8 5 8 u; N 5 14 u ? 2 5 28 u; O 5 16 u ? 2 5 32 u; S 5 32 u ? 1 5 32 u m(C6H8N2O2S) 5 72 u 1 8 u 1 28 u 1 32 u 1 32 u 5 5 172 u 17 N 2 – 28 u, O2 – 32 u, O3 – 48 u, H2O – 18 u, CH4 – 16 u, CO2 – 44 u, SO2 64 u, SO3 – 80 u, C,2 – 71 u, H2SO4 – 98 u, HNO3 – 63 u, C6H12O6 – 180 u, Fe2(SO4)3 − 400 u e Ca5(PO4)3OH − 502 u Moderna plus Parte III Unidade I Capítulo 28 M assa atômica, massa molecular e massa de íons química química na abordagem do cotidiano 18 Alternativa D. I. Correta: D 5 2 u ? 2 5 4 u; O 5 16 u ? 1 5 16 u; m(D2O) 5 4 u 1 16 u 5 20 u II. Correta: d 5 m / V V A densidade da água pesada é diferente da densidade da água comum. Assim, volumes iguais de ambas devem apresentar massas diferentes. III. Falsa: Assim como a água comum, a água pesada apresenta moléculas polares e portanto apresenta interações intermoleculares do tipo dipolo-dipolo. www.modernaplus.com.br 19 Alternativa B. A molécula de HC,O3 de menor massa será formada pelos isótopos de menor massa, que são 1 H, 35C, e 16O. Assim, a molécula terá massa 84 u. A molécula de HC,O3 de maior massa será formada pelos isótopos de maior massa, que são 3H, 37C, e 18 O, e terá massa 94 u. Isso indica que a alternativa B é correta e as alternativas A e C são incorretas. 1 tito canto 2 A molécula de HC,O3 com o menor número de nêutrons será formada pelos isótopos de menor número de massa que são 1H (nenhum nêutron), 35C, (18 nêutrons) e 16O (8 nêutrons), e terá 42 nêutrons ao todo. E a molécula de HC,O3 com maior número de nêutrons será formada pelos isótopos de maior número de massa, que são 3 H (2 nêutrons), 37C, (20 nêutrons) e 18O (10 nêutrons), e terá 52 nêutrons ao todo. Isso evidencia que as alternativas D e E são incorretas. 20 27 u e 27 u. A massa dos três elétrons perdidos para formar o cátion é desprezível perante a massa do núcleo. 21 197 u para todos os três. A massa dos elétrons perdidos para formar os cátions é desprezível perante a massa do núcleo. 22 32 u e 32 u. A massa dos dois elétrons recebidos para formar o ânion é desprezível perante a massa do núcleo. 23 62 u e 96 u.
Download