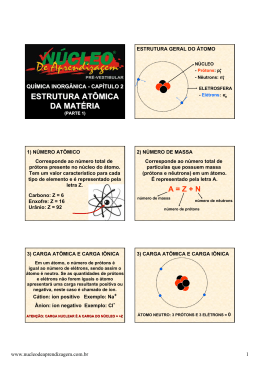
PONTIFÍCIA UNIVERSIDADE CATÓLICA DISCIPLINA: PROFESSOR (A): MAF – 1293 QUÍMICA GERAL Danns Pereira Barbosa Prezado aluno: Abaixo você irá encontrar uma coletânea de exercícios retirados dos mais diversos livros de química geral e aplicada do curso universitário. Não tome a compreensão destes exercícios como única fonte de estudo. A função destes é apenas ajuda-lo no aprendizado do conteúdo ministrado em sala de aula. Estrutura atômica 1. Em que aspecto(s) a teoria atômica de Demócrito era semelhante à teoria atômica de Dalton? 2. Indique se a afirmação é verdadeira ou falsa. a) O próton e o elétron têm a mesma massa, mas cargas opostas. b) A amassa do elétron é consideravelmente menor que a do nêutron. c) A unidade de massa atômica (u) é uma unidade de massa. d) 1u é igual a 1 grama. e) Os prótons e nêutrons do átomo são encontrados no núcleo. f) Os elétrons de um átomo são encontrados no espaço ao redor do núcleo. g) Todos os átomos do mesmo elemento têm o mesmo número de prótons. h) Todos os átomos do mesmo elemento têm o mesmo número de elétrons. i) Elétrons e prótons se repetem. j) O tamanho de um átomo é aproximadamente o tamanho de seu núcleo. k) O número de massa de um átomo é a soma do número de prótons e do número de nêutrons em seu núcleo. l) Para a maioria dos átomos, seu número de massa é o mesmo que seu número atômico. m) Os três isótopos do hidrogênio (hidrogênio-1, hidrogênio-2 e hidrogênio-3) diferem somente no número de nêutrons no núcleo. n) O hidrogênio-1 tem um nêutron em seu núcleo, o hidrogênio-2 tem dois nêutrons em seu núcleo, e o hidrogênio-3, três nêutrons. o) Todos os isótopos de um elemento têm o mesmo número de elétrons. p) A maioria dos elementos encontrados na Terra é uma mistura de isótopos. q) A massa atômica de um elemento dado na tabela periódica é a média ponderada das massas de seus isótopos encontrados na Terra. r) A massa atômica da maioria dos elementos é um número inteiro. s) A maior parte da massa de um átomo é encontrada no núcleo. t) A densidade de um núcleo é seu n´mero de massa expresso em gramas. 3. Qual é o número de massa de um átomo com: a) 22 prótons, 22 elétrons e 26 nêutrons? b) 76 prótons, 76 elétrons e 114 nêutrons? c) 34 prótons, 34 elétrons e 45 nêutrons? d) 94 prótons, 94 elétrons e 150 nêutrons? 4. Qual a diferença entre número atômico e número de massa? 5. Indique se a afirmação é verdadeira ou falsa. a) Mendellev descobriu que, quando os elementos são organizados em ordem crescente de massa atômica, certas propriedades recorrem periodicamente. b) Os elementos do grupo principal são aqueles das colunas 3A e 8A da tabela periódica. c) Os não metais são encontrados na parte de cima da tabela periódica, os metaloides, no meio, e os metais, na parte de baixo. d) Entre os 116 elementos, metais e não metais existem aproximadamente em igual número. e) Na tabela periódica, a fileira horizontal é chamada grupo. f) Os elementos do grupo 1A são chamados “metais alacalinos”. g) Os metais alacalinos reagem com água e produzem gás hidrogênio e um hidróxido de metal, MOH, emq eu “M” é o metal. h) Os halogênios são elementos do grupo 7A. i) Os pontos de ebulição dos gases nobres (elementos do grupo 8A) aumentam de cima para baixo na coluna. 6. Indique se a afirmação é verdadeira ou falsa. a) Dizer que “a energia é quantizada” significa que somente certos valores de energia são permitidos. b) Bohr descobriu que a energia do elétron no átomo é quantizada.
Download