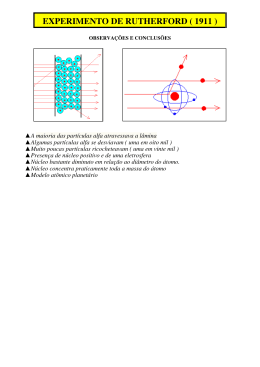
Seminário de Química Estilberg Ribeiro 14442 Paulo José Miranda Neto 14461 Átomos Íons Moléculas Teoria Atômica Demócrito (Aristóteles e Platão) - Indivisível J. Dalton – Bola de bilhar - Quatro postulados; - Explicava várias leis simples de combinações químicas da época; J.J. Thomson – Pudim de passas - “Descoberta” do elétron; - A massa do átomo era composta somente por prótons e elétrons ; Millikan – Mediu a carga do elétron Rutherford – Sistema Solar - Provou que os elétrons não estão embutidos no átomo como afirmava Thomson; Experiência de Rutherford - Analisou os desvios das partículas radioativas; Rutherford – Sistema Solar - Descoberta do núcleo ; - Provou que os elétrons movemse em torno do núcleo; Estrutura do átomo segundo Rutherford Chadwick – Descoberta dos nêutrons Estrutura Atômica - Átomos são constituídos de nêutrons, prótons e elétrons; - Partícula Elétron Prótons Nêutrons Carga -1,602 x 10-19 1,602 x 10-19 0 - Unidade de massa atômica (1 u = 1/N0 = 1,66054 x 10-24 g) Tabela Periódica Família ou Grupo Massa Atômica Nº. Atômico Símbolo Atômico Nome do Elemento Moléculas – Compostos Moleculares Reunião de dois ou mais átomos ligados firmemente entre si; Fórmulas Moleculares: indicam os números e tipos efetivos de átomos em uma molécula; Ex.: C2H4 – etileno; Fórmula estrutural: mostra quais átomos estão ligados a quais em uma molécula. O / \ H H Água H | H –- C –- H | H Metano Íons – Compostos Iônicos Átomos podem ou perder Transferência de umfacilmente elétron de umganhar átomo neutro elétrons. são removidos ou de Na paraSe um elétrons átomo neutro de Cl leva à 2 formação de um cátion Na+ e um ânion Cl adicionados formam-se os íons; CaCl MgO Um íon com carga positiva é chamado de cátion, e um íon com carga negativa é chamado de ânion; Nomenclatura – Inorgânicos Compostos Iônicos: consiste no nome do ânion seguido da preposição ‘de’ e do nome do cátion; Ex.: CaCl2 (cloreto de cálcio) Al(NO3)3 (nitrato de alumínio) Compostos Ácidos: Cl- + H+ (cloreto) Íon oso ico eto Ácido ito ato ídrico HCl (ácido clorídrico) Nomenclatura – Orgânicos N° de carbonos 1 2 3 4 5 6 Prefixo Met_ Et_ Prop_ But_ Pent_ Hex_ Ligação (hidrocarboneto) Terminação simples _ano dupla _eno tripla _ino duas duplas _dieno Funções Álcool (–OH) Cetona (=O) Aldeído (–CHO) Amina (–NH2) Nitrila (–CN) Sufixo _ol _ona _al _amina _nitrila Etano H H | | H -- C – C -- H | | H H Propanol H H H | | | H -- C – C – C – OH | | | H H H Referências bibliográficas Química a ciência central 9ª edição – Brown, LeMay, Bursten Ilustrações: www.profcupido.hpg.ig.com.br/teoria_atomica images.google.com.br OBRIGADO PELA ATENÇÃO
Download