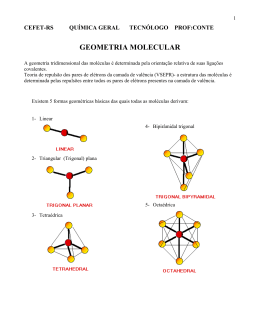
QUÍMICA ORGÂNICA I AULA 01 – LIGAÇÃO E ESTRUTURA MOLECULAR TÓPICO 05: TEORIA DA REPULSÃO DOS PARES ELETRÔNICOS DA CAMADA DE VALÊNCIA (TRPECV) VERSÃO TEXTUAL A Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (TRPECV) diz que o orbital contendo um par de elétrons livres repele uma ligação mais intensamente que uma outra ligação o faz. Isto explica o ligeiro achatamento observado. O ânion metila, CH3-, e o íon hidrônio, H3O+ (Figura 4-8), são isoeletrônicos com a amônia e têm estruturas piramidais como ela. Cada estrutura é aproximadamente tetraédrica com um par de elétrons livres em orbitais hibridizados sp3. Em consequência dos pares de elétrons se repelirem mutuamente, os pares de elétrons da camada de valência tendem a ficar mais afastados quanto possível. A repulsão entre os pares não-ligantes é, em geral, maior que a repulsão entre os pares ligantes. Chegamos à geometria da molécula pela consideração de todos os pares de elétrons (ligantes e não-ligantes), porém descrevemos a forma da molécula, ou do íon tomando, como referência as posições dos núcleos (ou átomos), e não as posições dos pares de elétrons. O metano, por exemplo, (Figura 5-1), tem 4 pares de elétrons ligantes e apenas a configuração tetraédrica permitirá que os quatro pares de elétrons tenham a máxima separação possível. O diclorometano, CH2Cl2, por também ter 4 pares de elétrons ligantes também tem sua estrutura melhor representada pelo arranjo tetraédrico. Todavia, alguém poderia sugerir que tanto o metano quanto o diclorometano tivesse geometria quadrado planar com ângulos de ligações de 90º. Esta sugestão foi descartada porque a tal estrutura planar do diclorometano permitira a existência de dois isômeros, fato este nunca observado. (FIGURA 5-1) Figura 5-1 - Geometrias tetraédrica e “quadrado planar” do metano e do diclorometano. Na molécula de trifluoreto de boro, BF3, somente uma configuração trigonal plana, na qual as ligações são separadas por ângulos de 120º, permitirá que os três pares de elétrons tenham a máxima separação possível, minimizando a energia da molécula. Já no ânion boroidreto, BF4-, a exemplo do metano e diclorometano, observam-se 4 pares de elétrons ligantes e, então, a estrutura é melhor representada pelo arranjo tetraédrico. O hidreto de berílio, BH2, por sua vez, tem apenas dois pares de elétrons ligantes. A geometria linear é a que permite uma melhor separação entre os pares ligantes. PARADA OBRIGATÓRIA Faça você mesmo: Utilize a Teoria da Repulsão dos Pares Eletrônicos de Valência para prever a geometria das seguintes moléculas e íons. a) BF2 b) NH4+ c) H2S e) :CCl3 d) CF4 - A tabela a seguir resume a relação da geometria adora pela molécula e seu número de pares ligantes e não ligantes. Tabela 5 1 - Geometria versus Número de Pares de Elétrons ATIVIDADE DE PORTFÓLIO Resolva os exercícios que seguem. EXERCÍCIOS 1) a) Na formação do NaCl a partir de um átomo de sódio e um átomo de cloro, um elétron é transferido da camada de valência do sódio para a camada de valência do cloro. Qual é o significado, em termos de números quânticos, de camada de valência? Dê uma descrição completa em termos dos quatro números quânticos daquele elétron transferido: a) quando ele está no átomo de sódio e b) após ele ter sido transferido para o átomo de cloro. Por que a transformação de NaCl por este processo é desencorajada? 2) Qual é a estrutura eletrônica das espécies que seguem? Você pode consultar uma tabela periódica antes de responder. H- HS- K+ Xe 3) Quais tipos de ligação podem ser formados entre os orbitais s e p? Qual possibilitará a melhor sobreposição, 1s + 2p ou 1s + 3p? Quais ligações serão mais fortes, aquelas entre H e C, N, O e F, ou aquelas entre H e Si, P, S e Cl? Justifique esta ordem de força de ligação: HF>OH>NH>CH. 4) Explique por que a molécula He2 não existe e o íon He2+ existe. 5) Construa um diagrama de orbitais moleculares para a molécula LiH e sugira qual tipo de ligação ela pode ter. 6) Deduza os OMs para a molécula de oxigênio. Qual é a ordem da ligação e onde estão os elétrons 2p? 7) Construa os orbitais moleculares do acetileno (etino) sem hibridizações. 8) Qual é a geometria e a hibridização de cada átomo de carbono nestas moléculas? FÓRUM Discuta com os colegas de turma a hibridação de todos os átomos das três moléculas do acima. FONTES DAS IMAGENS Responsável: Prof. Jose Nunes da Silva Junior Universidade Federal do Ceará - Instituto UFC Virtual
Download