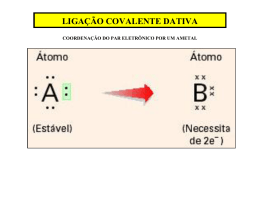
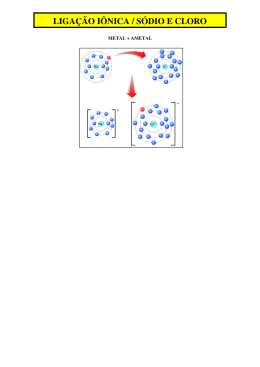
Ensino Médio – Unidade Parque Atheneu Professor (a): Aluno (a): Izabel Marques Série: 1ª Data: ____/ ____/ 2014. LISTA DE QUÍMICA I 1) A fórmula estrutural da água oxigenada: Fornece as seguintes informações: a molécula possui dois átomos de oxigênio ligados entre si e cada um deles ligado a um átomo de hidrogênio; há dois pares de elétrons isolados em cada átomo de oxigênio. Com as informações dadas a seguir, escreva a fórmula estrutural de uma molécula com as seguintes características: possui dois átomos de nitrogênio ligados entre si e cada um deles está ligado a dois átomos de hidrogênio: há um par de elétrons isolado em cada átomo de nitrogênio. 2) Entre os gases poluentes que compõem a atmosfera das grandes cidades, destaca-se o anidrido sulfúrico (SO3). Ele se combina facilmente com a água, formando um ácido muito forte, que se precipita na forma de “chuva ácida”. Identifique o tipo de ligação química presente na molécula do anidrido sulfúrico. Justifique sua resposta. 3) Os elementos H, O, Cl e Na (ver Tabela Periódica) podem formar compostos entre si. a) Que compostos podem-se formar entre: H e O, H e Cl, Na e Cl? b) Qual o tipo de ligação formada em cada caso? 4) Os elementos químicos que apresentam a última camada eletrônica incompleta podem alcançar uma estrutura mais estável unindo-se uns aos outros. a) De que forma se podem ligar dois átomos que precisem ganhar elétrons? b) Dois elementos situam-se um no segundo período e sub-grupo 4A, e o outro, no terceiro período e subgrupo 7 A da tabela periódica. Qual será a fórmula provável do composto por eles formado? 5) Considere as moléculas NH3, CH4, CO2 e H2O, indique a configuração espacial de cada uma, utilizando a terminologia: linear, angular, piramidal, quadrangular, tetraédrica. 6) Representar as Estruturas de Lewis e descrever a geometria de NO2-, NO3- e NH3. Para a resolução, considerar as cargas dos íons localizadas nos seus átomos centrais. (Números atômicos: N = 7; O = 8; H = 1.) 7) A partir das configurações eletrônicas dos átomos constituintes e das Estruturas de Lewis: a) Determine as fórmulas dos compostos mais simples que se formam entre os elementos (número atômicos: H = 1; C = 6; P = 15): I. hidrogênio e carbono; II. hidrogênio e fósforo. b) Qual é a geometria de cada uma das moléculas formadas, considerando-se o número de pares de elétrons? 8) Indique a geometria das substâncias PH3 e BF49) Escreva a estrutura de Lewis para cada uma das moléculas abaixo, prevendo a geometria molecular (incluindo os ângulos de ligação) e os orbitais híbridos no átomo central. a) XeOF4 c) XeO4 b) XeOF2 d) XeF4 10) Cite três características físicas que permitem identificar um elemento metálico. Atenção ao prazo de entrega das listas!!!Bom final de Semana!!! Unid. Parque Atheneu (62) 3273 – 0040 – www.colegiointerativa.com.br – e-mail: [email protected]
Download

![01) [2,0 pontos] Considere os átomos dos seguintes elementos: I](http://s1.livrozilla.com/store/data/001046502_1-19013d44a256f5fc7df7df0d3e2d094b-260x520.png)