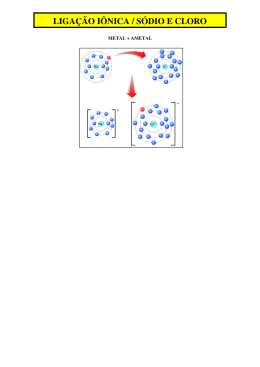
LIGAÇÃO COVALENTE DATIVA COORDENAÇÃO DO PAR ELETRÔNICO POR UM AMETAL ÁCIDO SULFÚRICO ESTRUTURA DE LEWIS MONÓXIDO DE CARBONO ESTRUTURA DE LEWIS DIÓXIDO DE ENXOFRE SOBREPOSIÇÃO DE ELETROSFERAS LIGAÇÃO METÁLICA ELÉTRONS LIVRES E CONFINADOS LIGAÇÃO METÁLICA NUVEM ELETRÔNICA OU MAR DE ELÉTRONS CONFORMAÇÃO DOS METAIS FORÇA ELETROSTÁTICA UNIFORMEMENTE DISTRIBUÍDA CARACTERÍSTICAS DOS METAIS PROPRIEDADES METÁLICAS BRILHO METÁLICO ELEVADO PONTO DE FUSÃO CONDUTIVIDADE ELÉTRICA E TÉRMICA LIGAS METÁLICAS COMBINAÇÃO DE DOIS OU MAIS METAIS LIGAS METÁLICAS COMBINAÇÃO DE DOIS OU MAIS METAIS MOLÉCULAS DIATÔMICAS NÚCLEOS ALINHADOS GEOMETRIA LINEAR ÁCIDO CIANÍDRICO GEOMETRIA ANGULAR GÁS OZÔNIO GEOMETRIA TRIANGULAR TRIÓXIDO DE ENXOFRE GEOMETRIA ANGULAR ÁGUA GEOMETRIA PIRAMIDAL AMÔNIA GEOMETRIA TETRAÉDRICA METANO MUSIQUINHA MOLÉCULAS Defendo que a molécula formada por dois átomos apenas é linear Se ela têm três átomos não sobra par de elétrons no central Ela também é linear Agora quando sobra a molécula tem geometria angular E ela com quatro átomos pode ser piramidal ou triangular Eu sei dizer que elétron sobrou ela é piramidal Se não sobra ela tem geometria trigonal Se você quer aprender precisa entender Geometria tetraédrica cinco átomos vai ter QUESTÃO EXTRA PROPRIEDADES PERIÓDICAS ( Uel ) Os gráficos I e II estão representando aleatoriamente os 7 elementos químicos representativos do 3º. período e do 5º. período da tabela periódica respectivamente, sem os gases nobres. O gráfico I mostra o tamanho dos átomos e o gráfico II mostra a energia de ionização dos átomos. Consultando a tabela periódica e comparando os gráficos I e II, é correto afirmar que estão na mesma família ou grupo somente: a) Os átomos da posição Y nos gráficos I e II. b) Os átomos da posição T nos gráficos I e II. c) Os átomos da posição Z nos gráficos I e II. d) Os átomos das posições M e D nos gráficos I e II. e) Os átomos das posições G e H nos gráficos I e II. alternativa A
Download