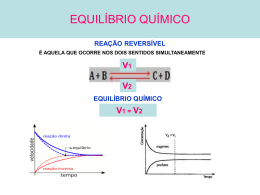
Equilíbrio Químico èIntrodução – Histórico: foi no início da segunda metade do século XIX que surgiram as primeiras ideias sobre equilíbrio químico em pesquisas que procuravam solucionar a questão da afinidade química. A primeira pessoa a citar o nome equilíbrio químico foi A. Williamson ao constatar que quando uma reação produz substâncias com uma velocidade definida e essas substâncias, por sua vez, reagem novamente para regenerar o produto inicial há um momento em que se estabelece um equilíbrio entre essas duas reações. •Guldberg e Waage: foram os primeiros a perceberem a importância do conceito de equilíbrio químico e também foram responsáveis pela “Lei da Ação das Massas” –também conhecida como constante de equilíbrio-‐. •Van’t Hoff: lançou a ideia de que uma reação endotérmica (que absorve calor) é favorecida pelo aumento da temperatura, enquanto uma reação exotérmica (que libera calor) é favorecida pela diminuição da temperatura. •Deville: descobriu que algumas moléculas, como a de enxofre, podem ter sua constituição variada de acordo com a temperatura. A isso deu o nome de ‘fenômeno da dissociação’. •Le Chatelier: formulou uma lei da influência da pressão sobre um sistema químico em equilíbrio quando nele estão envolvidos gases e a temperatura é constante: aumentando-‐se a pressão, a reação ocorre no sentido em que houver diminuição do volume e diminuindo-‐se a pressão, a reação ocorre no sentido em que houver aumento do volume. Porém, o que mais o deixou conhecido foi o ‘Princípio de Le Chatelier’ que nos afirma que quando se alteram as condições de um sistema inicialmente em equilíbrio, este desloca-‐se no sentido de restabelecer as condições iniciais. èEquilíbrio Químico: é definido como uma parte da físico-‐química que estuda as reações reversíveis –lembrando que nem toda reação é reversível, mas toda reação reversível entra em equilíbrio-‐ e as condições para estabelecimento desta atividade equilibrada. •Reações que se desenvolvem ao mesmo tempo e em sentidos opostos são chamadas de reações reversíveis. São exemplos dessas reações a síntese da amônia e do ácido sulfúrico e a solução saturada de carbonato de cálcio. •A nivelação de velocidade da reação direta e a da reação inversa é considerada a causa do equilíbrio químico. E a consequência está nas mudanças de concentração das substâncias reagidas e produzidas. Já as condições necessárias para o equilíbrio ser atingido são duas: existência de um sistema fechado e temperatura e pressão constantes. ↔Características do equilíbrio químico: •A velocidade da reação direta, durante o equilíbrio, é equivalente à da reação indireta (V1=V2). •O equilíbrio é dinâmico, o que significa dizer que V1=V2 ≠ 0 e, além disso, é isso que nos permite dizer que, durante o equilíbrio, as propriedades microscópicas estão em evolução. •As concentrações, tanto de reagentes quanto de produtos, permanecem constantes e isso permite a existência de uma constante de equilíbrio. •As propriedade macroscópicas como calor, temperatura e pH permanecem constantes, ou seja, não se percebe nenhuma modificação externamente. •Uma reação reversível necessariamente se desloca espontaneamente para um estado de equilíbrio no qual teremos um máximo de entropia (S) e um mínimo de entalpia (H). ─Energia livre e equilíbrio químico: Para que uma reação ocorra, a energia livre – tendência da reação realizar-‐se-‐ do sistema deve sempre diminuir, sendo que no equilíbrio seu valor equivale a zero, quando seu valor é negativo a reação é espontânea e quando é positivo a reação é não espontânea. Portanto, as reações ocorrem ou porque a entalpia dos produtos é menor que a entalpia dos reagentes (∆H<0) ou porque a entropia dos produtos é maior que a dos reagentes (∆>0). Obs: 1) entropia é a tendência para desordem de um sistema. 2)A medida que a pressão parcial dos produtos ou dos reagentes diminui e a outra aumenta, o sistema tende a entrar em equilíbrio e, consequentemente, ∆G tende a atingir o valor mínimo. 3) O quociente da reação, Q, é determinado da mesma maneira que ke. Porém, Q pode ser maior, menor ou igual à ke e com isso é possível concluir que pode ser medido a qualquer momento. Além disso, no equilíbrio Q= ke e, para atingir o equilíbrio, o sistema evoluirá sempre de modo chegar nessa igualdade. 4) Se eu somar duas equações a constante nova será a multiplicação das constantes das equações somadas. ∆G = ∆H − T∆S ↔Análise gráfica: ↔Constante de equilíbrio (ke): Também é conhecida como ‘Lei da ação das Massas’ e é obtida através da razão entre a concentração ou a pressão parcial de cada produto elevada a cada coeficiente estequiométrico e a concentração ou pressão parcial de cada reagente elevada a cada coeficiente estequiométrico. No caso da concentração, levam-‐se em conta apenas as substâncias aquosas e gases. Já no caso da pressão levam-‐se em conta apenas os gases. Uma constante de equilíbrio pode medir o rendimento (quanto maior este for, maior a constante) e Kp = Kc . RT (Δn) Obs: 1)Toda constante química depende da reação e da temperatura. 2) Kp = Kc quando o número de mols de gases dos reagentes é igual ao número de mols de gases dos produtos. 3) Água quando é solvente tem concentração constante e, portanto, não é expressa na constante de equilíbrio ↔Grau de equilíbrio (α): é responsável por indicar a porcentagem da quantidade de uma determinada espécie que reagiu até que a reação atingisse o equilíbrio. É dado sempre em função de algum reagente e demonstra quanto desloca o equilíbrio. ∝= 𝑵𝒓 𝑵𝒊 em que Nr é o número de mols transformados e Ni é o número de mols iniciais ∝ % =∝ .100 ↔Princípio de Le Chatelier: determinou que se um sistema for perturbado por alguma ação externa, ele tende a anulá-‐la voltando para a situação de equilíbrio. Este princípio é afetado pela concentração, pela pressão e pela temperatura. É importante lembrar que deslocar um equilíbrio é alterar sua condição, fazendo uma das reações ser favorecida. Tem que levar em conta aspecto de rendimento, cinética das reações e economia. •Concentração: ao aumentar a concentração do reagente o equilíbrio tende a se deslocar no sentido da reação direta e, ao aumentar a concentração do produto o equilíbrio tende a se deslocar no sentido da reação indireta. Já ao diminuir a concentração, o equilíbrio tende a se deslocar para o lado em que houve a diminuição da concentração. Ou seja, o equilíbrio se desloca sempre no sentido que tem menor concentração a fim de ser restabelecido. •Pressão: é capaz de alterar o equilíbrio desde que se tenha gases na reação e que haja uma diferença entre a quantidade de moléculas gasosas nos reagentes e nos produtos. Aumentando a pressão o equilíbrio se desloca para o lado de menor volume e diminuindo a pressão o equilíbrio se desloca para o lado de maior volume. No caso da pressão externa como, por exemplo, ao acrescentar um gás inerte, o equilíbrio só se desloca se esse gás reagir com algum reagente ou com algum produto diminuindo, então, a concentração deste. Se o gás não reagir com nenhum produto e com nenhum reagente nada ocorre já que acarretará em um aumento igual da pressão em todo o sistema. •Temperatura: de todos os fatores que alteram um equilíbrio é o único capaz de alterar a constante de equilíbrio. No geral, costuma-‐se falar que aumentando a temperatura a reação endotérmica é favorecida e diminuindo a temperatura a reação exotérmica é favorecida, isto está correto, mas tem um detalhe: o fato de favorecer uma ou outra reação não significa que apenas ela sofreu alterações, significa que ela sofreu mais alterações que a reação não favorecida. Por exemplo, um aumento da temperatura aumenta a velocidade de ambas as reações, mas favorece a endotérmica por ser a que possui maior energia de ativação. Obs: de modo geral, para reações endotérmicas um aumento da temperatura acarreta em um aumento da constante e uma diminuição da temperatura em uma diminuição da constante. •Catalisador: não é capaz de alterar a condição de um equilíbrio uma vez que um catalisador, além de diminuir a energia de ativação, é responsável por aumentar a velocidade da reação direta e da indireta, mas na mesma proporção. O único objetivo do uso do catalisador é fazer com que se atinja o equilíbrio mais rápido. èEquilíbrio Iônico: é um caso particular do equilíbrio químico no qual participam íons. Esse tipo de equilíbrio ocorre principalmente entre espécies químicas denominadas eletrólitos fracos em solução aquosa, ou seja, ácidos e bases fracas¹. ↔Eletrólitos: são substancias que dissolvidas em água sofrem ionização ou dissociação iônica, permitindo a passagem de corrente elétrica. O grau de ionização ou de dissociação iônica é a razão entre o número de mols ionizados e o número total de mols dissolvidos em água. Obs: ionização é o fenômeno em que há formação de íons e ocorre com ácidos, dissociação é a separação dos íons já existentes e ocorre com bases e sais. ↔Constante de ionização: é expressa da mesma maneira que a constante de equilíbrio sendo que, nesse caso, sempre haverá íons. Essa constante pode medir a força de um ácido e de uma base –quanto maior o valor de kA, maior a concentração e mais forte-‐. Obs: a concentração da água não aparece, pois não interfere no valor desta constante. ¹ São ácidos fracos: HCN, HCOOH, HClO, HF, HNO2, CH3COOH, H2S E H2CO3. Já as bases fracas têm como exemplos: hidróxidos de metais de transição, as aminas e o NH3. ↔Lei da diluição de Ostwald: é responsável por relacionar a constante de ionização ao grau de ionização e estabelecer a correlação entre diluição e grau de ionização. Obs: 1) A diluição gradativa aumenta o grau de ionização do eletrólito. ↔Efeito do íon comum: é uma aplicação pura e simples da Lei de Chatelier que fala sobre a alteração da posição de equilíbrio pela adição de um íon comum a ele, tornando, então, o eletrólito menos ionizado. èEquilíbrio de solubilidade: é um caso particular de equilíbrio heterogêneo e iônico que envolve a propriedade das substâncias em se dissolverem –ficar aquoso-‐ e dissociarem –virar íons-‐ em outra. É possível para substâncias pouco solúveis numa solução saturada² desta substância em determinada temperatura. Quando um sistema está em equilíbrio ocorre a dissolução e a precipitação com a mesma velocidade (V1=V2). ²aquela que apresenta a quantidade máxima de soluto que pode estar dissolvido em um solvente de acordo com o CS. ↔Solubilidade e kps: kps = [B+].[A-‐] Chamamos de solubilidade a quantidade máxima de soluto que se dissolve em determinado volume de solução, formando uma solução saturada. Na representação kps não aparece a [BA], pois, como sabemos, sólidos não são expressos na constante. assim, por exemplo, + -‐ se falarmos que a [Ag ]=[Cl ]=s, Ks= s². ↔Aplicações de kps: 1) Análise da solubilidade das substâncias: kps é um indicativo da maior ou menor solubilidade de uma substâncias. Quanto maior o valor de kps, maior a solubilidade 2)Previsão de precipitação: quando o produto da concentração dos íons supera o kps, ocorre precipitação. Se igual a solução é saturada e, se menor, a solução é insaturada. 3)Precipitação fracionada: é um recurso utilizado na química analítica e serve para separar cátions ou ânions de uma mistura através da adição de um íon que formará substâncias pouco solúveis. Por exemplo, se em uma solução saturada eu tenho Ca2+, Fe2+ e Cu2+ e quero separar o último cátion, posso adicionar a essa substância Na2S e, assim S2-‐ reagirá com Cu2+ formando CuS.
Download