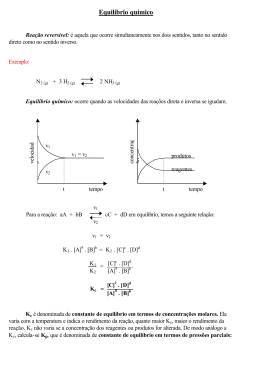
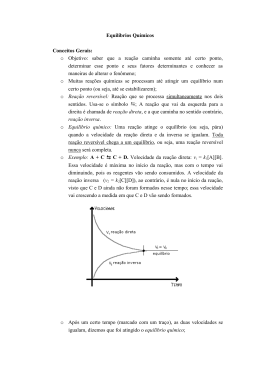
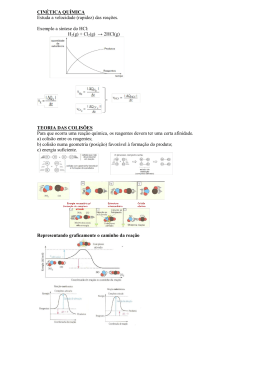
Equilíbrio Químico A+B C+D REVERSIBILIDADE Reações que se desenvolvem ao mesmo tempo, em direções opostas. Ou seja, reagentes e produtos são consumidos e formados ao mesmo tempo. EQUILÍBRIO QUÍMICO – condições: Sistema fechado e temperatura e pressão constantes Reação DIRETA e reação INVERSA REAÇÃO DIRETA N2O4(g) REAÇÃO INVERSA velocidade vd 2 NO2(g) No início da reação a velocidade direta é máxima instante a reação atingiu o equilíbrio químico Vd = Neste Vi com o passar do tempo vi No início da reação a velocidade inversa é nula te tempo V1 = V2 No equilíbrio químico ... 1 cC + dD aA + bB 2 V1 = V2 K1 .[ A ]a. [ B ]b = K2 .[ C ]c. [ D ]d K1 = [ C ]c. [ D ]d = kc K2 [ A ]a. [ B ]b K1 = [ C ]c. [ D ]d = kc K2 [ A ]a. [ B ]b Medidas de concentração para o sistema abaixo, em equilíbrio, a uma certa temperatura forneceram os seguintes resultados: [ H2 ] = 0,10 mol/L H2 ( g ) + I2 ( g ) 2 HI ( g ) [ I2 ] = 0,20 mol/L [ HI ] = 1,0 mol/L Determine a constante de equilíbrio da reação nestas condições. ( 1,0 ) 2 KC = = (0,10) x (0,20) 1,0 0,02 KC = 50 04) Foram colocados em um recipiente fechado, de capacidade 2,0 L, 6,5 mol de CO e 5 mol de NO2. À 200°C o equilíbrio foi atingido e verificou-se que haviam sido formados 3,5 mol de CO2. Podemos dizer que o valor de Kc para o equilíbrio dessa reação é: a) 4,23. CO + NO2 b) 3,84. c) 2,72. início 6,5 d) 1,96. reage / produz 3,5 equilíbrio 3,0 CO2 + NO 5,0 0,0 0,0 3,5 3,5 3,5 1,5 3,5 3,5 e) 3,72. 3,5 [ CO2 ] [ NO ] [ CO ] = = 2,0 3,5 2,0 3,0 = 2,0 1,5 [ NO2 ] = 2,0 = 1,75 M KC = [ CO2 ] [ CO ] = 1,75 M KC = 1,50 = 1,50 M KC = = 0,75 M 1,75 x x 3,0625 1,125 [ NO ] x x [ NO2 ] 1,75 0,75 KC = 2,72 1.888 2 NO2(g) Castanho avermelhado EXOTÉRMICA N2O4(g) ENDOTÉRMICA incolor ΔH < 0 Vamos analisar o equilíbrio abaixo: Cr2O7 2– alaranjada 1 + H2O 2 2 CrO4 amarela 2– + 2H+ Consideremos o efeito da variação de concentração na mistura em equilíbrio cloro e água. A equação de equilíbrio é: Cl2 + 2 H2O HOCl + H3O+ + Cl- Esquerda Direita Esquerda Direita Esquerda Podemos generalizar afirmando que um(a) ... AUMENTO DE CONCENTRAÇÃO desloca o equilíbrio no SENTIDO OPOSTO da espécie química adicionada DIMINUIÇÃO DE CONCENTRAÇÃO desloca o equilíbrio no mesmo MESMO SENTIDO da espécie química retirada N2 ( g ) + 3 H2 ( g ) 2 NH3 ( g ) 4 volumes 2 volumes A reação em equilíbrio, ocorre a variação do n. moles de reagentes e produtos, ou seja variação de volume. Um aumento de pressão desloca o equilíbrio para o lado de menor volume (menor n. moles) para diminuir o efeito do aumento da pressão. Aumento de volume diminui a pressão total desloca para o maior número de moléculas Redução de volume aumenta a pressão total desloca para o menor número de moléculas Exemplo: N2(g) + 3 H2(g) 1mol 3 mols 2 NH3(g) 2 mols O lado esquerdo da reação representa 4 mols de gás combinando-se para dar 2 mols no lado direito. Um aumento na pressão total do sistema desloca o equilíbrio para a direita. Exemplo: N2(g) + O2(g) 2 NO(g) 1mol 1 mol 2 mols Considere a reação em equilíbrio químico: N2 (g) + O2 (g) 2 NO (g) É possível deslocá-lo para a direita: a) Retirando o N2 existente. b) Removendo o NO formado. c) Introduzindo um catalisador. d) Diminuindo a pressão, à temperatura constante. e) Aumentando a pressão, à temperatura constante. O equilíbrio gasoso representado pela equação : N2( g ) + O2( g ) 2 NO( g ) – 88 kj É deslocado no sentido de formação de NO(g), se : a) a pressão for abaixada. b) N2 for retirado. c) a temperatura for aumentada. d) for adicionado um catalisador sólido ao sistema. e) o volume do recipiente for diminuído. Referências – Equilíbrio Químico Agamenon Roberto
Download