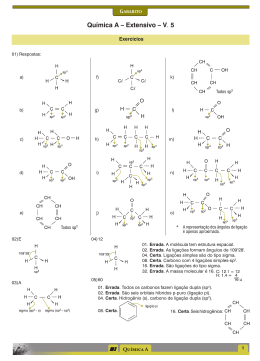
QUÍMICA Prof. Arthur LISTA DE EXERCÍCIOS - 1.7: LIGAÇÕES QUÍMICAS, GEOMETRIA MOLECULAR, POLARIDADE E INTERAÇÕES INTERMOLECULARES 1. (Fac.Coc-SP) Dois elementos químicos, X e Y, apresentam os seguintes subníveis energéticos, no 2 5 estado fundamental: 4s e 3p , respectivamente. Qual é a fórmula mais provável de um composto formado por esses dois elementos? 2. (Unesp-SP) Tem-se dois elementos químicos A e B, com números atômicos iguais a 20 e 35, respectivamente. Qual será a fórmula do composto formado entre os elementos A e B? Que tipo de ligação existirá entre A e B no composto formado? Justificar. 3. (Cesgranrio-RJ) Quando o elemento X (Z = 19) se combina com o elemento Y (Z = 17), obtém-se um composto cuja fórmula molecular e cujo tipo de ligação são, respectivamente? 4. (UFJF-MG) Em uma ligação química em que há grande diferença de eletronegatividade entre os átomos, irá ocorrer formação de compostos: a) moleculares. b) de baixo ponto de fusão. c) não-condutores de corrente elétrica, quando fundido. d) insolúveis na água. e) que apresentam retículo cristalino. 5. (PUC-Campinas-SP) Dentre as seguintes propriedades das substâncias: I - elevada temperatura de fusão; II - boa condutividade elétrica no estado sólido; III - formação de solução aquosa condutora de corrente elétrica; IV - elevada solubilidade em líquidos apolares. Quais caracterizam compostos iônicos? a) I e II b) I e III c) II e III d) II e IV e) III e IV 6. (FGV-SP) Quantos átomos de cloro se combinam com um átomo de qualquer elemento da família IIA da Tabela Periódica? 7. (Unimep-SP) Átomos do elemento A (Z = 12) combinaram-se com átomos do elemento B (Z = 15). A fórmula do composto formado é? 8. (UFJF-MG) Num composto iônico XY3, sendo X o cátion e Y o ânion, no estado normal, os átomos X e Y devem possuir, respectivamente, na última camada: 9. (Unicamp-SP) Considere as seguintes informações sobre os elementos químicos X, Y e Z: a) Quais são os elementos X, Y e Z? b) A combinação de dois desses elementos pode formar substâncias não iônicas e gasosas à temperatura e pressão ambientes. Escreva a fórmula de uma dessas substâncias. 1 10. (UFMG-MG) Considere os elementos 1A, 8B, 17C. a) Faça a distribuição eletrônica dos três elementos e indique o número de elétrons existentes em suas camadas de valência. b) Faça a combinação entre (A e B) e (A e C). Indique a fórmula eletrônica e a estrutural de cada composto resultante das combinações. 11. (FCMSC-SP) Por compartilhamento de elétrons, muitos átomos adquirem eletrosferas iguais às dos gases nobres. Isso acontece com todos os átomos representados na fórmula: a) O - F. b) O = F. c) F = O = F. d) F - O - F. e) O - F - O. 12. (Fuvest-SP) Considere o elemento cloro formando compostos com, respectivamente, hidrogênio, carbono, sódio e cálcio. a) Com quais desses elementos o cloro forma compostos covalentes? b) Qual a fórmula eletrônica de um dos compostos covalentes formados? 13. O enxofre pode ser encontrado sob a forma de moléculas S 2. Nessas moléculas, cada átomo adquiriu configuração eletrônica de gás nobre ao compartilhar quantos pares de elétrons? 14. (PUC-MG) O elemento bromo forma compostos iônicos e moleculares. Apresente, respectivamente, um composto iônico e um molecular formado pelo bromo. 15. O iodo (I) combina-se com o hidrogênio (H), formando o ácido iodídrico. Sabendo-se que o número atômico do iodo é igual a 53 e o do hidrogênio é igual a 1, informe: a) a fórmula molecular do ácido iodídrico b) a fórmula eletrônica (Lewis) do ácido iodídrico c) a fórmula estrutural do ácido iodídrico 16. (Unesp-SP) A partir das configurações eletrônicas dos átomos constituintes e das estruturas de Lewis: a) determine as fórmulas dos compostos mais simples que se formam entre os elementos: I. hidrogênio e carbono; II. hidrogênio e fósforo. b) Qual é a geometria de cada uma das moléculas formadas, considerando-se o número de pares de elétrons? Números atômicos: H = 1; C = 6; P = 15. 17. Para cada molécula NH3, CO2, SO2, SO3, CH4, H2O, CCl4, H2, HF informe: a) a fórmula molecular b) a fórmula eletrônica (Lewis) c) a fórmula estrutural d) a geometria molecular e) a polaridade molecular 18. (UNIFESP-SP) Na figura, são apresentados os desenhos de algumas geometrias moleculares. SO3, H2S e BeCℓ2 geometrias moleculares: a) III, I e II. b) III, I e IV. c) III, II e I. d) IV, I e II. e) IV, II e I. apresentam, respectivamente, as 19. (CEFET-CE) A geometria de uma molécula é informação muito importante, uma vez que define algumas propriedades do composto, como a polaridade, a solubilidade, o ponto de fusão e ebulição, possibilitando uma boa aplicação para ela. O fosgênio COCℓ2 é usado na obtenção dos policarbonatos, que são plásticos que se aplicam na fabricação de visores para astronautas, vidros à prova de bala e CDs. A amônia que é bastante solúvel em água e no estado líquido é utilizada como solvente. O tetracloreto de carbono é um líquido muito pouco reativo, sendo empregado como solvente de óleos, gorduras e ceras. As estruturas dos três compostos citados estão representadas logo a seguir. 2 Com relação à geometria das moléculas I, II e III, na figura, é correto afirmar: a) Todas são planas. b) Todas são piramidais. c) Apenas I e II são planas. d) Apenas I é plana. e) Todas são tetraédricas. 20. (UEL-PR) Cloro é mais eletronegativo do que o bromo. Sendo assim, mostre uma molécula formada por esses dois elementos. Ela pode ser classificada como polar ou apolar? 21. (Mackenzie-SP) Analise as seguintes informações: I. A molécula CO2 é apolar, sendo formada por ligações covalentes polares. II. A molécula H2O é polar, sendo formada por ligações covalentes apolares. III. A molécula NH3 é polar, sendo formada por ligações iônicas. Quais são verdadeiras? 22. (Unesp-SP) Dentre as afirmativas abaixo, assinale a que contém a afirmação incorreta. a) Ligação covalente é aquela que se dá pelo compartilhamento de elétrons entre dois átomos. b) O composto covalente HCℓ é polar, devido à diferença de eletronegatividade existente entre os átomos de hidrogênio e cloro. c) O composto formado entre um metal alcalino e halogênio é covalente. d) A substância da fórmula Br2 é apolar. e) A substância da fórmula CaI2 é iônica. 23. (UFRGS-RS) As substâncias SO2 e CO2 apresentam moléculas que possuem ligações polarizadas. Sobre as moléculas destas substâncias, é correto afirmar que a) ambas são polares, pois apresentam ligações polarizadas. b) ambas são apolares, pois apresentam geometria linear. c) apenas o CO2 é apolar, pois apresenta geometria linear. d) ambas são polares, pois apresentam geometria angular. e) apenas o SO2 é apolar, pois apresenta geometria linear. 24. As ligações químicas nas substâncias K(s), HCℓ(g), KCℓ(s) e Cℓ2(g) são respectivamente: 25. (UFSC-SC) Considere a tabela a seguir e selecione a(s) proposição(ões) que relaciona(m) CORRETAMENTE a forma geométrica e a polaridade das substâncias citadas: 01. H2O: angular e polar. 02. CO2: linear e apolar. 04. CCℓ4: trigonal e polar. 08. NH3: piramidal e polar. 16. CCℓ4: tetraédrica e apolar. Soma das alternativas corretas ( ) 26. (UFUberlândia-MG) A molécula apolar que possui ligações covalentes polares é a) CH3Cℓ. b) CHCℓ3. c) Cℓ2. d) CCℓ4. 3 27. (UFPA-PA) O gás carbônico (CO2), quando congelado, é conhecido como gelo-seco, muito utilizado nos carrinhos de sorvete e em efeitos especiais em cinema e televisão. Nessa condição, suas moléculas estão unidas por qual interação intermolecular? 28. (UFSE-SE) Na seguinte estrutura estão representadas moléculas de água unidas entre si por: 29. (PUC-MG) Sabe-se que um tipo importante de ligação que mantém as bases nitrogenadas ligadas no DNA são aquelas circuladas na figura adiante. Observando-se o desenho a seguir, essas ligações são do tipo: 30. (UFC-CE) Recentemente, uma pesquisa publicada na revista Nature (Ano: 2000, vol.405, pg. 681) mostrou que a habilidade das lagartixas (víboras) em escalar superfícies lisas como uma parede, por exemplo, é resultado de interações intermoleculares. Admitindo que a parede é recoberta por um material apolar e encontra-se seca, informe o tipo de interação que prevalece entre as lagartixas e a parede, respectivamente: 4 GABARITO 1. XY2 13. 1 par 2. A: 1s2 2s2 2p6 3s2 3p6 4s2 grupo IIA B: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 grupo VIIA AB2- ligação iônica, onde A = metal e B = ametal. 14. CaBr2 e HBr 15. a) HI b) c) 3. XY e ligação iônica. 4. E 16. 5. B 6. B 7. A3B2 8. 3 e 7 9. a) Os elementos X, Y e Z são, respectivamente, oxigênio, carbono e potássio. b) A combinação de X e Y pode originar gás carbônico - CO2. 10. a) 1A: 1s1 – CV: 1e- / 8B: 1s2 2s2 2p4 – CV: 6e- / 17C: 1s2 2s2 2p6 3s2 3p5 – CV: 7eb) 17. Resolução em sala de aula 18. E 19. D 20. Cl - Br, que é polar. 21. Somente I 22. C 23. C 24. Metálica, covalente, iônica e covalente. 11. D 25. - 01 + 02 + 08 + 16 = 27 12. a) O elemento químico cloro (7A) forma compostos moleculares (Ametal + Ametal ou Ametal + H) com o Hidrogênio e também com o carbono (4A). b) Fórmulas eletrônicas: 26. D 27. Dipolo induzido – Dipolo induzido (van-derwaals) 28. Ligações de hidrogênio 29. Ligações de hidrogênio 30. Dipolo induzido – Dipolo induzido 5
Download