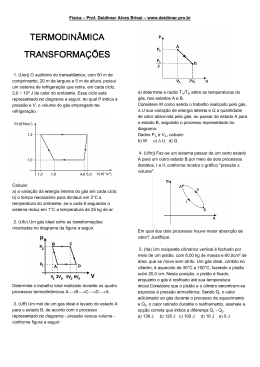
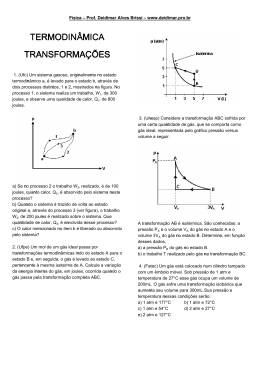
Estudo dos Gases Prof. André Luiz Retek Variáveis de Estado Um gás é caracterizado por três grandezas: • Temperatura: estado de agitação das moléculas; • Volume: espaço ocupado pelo corpo; • Pressão: Relação entre Força e Área de contato. 𝐹 𝑃= 𝐴 Transformações Gasosas – Isocórica ou Isovolumétrica Transformação realizada a volume constante. Situação inicial (A) Situação final (B) Situação final (B) Aumentando a Temperatura, a Pressão também aumenta 𝑃𝐴 𝑃𝐵 = 𝑇𝐴 𝑇𝐵 Diagrama P x T P T Transformações Gasosas – Isobárica Situação final (B) Transformação realizada a pressão constante. Situação final (B) Situação inicial (A) Aumentando a Temperatura, o Volume também aumenta 𝑉𝐴 𝑉𝐵 = 𝑇𝐴 𝑇𝐵 Diagrama V x T V T Transformações Gasosas – Isotérmica Transformação realizada a temperatura constante. Situação inicial (A) Situação final (B) Diminuindo o Volume a Pressão aumenta 𝑃𝐴 . 𝑉𝐴 = 𝑃𝐵 . 𝑉𝐵 Situação final (B) Diagrama P x V P 𝑇2 𝑇1 𝑇1 𝑒 𝑇2 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒𝑠 𝑇2 > 𝑇1 V Equação de Clapeyron 𝑃𝑉 = 𝑛𝑅𝑇 • P = pressão P = [atm, N/m2] • V = volume V = [litro, m3] • n = número de mols 𝑚 𝑛= m = massa 𝑀 M = massa molar • R = constante universal dos gases perfeitos 𝑎𝑡𝑚.𝑙 𝐽 𝑅 = 0,082 ou 𝑅 = 8,31 𝑚𝑜𝑙.𝐾 𝑚𝑜𝑙.𝐾 • T = Temperatura T = [K] Lei Geral dos Gases Perfeitos 𝑃𝑉 = 𝑛𝑅𝑇 𝑃𝑉 =𝑅 𝑛𝑇 𝑃𝐴 . 𝑉𝐴 𝑃𝐵 . 𝑉𝐵 = 𝑛𝐴 . 𝑇𝐴 𝑛𝐵 . 𝑇𝐵 Condições Normais de Temperatura e Pressão (CNTP) Temperatura : 𝜃𝑐 = 0°𝐶 T =273 K Pressão : 1 atm = 105 𝑁 𝑚2
Download