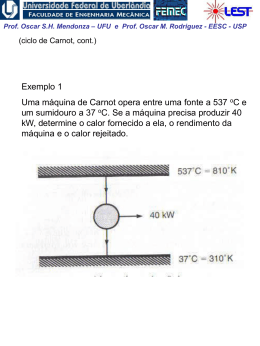
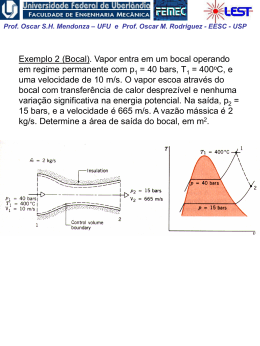
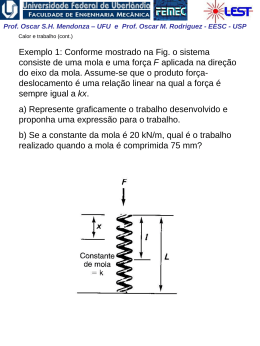
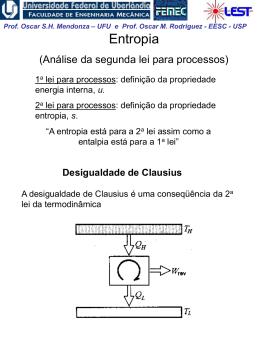
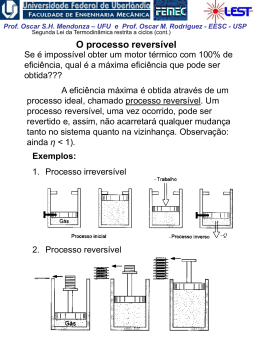
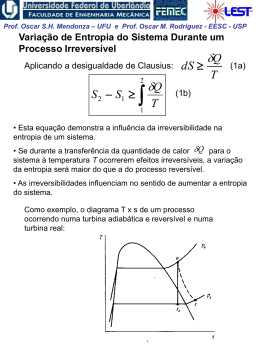
Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP 1ª Lei da Termodinâmica para sistemas (cont.) A Propriedade Termodinâmica Entalpia H = U + PV visto que todas essas quantidades são ENTALPIA h = u + pv propriedades termodinâmicas, funções apenas dos estado do sistema, sua combinação também deve possuir essas mesmas características Exemplo: calor é transferido para um sistema em um processo quase-estático a pressão constante, (ΔEC = ΔEP = 0). W 1 Q2 U 2 U1 1W2 Neste caso a pressão é constante,o sistema de massa2 fixa: 1 W2 1 pdV p dV pV 2 1 V1 1 Portanto: 1 Q2 U 2 U1 p2V2 p1V1 U 2 p2V2 U1 p1V1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Conclusão: o calor transferido em um processo quaseestático a pressão constante é igual à variação da entalpia do processo! 1 Q2 H 2 H1 Obs: resultado válido apenas para este caso restrito. Para processos que ocorrem com variação de pressão, entalpia não tem esse significado físico; porém, sendo uma propriedade termodinâmica, entalpia é uma função de ponto, ou seja, não depende do processo. Sendo assim, é válida para qualquer processo a seguinte relação: u h pv O estado de referencia, nas tabelas de vapor de agua, é o do líquido saturado a 0,01 oC, onde a energia interna recebe o valor zero. Assim, é possível termos valores negativos de entalpia. Na região de saturação: h hl xhlv Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Calores Específicos a Volume e a Pressão Constantes CALOR ESPECÍFICO: a quantidade de calor necessária para elevar a temperatura de uma unidade de massa da substância em 1 grau. calor 1 Q c massa T m T (Considera-se apenas uma fase homogênea, sólida, líquida ou gasosa) Para uma substância simples compressível e processo quase estático ( ΔEC = ΔEP = 0 e W = pdV ), da 1a lei da termodinâmica: Q dU W dU pdV 1. Volume constante (pdV = 0): cv 1 Q 1 U u m T v m T v T v 2. Pressão constante ( dU pdV U 2 U1 pV2 pV1 H 2 H1 dH): 1 Q 1 H h cp m T p m T p T p Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP Obs: calores específicos também são propriedades termodinâmicas! Para sólidos e líquidos: dh du d pv du (praticamente incompressíveis) 0 Assim: dh du c dT cv ou c p Obs.: para temperaturas não muito baixas e para um intervalo não muito grande de temperaturas: cv c p c constante Assim, para sólidos e líquidos: h2 h1 u2 u1 cT2 T1 Prof. Oscar S.H. Mendonza – UFU e Prof. Oscar M. Rodriguez - EESC - USP EXEMPLO 1: Vapor inicialmente úmido, contendo 3% de umidade a 7,5 kPa, é condensado até a saturação do líquido. Quanto calor foi retirado por Kg de vapor, assumindo o processo a pressão constante? EXEMPLO 2: Calor é fornecido a pressão constante para uma máquina turboélice como mostrado na Fig. Se a temperatura do ar é aumentada de 20oC para 500oC na câmara de combustão, determine o calor transferido por kg de ar. A pressão na câmara de combustão é de 1 MPa e supomos um calor específico constante cp = 1,0062 kJ / (Kg K) para o ar durante o processo.
Download