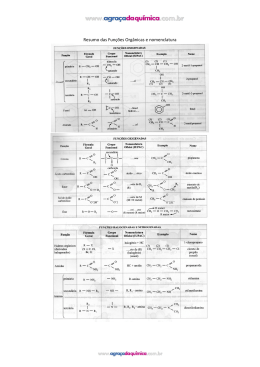
QUÍMICA 1 LIVRO 2 Resoluções das atividades Sumário Capítulo 5 – Estudo dos hidrocarbonetos...................................................................................................................................................................................................1 Capítulo 6 – Ressonância e aromaticidade..................................................................................................................................................................................................3 Capítulo 7 – Sinopse das funções orgânicas................................................................................................................................................................................................5 Capítulo 5 IV. (V) O hidrocarboneto D obedece à fórmula geral CnH2n, e o número de carbonos é maior que 2 (n > 2). V. (V) O hidrocarboneto obedece à fórmula geral CnH2n–2, e o número de carbonos é maior que 2 (n > 2). Estudo dos hidrocarbonetos Atividades para sala 02 B 01 E Após a análise das fórmulas moleculares e das proposições, tem-se: C15H32: (A)Alcano porque obedece a fórmula geral CnH2n+2, sendo n ≥ 1. C2H4: (B)Alceno porque obedece a fórmula geral CnH2n, sendo n ≥ 2. C2H2: (C)Alcino porque obedece a fórmula geral CnH2n–2, sendo n ≥ 2. C3H4: (E)Com essa fórmula molecular é possível escrever compostos pertencentes às subfunções alcino, alcadieno e cicleno, visto que obedecem à fórmula geral CnH2n–2, sendo n ≥ 3. As fórmulas solicitadas para propano, propadieno e etino são, respectivamente: 03 E Todo alcano tem fórmula geral CnH2n + 2, onde n é o número de carbonos e 2n + 2 é o número de hidrogênios. Dessa forma, 2n + 2 = 64. Logo, n será: 2n + 2 = 64 ∴2n = 64 – 2 ∴2n = 62 62 ∴n = ∴n = 31 2 Portanto, o composto apresenta 31 átomos de carbono. 4 04 a) 3 Metil CH H—C C — CH3 Alcino CH2 C CH2 Alcadieno HC 1 2 CH2 Cicleno O nome do composto é 3-metilbut-1-eno. b) Metil 1 Metil 2 3 4 5 Logo: I. (V) O hidrocarboneto A obedece à fórmula geral CnH2n+2, sendo, portanto, um alcano. II. (F) Apesar de obedecer à fórmula geral CnH2n, esse hidrocarboneto não pode ser um ciclano porque o número de carbono é menor que 3 (n < 3). III.(F) Apesar de obedecer à fórmula geral CnH2n–2, esse hidrocarboneto não pode ser nem um alcadieno nem um cicleno, porque o número de carbonos é menor que 3 (n < 3). Metil O nome do composto é 2,3,3-trimetilpentano. c) Metil 3 4 2 5 1 6 Etil O nome do composto é 1-etil-2-metilbenzeno. 2a Série – Ensino Médio 1 QUÍMICA 1 LIVRO 2 c)(F)Devido à presença da insaturação, os alcenos são um pouco mais solúveis em água que os alcanos. d)(F) Os alcinos são mais reativos que os alcenos e os alcanos. e)(F)Os alcenos são conhecidos como olefinas. Metil d) 1 2 3 4 5 6 7 Metil O nome do composto é 5,6-dimetilept-2-ino. 03 D e) 4 1 3 2 Metil O nome do composto é 3-metilciclobuteno. 04 E f) Composto I: Metil Metil 1 2 3 Metil 5 7 5 3 6 4 2 3,3,6-trimetileptano Metil Composto II: O nome do composto é 1,1,3-trimetilciclopentano. Etil 05 Os compostos dados são alcanos com o mesmo número de carbonos e hidrogênios e nesses casos, quanto maior for o número de ramificações, menor será o ponto de ebulição. Logo, a ordem crescente do ponto de ebulição é C < B < A. Metil 1 4 Metil Ao completar as lacunas, tem-se: O tolueno e a naftalina são hidrocarbonetos aromáticos, enquanto que o propeno e o but-2-ino são hidrocarbonetos acicíclicos insaturados de cadeia normal. Dessa forma, as palavras que completam corretamente o texto são: hidrocarbonetos e insaturados. Segundo a IUPAC, eles são denominados, respectivamente, heptano, 3-metilexano e 2,3-dimetilpentano. 5 7 4 6 1 3 2 4-etileptano Composto III: Etil Atividades propostas 2 1 3 6 4 5 01 B Metil 1 2 6 4-etil-3-metileptano Metil Metil 05 E 3 5 7 Composto I: Composto II: 4 Propil Benzeno O nome correto do composto é: 1,2-dimetil-3-propilbenzeno. 02 B Após analise das afirmações, é possível concluir: a)(F)Os alcanos, por serem compostos apolares, são insolúveis em água. b)(V)As ligações intermoleculares nos alcanos são mais fracas do que as da água, o que deixa suas moléculas mais afastadas, tornando sua densidade menor do que a da água. 2 Tolueno Composto III: a) o-xileno b) m-xileno c) p-xileno Os compostos I, II e III são denominados, usualmente, benzeno, tolueno e xileno. 2a Série – Ensino Médio QUÍMICA 1 LIVRO 2 06 C 5 1. 4 3 2 1 e) Pent-2-ino 1 2. Cicloexano 4 3 2 Etil f) 2-etilbut-1-eno 3. 8 7 Hexano 6 5 4 3 2 1 Metil Octa-1,5-dieno Metil 4. 1 g) 1 2 3 Metil 2 3 Metil 2 3 4 5 1 2 3 4 Buta-1,2-dieno 2-etil-3-metilpent-1-eno , Ciclobuteno 10 a) Composto I: Para alcanos com o mesmo número de átomos de carbono por molécula (C5H12), quanto menor for o número de ramificações da cadeia carbônica, maior será o ponto de ebulição. 1 CH2 08 a) 4 4 , Buta-1,3-dieno 2 3 2 3-metilciclopropeno e 1 3 Metil 5 2 1-metilciclopropeno CH3 3 4 CH C CH3 CH3 Composto II: 1 Metil 3 3 Metil 07 B 2 2 1 (4)2,3-dimetilbutano (1)pent-2-ino (2)2-etilbut-1-eno (3)octa-1,5-dieno (5)2-etil-3-metilpent-1-eno 1 1 , 1 6 09 Com a fórmula molecular C4H6 são possíveis os seguintes hidrocarbonetos: 1 2 3 4 1 2 3 4 , , But-2-ino But-1-ino 4 Etil 5 2-metilex-3-eno 2,3-dimetilbutano 5. 4 CH2 2 CH 3 CH2 3,3-dimetilbut-1-eno 4 CH2 5 CH2 6 CH3 hex-1-eno b) O composto III deve apresentar temperatura de ebulição maior que 63 ºC, visto que possui maior cadeia carbônica e, consequentemente, maior massa molar. Metil 3,3-dimetilpenta-1,4-dieno b) 1 2 3 4 5 Capítulo 6 Pent-1-ino Atividades para sala c) 01 E Somente o composto a seguir é denominado tolueno. Ciclopropano d) Ressonância e aromaticidade 1 2 5 4 Metil 3 Etil 3-etil-4-metilciclopenteno 2a Série – Ensino Médio 3 QUÍMICA 1 LIVRO 2 02 D 04 Com a fórmula molecular C14H10, pode-se apresentar os seguintes hidrocarbonetos aromáticos: 14444244443 Benzeno – C6H6 144444444424444444443 C14H10 – Antraceno 144444424444443 Naftaleno – C10H8 144444444424444444443 C14H10 – Fenantreno 05 n = ? 9 pares de elétrons pi (p) são 18 elétrons pi (p). 16 Logo, 4n + 2 = 18 ∴ 4n = 16 ∴ n = ∴ n = 4. 4 Portanto, para uma substância aromática com 9 pares de elétrons pi (p) o valor de n é 4. 1444444442444444443 Antraceno – C14H10 Logo, as fórmulas moleculares dos hidrocarbonetos citados são, respectivamente, C6H6, C10H8 e C14H10. 03 C 01 D A estrutura a seguir apresenta carbono híbrido sp , ou seja, não pode ser aromática. 3 Atividades propostas Após as estruturas dos compostos A e B serem analisadas, conclui-se: a)(F)B é um hidrocarboneto. b)(F)Somente A é composto aromático. c)(F)O composto A é aromático e o B é alicíclico. d)(V)O composto A apesenta aromaticidade, visto que contém um anel benzênico. e)(F)O composto B não apresenta anel aromático. sp3 A segunda estrutura não obedece a Regra de Hückel, dessa forma, não é aromática. 02 A O o-xileno e o m-cresol são, respectivamente, um hidrocarboneto e um fenol aromáticos. 4n + 2 = 8 4n = 6 n= 6 3 ∴n = 4 2 Portanto, duas das estruturas dadas são aromáticas. 4 o-xileno 2a Série – Ensino Médio m-cresol QUÍMICA 1 LIVRO 2 03 D sp2 08 B sp2 p p sp2 sp2 B A 1444444442444444443 Após a análise das estruturas dos compostos A e B, conclui-se que o composto da estrutura B é mais estável, pois apresenta ressonância, enquanto o composto da estrutura A não apresenta. Vale ressaltar também que nenhuma das estruturas é aromática. FM=C4H5N Após análise da estrutura do pirrol, é possível concluir: a)(F)Sua fórmula molecular é C4H5N. b)(F)Todos os carbonos são sp2. c)(F)Não é aromático. d)(V) e)(F)Possui 6 elétrons pi (p). 09 E 04 C Os compostos tolueno, anilina e fenol são aromáticos e apresentam o fenômeno da ressonância. Devido à presença do anel benzênico, o composto é aromático. 10 p Tolueno Anilina Fenol p 06 D p p p Com 7 ligações pi (p), há 14 elétrons pi (p). Assim, aplicando a Regra de Hückel, tem-se: 4n + 2 = 14 4n = 12 ∴ n = p p p O solvente não deverá conter tolueno por ser um hidrocarboneto aromático. Tolueno p p 05 A p 12 ∴n = 3 4 Portanto, o valor de n é 3. 4n + 2 = 8 4n = 6 ∴ n = 6 3 ∴n = 4 2 Capítulo 7 Atividades para sala Após a estrutura do composto ser analisada e a Regra de Hückel ser utilizada, é possível concluir que: a)(F)O composto não é aromático. b)(F) É insaturado. c)(F)A cadeia é homocíclica. d)(V) e)(F)O benzeno é mais estável devido ao fenômeno da ressonância. 01 D I. (éter) II. 07 C Dentre os compostos dados, somente o ciclobutadieno não é aromático, sendo ele, portanto, o mais reativo, isto é, o mais instável. Sinopse das funções orgânicas (álcool) III. (aldeído) 2a Série – Ensino Médio 5 QUÍMICA 1 LIVRO 2 e) IV. (cetona) (A) – cetona (B) – aldeído V. (ácido carboxílico) Os compostos I, II, III, IV e V pertencem, respectivamente, às funções orgânicas éter, álcool, aldeído, cetona e ácido carboxílico. (C) – álcool 05 Ácido carboxílico Álcool 02 B OH CH Haleto orgânico Amina NH CH2 (D) – Éter Éter CH3 1442443 HO Fenol FM = C8H6OC l 2 OH a) As funções orgânicas presentes na estrutura desse herbicida são ácido carboxílico, éter e haleto orgânico. b) Sua fórmula molecular é C8H6OCl2. Após análise da estrutura da adrenalina, conclui-se que nela estão presentes grupos funcionais que identificam as funções orgânicas fenol, amina e álcool. 03 D Cetona Haleto orgânico Atividades propostas Fenol 01 B Éter Dentre os grupos funcionais dados, aqueles que caracterizam as funções éster e cetona são, respectivamente: 14444444444444244444444444443 FM = C14H12O3 O composto tem fórmula molecular C14H12O3, sendo aromático de função mista, apresentando grupos funcionais que caracterizam as funções orgânicas cetona, fenol e éter. 04 a) Carbonila ou . 02 A Éster O b) O Formila CH3O Éter p-metoxicinamato de octila (B) (A) c) d) Éster O Hidroxila O (D) (C) 1444444444442444444444443 C 3H6O 6 2a Série – Ensino Médio OH Homosalto Fenol QUÍMICA 1 LIVRO 2 Éster O O Após análise da estrutura de zingerona e do gingerol, conclui-se que nela estão presentes, respectivamente, as funções orgânicas éter, fenol, cetona e éter, fenol, cetona e álcool. 06 E N O Amina I II O Ácido carboxílico O Éster Éster —C O—C— OH Amina IV III Após análise dos grupos funcionais I, II, III e IV, conclui-se que eles pertencem às funções orgânicas aldeído, álcool, ácido carboxílico e éster. 07 C 04 D Aldeído I Haleto orgânico HO O I Éter CH2 I Haleto orgânico Tiroxina CH O C Éter (1) OH Ácido carboxílico Após análise da estrutura da tiroxina, conclui-se que nela estão presentes grupos funcionais que caracterizam as funções orgânicas fenol, haleto orgânico, éter, amina e ácido carboxílico. 05 D ( 6 ) amida Amina I NH2 Fenol Ácido carboxílico —C — C — OH H Após a analise das estruturas dos três bloqueadores solares, conclui-se que neles estão presentes éster, éter, fenol e amina. 03 B Álcool —C Padimato A Aldeído Ácido carboxílico ( 3 ) fenol (2) (3) ( 1 ) aldeído Fenol Cetona Cetona ( 5 ) amina Zingerona (4) Fenol Álcool Cetona (5) ( 2 ) ácido carboxílico Amina Gingerol Amida Fenol Éter ( 4 ) cetona (6) 2a Série – Ensino Médio 7 QUÍMICA 1 LIVRO 2 Aldeído 08 Amina Éter Amida O H2N N CH3 H O HO O O Ácido carboxílico Fenol CH3 Vanilina Após análise das fórmulas estruturais do acebutolol e da vanilina, identifica-se em cada um deles, as seguintes funções orgânicas: O H2N Álcool O C OH H C HO Cetona O Éster Aspartame Amida O Cetona Cetona Fenol O O OH Acebutolol Amida Amina Álcool Cetona Éter Aldeído Éter Fenol Vanilina 10 Após análise da estrutura do composto hipotético, identifica-se as seguintes funções: O Cetona CH3 N HO CH3 Álcool CH3 Álcool C Haleto orgânico Amina Aureomicina OH Éter Amida Enol OH O O Amina N Fenol OH Éster O O N OH H Após análise das fórmulas estruturais do aspartame e da aureomicina, identifica-se, em cada um, as seguintes funções orgânicas: O NO2 Aldeído Nitrocomposto Amida Amina Amida Aureomicina Álcool Amina Fenol Aspartame Ácido carboxílico Cetona Éster Haleto orgânico Cetona Álcool Amida Éter O O CH3 CH3 Amina N H N H 8 OH Br Cetona Haleto orgânico O Ácido carboxílico Aldeído, éter, álcool, enol, amina, amida, fenol, éster, ácido carboxílico, haleto orgânico, cetona e nitrocomposto. 09 O O CH3 CH3 Acebutolol 2a Série – Ensino Médio
Download