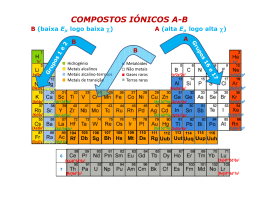
Química Geral - 2014/2015 Professor Valentim Nunes, Unidade Departamental de Engenharia email: [email protected] Gabinete: J207 Pág. Web: http://www.docentes.ipt.pt/valentim/ensino/quimica1.htm (é bastante útil a consulta desta página!) Why study chemistry? • Porque é necessário para obter a graduação em Engenharia!!! • Pela inúmeras aplicações no nosso dia-a-dia •Diferentes disciplinas dependem da Química: materiais, reacção química, energia, ambiente, bioquímica, etc. • Compreensão de aspectos ambientais: camada de ozono, chuva ácida, reacções nucleares, medicamentos, reciclagem, etc. Ver lição de apresentação! Planificação das aulas teóricas 1ª Semana 2ª Semana 18/09 25/09 Apresentação; Química e o nosso futuro Ferramentas da Química I 3ª Semana 4ª Semana 5ª Semana 6ª Semana 02/10 09/10 16/10 23/10 Ferramentas da Química II Ferramentas da Química III - Termoquímica Estrutura Atómica Tabela Periódica 7ª Semana 8ª Semana 9ª Semana 10ª Semana 11ª Semana 30/10 06/11 13/11 20/11 27/11 Ligação Química Estados da Matéria - Estado Gasoso (Cont.)Líquidos, Sólidos e Mudanças de Fase Propriedades Físicas das Soluções Equilíbrio Químico - Lei da Acção de Massas 12ª Semana 13ª Semana 14ª Semana 04/12 11/12 18/12 (Cont.) Equilíbrio Ácido-Base (Cont.) Equilíbrio de Solubilidade Revisões Ferramentas básicas da Química Química - É uma Ciência experimental que se ocupa do estudo da Matéria e das transformações que nela ocorrem. Matéria: Tudo o que possui massa e ocupa espaço. Substância pura: forma de matéria com composição bem definida e propriedades próprias. Exº: H2O, ouro, O2, etc.. Elementos: blocos básicos da matéria! Não podem ser decompostos por meios químicos em substâncias mais simples Compostos: combinação de dois ou mais elementos unidos quimicamente em proporções bem definidas e constantes. Misturas: combinação de duas ou mais substâncias que mantêm a sua identidade. Homogéneas: Constituídas por uma única fase uniforme Heterogéneas: múltiplas fases. Classificação da Matéria Elementos Elements… Elementos Elements… Estados da Matéria Todas as substâncias podem, em princípio, existir em três estados: Sólido Líquido Gasoso Unidades do Sistema Internacional (SI) Unidades de Base: comprimento (m); massa (kg); tempo (s), corrente (A); Temperatura (K); intensidade luminosa (cd); quantidade de substância (mol). Unidades derivadas: exº volume (m3); força (N); energia (J), etc. Conversão de unidades --> método do factor unitário = 1300 kg/m3 = 1300 kg/ m3 (1 m3/ 1106 cm3) (1000 g/ 1 kg) = 1.3 g/ cm3 Propriedades dos materiais Propriedades intensivas: não dependem da quantidade de matéria: exº densidade, temperatura… Propriedades extensivas: dependem da quantidade de matéria: exº massa, volume… Propriedades físicas: características que não alteram a composição química do material: exº ponto de fusão, temperatura, dureza, condutividade,.. Propriedades químicas: envolvem a mudança de composição química: exº reactividade química, combustão, polimerização, explosividade,…. Densidade…. Density - an Intensive, Physical Property • For Most materials, density decreases with temperature as the volume increases -- not so for water If the density of ice at 0° C is 0.917 g / ml how much mass of ice is there in 75 ml of ice? = m/V m = V = 0.91775 = 69 g Teoria atómica Dalton: elementos são constituídos por partículas pequenas, chamados átomos. Os átomos de um dado elemento são iguais, indivisíveis e indestrutíveis (Not true!!) Estrutura do átomo Thomson: electrões Rutherford: protões e o núcleo. Chadwick: neutrões. The Nuclear Atom Relações mássicas Número atómico, Z: número de protões do núcleo. Número de massa, A: número de protões + número de neutrões do núcleo. Um átomo X é designado por A Z X Isótopos: átomos de um mesmo elemento mas com diferente número de massa. Unidade de massa atómica: propriedade fundamental dos átomos. Por Convenção Internacional 1 u.m.a. é igual a 1/12 da massa de um átomo de carbono 12, 12C 6 Massa atómica: é a massa média pesada de um elemento, tendo em conta a abundância natural relativa dos isótopos desse elemento. Relações mássicas Mole, mol: Quantidade de substância que contem o mesmo número de entidades elementares (átomos, moléculas, iões ou outras partículas) quantos os átomos existentes em exactamente 12 g de carbono-12. 1 mol contem sempre o mesmo número de partículas. Constante de Avogadro: NA 6.022 1023 mol-1 Massa molar: a massa em gramas de 1 mol de átomos de um elemento. A massa molar é a quantidade em gramas numericamente igual à massa atómica em u.m.a. Moléculas, Iões e seus compostos Molécula: agregado de pelo menos dois átomos ligados por forças químicas. É a mais pequena entidade em que uma substância pura, como o açúcar ou água, pode ser dividida e ainda reter a composição e propriedades químicas da substância. São representadas por fórmulas: molecular: C2H6O condensada: CH3CH2OH estruturais: Iões: Um ião é um átomo ou grupo de átomos que tem uma carga positiva ou negativa - monoatómicos ou poliatómicos. Catiões: Al3+, Cu2+, NH4+, ….. Aniões: O2-, F-, CO32-, …. Compostos Compostos iónicos Para escrever a fórmula de um composto iónico usamos a “regra do abraço”:o índice do catião é numericamente igual á carga do anião, e o índice do anião é numericamente igual à carga do catião. Ca2+ + Cl- CaCl2 ; Al3+ + O2- Al2O3 Compostos moleculares: não-iónicos, resultam geralmente da combinação de dois elementos não-metálicos. Massa molar de um composto: é a massa em gramas do número de Avogadro de moléculas (ou unidades de fórmula num composto iónico). Calcula-se pela soma das massas atómicas dos elementos constituintes. Composição percentual dos Compostos Composição percentual de um composto: é a percentagem em massa de cada elemento num composto. Exº NH3 %N = (massa N/massa de NH3) x100 = (14.007/17.031)x100 = 82.24% %H = (3xmassa de H/massa de NH3)x100 = 17.76% Obtenção de fórmulas empíricas e moleculares: --> converter massa em % --> converter massa em número de moles --> encontrar a razão entre o número de moles de cada elemento (permite obter a fórmula empírica) --> a partir da massa molar, obter a fórmula molecular Nomenclatura de compostos Inorgânicos Compostos iónicos: muitos compostos iónicos são binários ou formados apenas por dois elementos. O primeiro elemento nomeado é o anião não-metálico, seguido do catião. O nome do anião obtém-se adicionando a terminação “eto” A terminação em “eto” é também usada para alguns grupos aniónicos com elementos diferentes como o ião cianeto (CN-). Com excepção do ião amónio (NH4+), todos os catiões com interesse resultam de átomos de metais e recebem o nome dos seus elementos. Exemplos: NaCl : cloreto de sódio KBr : brometo de potássio ZnI2 : iodeto de zinco Al2O3 : óxido de alumínio (!) Nomenclatura de compostos Inorgânicos Nomes e fórmulas de alguns catiões e aniões inorgânicos comuns Catião Anião __________________________________________________________________ Amónio, NH4+ Carbonato, CO32Bário, Ba2+ Clorato, ClO3Sistema de Stock: Cádmio, Cd2+ Cloreto, ClCálcio, Ca2+ Cromato, CrO42FeCl2: cloreto de ferro (II) + 2Césio, Cs Dicromato, Cr2O7 FeCl3: cloreto de ferro (III) Chumbo(II), Pb2+ Fluoreto, FCrómio, Cr3+ Hidreto, HCobre(I) ou cuproso, Cu+ Hidrogenocarbonato ou bicarbonato, HCO3Cobre(II) ou cúprico, Cu2+ Iodeto, IFerro(II) ou ferroso, Fe2+ Nitrato, NO3Ferro(III) ou férrico, Fe3+ Nitreto, N3Lítio, Li+ Óxido, O2Potássio, K+ Peróxido, O22Sódio, Na+ Sulfato, SO42Zinco, Zn2+ Sulfureto, S2____________________________________________________________________________________________________________ Nomenclatura de compostos Inorgânicos Compostos moleculares: Ao contrário dos compostos iónicos, os compostos moleculares contêm unidades moleculares discretas. A nomenclatura de compostos binários é semelhante aos compostos iónicos. Exemplos: HCl : cloreto de hidrogénio; SiC: carboneto de silício Para outros compostos utilizam-se os prefixos gregos para indicar o número de átomos de cada elemento na molécula: Exemplos: CO: monóxido de carbono CO2: dióxido de carbono SO3: trióxido de enxofre PCl3: tricloreto de fósforo Nomenclatura de compostos Inorgânicos Ácidos e Bases: um ácido pode ser descrito como uma substância que liberta iões de hidrogénio, H+, quando dissolvida em água, enquanto uma base pode ser descrita como uma substância que cede iões hidróxido, OH-, quando dissolvida em água. Aniões cujo nome termina em “eto” formam ácidos com uma terminação em “ico” Exemplos: F- ,fluoreto HF, ácido fluorídrico Cl-, cloreto HCl, ácido clorídrico CN-, cianeto HCN, ácido cianídrico Nomenclatura de compostos Inorgânicos Os oxoácidos são ácidos que contêm hidrogénio, oxigénio e um outro elemento. Oxoácido ácido “per---ico” Remoção de todos os iões H+ Oxoanião “per--ato” +O ácido “--ico” “--ato” -O ácido “--oso” “--ito” -O ácido “hipo--oso” “hipo--ito” Nomenclatura de compostos Inorgânicos Ácido HClO4 (ácido perclórico) HClO3 (ácido clórico) HClO2 (ácido cloroso) HClO (ácido hipocloroso) Anião ClO4- (perclorato) ClO3- (clorato) ClO2- (clorito) ClO- (hipoclorito) Hidratos: são compostos que possuem um número específico de moléculas de água ligadas a si. Exemplos: BaCl2 ·2H2O MgSO4 ·7 H2O dihidrato de cloreto de bário heptahidrato de sulfato de magnésio Recomendações Finais Utilizem estes “slides” em conjuntos com as vossa notas da lição! Complementem o vosso estudo com a leitura do Capítulo 1 e 2 do Chang (R.Chang, Química, 11ª ed., McGraw-Hill, Lisboa, 2013) Resolvam os exercícios da 1ª série! Boa semana!
Download