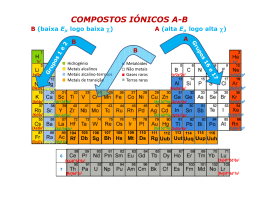
Ligação química em sólidos Sólidos covalentes Sólidos moleculares Sólidos metálicos Sólidos iónicos Ligação química em sólidos Sólidos covalentes → rede 3D de ligações covalentes C, diamante C, grafite Si, Ge, SiO2, ZnS, etc. Ligação química em sólidos Sólidos moleculares → forças intermoleculares Ligações de H Forças de van der Waals Ligação química em sólidos Sólidos metálicos → partilha de e-’s por muitos átomos iguais Fe Hg Ligação química em sólidos Sólidos iónicos → atracção electrostática entre iões de carga oposta + - + - - + + - + + + CaF2 NaCl AnBm Catiões (A): grupos 1, 2 e 13 (parte) Aniões (B): grupos 16, 17 e N Esferas rígidas (indeformáveis) com carga inteira Interacções electrostáticas → não direccionais → cristais 3D Estrutura resulta do balanço entre a estequiometria e as dimensões dos iões Estruturas de sólidos AB Ligação iónica NC=6 Estrutura do cloreto de sódio (NaCl) B A A = metais alcalinos (excepto Rb e Cs) B = halogenetos (X-), CN-, OH-, SH- A = metais alcalino-terrosos B = calcogenetos (O2-, S2-, etc.) Estruturas de sólidos AB Estrutura do cloreto de césio (CsCl) B A = Rb+, Cs+, Tl+, NH4+ B = halogenetos (X-) Ligação iónica NC=8 A Estruturas de sólidos AB Ligação iónica Estrutura da blenda (ZnS) NC=4 A B A = Be, Zn, Cd, Hg B = calcogenetos (O2-, S2-, etc.) Estruturas de sólidos AB2 Estrutura da fluorite (CaF2) Ligação iónica NC=8:4 B A MF2 (M = Ca, Sr, Ba, Ra, Pb, Cd, Hg, Eu) MO2 (M = Ce, Pr, Tb – (isto é, lantanídeos) e Th, Pa, U, Np, Pu, Am e Cm) Estruturas de sólidos AB2 Estrutura do rútilo (TiO2) Ligação iónica NC=6:3 B MO2 (M = Ge, Sn, Pb, Ti, Cr, Mn, Ta, Tc, Re, Ru, Os, Ir, Te) MF2 (M = Mg, Mn, Fe, Co, Ni, Zn, Pd) Energia reticular Ligação iónica Z1 Z 2 e 2 U '= 4πε 0 r Energia de Coesão (U’) 1 Interacção electrostática entre cargas (iões) + - + - + - + - - + - +r 6 r 3 +r + - - + + r 2 + NaCl Caso geral: r 5 - + + - U ' NaCl ⎞ 1 ⎛ 6e 2 12e 2 8e 2 6e 2 24e 2 = − + − + − + L⎟ ⎜ 4πε0 ⎝ r ⎠ r 2 r 3 2r r 5 U ' NaCl ⎞ 2 N ⎛ 6e 2 12e 2 8e 2 6e 2 24e 2 = − + − + − + L⎟ ⎜ 4πε0 ⎝ r ⎠ r 2 r 3 2r r 5 U ' NaCl 1 2N = 2 4πε0 - + U ' NaCl ⎞ ⎛ 6e 2 12e 2 8e 2 6e 2 24e 2 − + − + L⎟ ⎜− r + ⎠ ⎝ r 2 r 3 2r r 5 N e2 ⎛ ⎞ 12 8 6 24 = − + − + − L⎟ 6− ⎜ 4πε0 r ⎝ ⎠ 2 3 2 5 AN Z1Z 2 e 2 U' = − 4πε 0 r A depende apenas da estrutura (ANaCl= 1.74756) Energia reticular Ligação iónica U" = Forças repulsivas (U”) U "NaCl + - - + + - - + - +r - + r 5 r 2 - + ⎛ 2N ⎜ b b = 6 n + 12 2 ⎜ r r 2 ⎝ ( ) n - + - - + NaCl + - (r 3 ) U "NaCl ≅ N Caso geral: + +8 b n +6 b ( 2r ) desprezam-se (n elevado) +r 6 r 3 - + b rn + 6b rn xb U" ≅ N n r n ⎞ + L⎟ ⎟ ⎠ Energia reticular Ligação iónica Juntando a coesão com a repulsão… ⎛ AZ1Z 2 e 2 xb ⎞ + n ⎟⎟ U = U '+ U " = N ⎜⎜ − r ⎠ ⎝ 4πε 0 r Energia ⎛ AZ1Z 2e 2 xbn ⎞ ⎛ dU ⎞ − n +1 ⎟⎟ = 0 ⎜ ⎟ = N ⎜⎜ 2 ( ) πε r r0 ⎠ 4 dr ⎠ r =r0 ⎝ 0 0 ⎝ U” r0 0 r U AZ1 Z 2 e 2 xbn AZ1 Z 2 e 2 r0n −1 = →b= (4πε0 )r02 r0n +1 (4πε0 ) xn E0 ⎛ AZ Z e 2 AZ Z e 2 r n −1 ⎞ U = − N ⎜⎜ 1 2 − 1 2 0n ⎟⎟ n(4πε 0 )r0 ⎠ ⎝ (4πε 0 )r0 U’ Equação de Born-Landé U ret AZ1 Z2 e 2 ⎛ ⎜1 − U = −N ( 4πε0 ) r0 ⎝ AZ1Z 2 e 2 ⎛ 1 ⎞ = −U = N ⎜1 − ⎟ (4πε 0 ) r0 ⎝ n ⎠ Parte atractiva Parte repulsiva 1⎞ ⎟ n⎠ Energia reticular Ligação iónica Constante de Madelung, A Constante de compressibilidade de Born, n Estrutura NC Iões A Cloreto de sódio 6:6 M+, X– 1,74756 Conf. electr. do ião Exemplo n Cloreto de césio 8:8 M+, X– 1.76267 He Li+ 5 Blenda 4:4 M+, X– 1,63806 Ne F–, Na+ 7 Wurtzite 4:4 M+, X– 1,64132 Ar Cl–, K+, (Cu+) 9 Fluorite 8:4 M2+, 2X– 2,51939 Kr Br–, Rb+, (Ag+) 10 Rútilo 6:3 M2+, 2X– 2,408 Xe I–, Cs+, (Au+) 12 Curundum 6:4 2M3+, 3X2– 4,1719 Conhecendo a estrutura (A) e a constante de compressibilidade, podemos usar a eq. de Born-Landé: U ret AZ1Z 2 e 2 ⎛ 1 ⎞ = −U = N ⎜1 − ⎟ (4πε 0 ) r0 ⎝ n ⎠ Energia reticular Ligação iónica Se não soubermos A ou n: Equação de Kapustinskii U ret 1,214 × 105 νZ1Z 2 ⎛ 34,5 ⎞ ⎟⎟ ⎜⎜1 − = rc + ra ⎝ rc + ra ⎠ kJ mol-1 (raios expressos em pm) U ret AZ1Z 2 e 2 ⎛ 1 ⎞ = −U = N ⎜1 − ⎟ (4πε 0 ) r0 ⎝ n ⎠ ν – nº de iões na fórmula Z1 – módulo da carga do catião Z2 – módulo da carga do anião rc – raio do catião ra – raio do anião r0 = rc + ra – distância entre iões Ciclos de Born-Haber (lei de Hess) 200 + - Na (g) + e + Cl(g) 180 160 ∆ H = -EA(Cl) = -83,3 140 Energia /kcal mol -1 120 ≡ EI1(Na) = 118,4 ∆H = + - Na (g) + Cl (g) 100 EA e Uret: grandezas de determinação experimental difícil 80 60 40 20 1 1 Na(g) + /2Cl2(g) 1 Na(s) + /2Cl2(g) 0 ∆ H = -Uret(NaCl) = -188,1 Na(g) + Cl(g) /2∆ diss H(Cl2) = 28,9 ∆ subH(Na) = 25,9 (estado inicial) -20 -40 o ∆ fH (NaCl) = -98,2 -60 -80 -100 Previsão da estabilidade termodinâmica de cristais iónicos NaCl(c) (estado final) ∆fH°(NaCl) = ∆subH(Na) + ½ ∆dissH(Cl2) + EI1(Na) – EA(Cl) – Uret(NaCl) Raios iónicos - Landé F– Li+ 2,01 Cl– (0.56) 2,57 (0,30) Na+ 2,31 2,66 (0.50) 2,81 (0,48) 2,82 (0,47) 3,00 (0,15) 3,28 3,56 2,98 3,29 (0,15) 3,43 (0,25) 3,71 3,23 (0,30) (0,23) 3,53 (0,14) (0,23) (0,28) (0,15) 3,02 (0,21) (0,14) (0,28) (0,55) (0,27) (0,33) (0,14) (0.18) Cs+ (0,17) 3,14 2,75 I– (0,23) (0,33) (0,16) Rb+ (0,18) (0,24) (0,35) K+ Br– 3,66 (0,29) (0,24) 3,95 Distâncias internucleares nos halogenetos de metais alcalinos d r r LiI → Iodetos tocam-se: d 2 = (2 r ) + (2 r ) ⇒ r = 2 2 d 2 1 ≈ 0 , 353 d 2 Raios iónicos - Pauling C r = Z ef (C depende da configuração electrónica) Conhecendo r0 para um dado cristal: ⎧r0 = rc + ra ⎪ Z ef ( an ) ⎨ rc ⎪ ra = Z ef ( cat ) ⎩ Pode-se obter C (no caso de se usar C para iões monovalentes) Correcção para iões de valência superior a 1: −2 n −1 cristalino univalente r = r ×Z Raios cristalinos (e univalentes) de Pauling (Å) H– 2,08 (2,08) He (0,93) Ne (1,12) Ar (1,54) Kr (1,69) Xe (1,90) Li+ 0,60 (0,60) Na+ 0,95 (0,95) K+ 1,33 (1,33) Rb+ 1,48 (0,48) Cs+ 1,69 (1,69) Be+2 0,31 (0,44) B+3 0,20 (0,35) Mg+2 0,65 (0,82) Ca+2 0,99 (1,18) Sr+2 1,13 (1,32) Ba+2 1,35 (1,53) Al+3 0,50 (0,72) Sc+3 0,81 (1,06) Y+3 0,93 (1,20) V+5 0,59 (0,88) Nb+5 0,70 (1,00) La+3 1,15 (1,39) Cr+6 0,52 (0,81) Mo+6 0,62 (0,93) Cu+ 0,96 (0,96) Ag+ 1,26 (1,26) Au+ 1,37 (1,37) Ce+4 1,01 (1,27) Zn+2 0,74 (0,88) Cd+2 0,97 (1,14) Hg+2 1,10 (1,25) Ga+3 0,62 (0,81) In+3 0,81 (1,04) Tl+3 0,95 (1,15) C+4 0,15 (0,29) N+5 0,11 (0,25) O+6 0,09 (0,22) F+7 0,07 (0,19) C–4 2,60 (4,14) N–3 1,71 (2,47) O–2 1,40 (1,76) F– 1,36 (1,36) Si+4 0,41 (0,65) P+5 0,34 (0,59) S+6 0,29 (0,53) Cl+7 0,26 (0,49) Si–4 2,71 (3,84) P–3 2,12 (2,79) S–2 1,84 (2,19) Cl– 1,81 (1,81) Ge+4 0,53 (0,76) As+5 0,47 (0,71) Se+6 0,42 (0,66) Br+7 0,39 (0,62) Ge–4 2,72 (3,71) As–3 2,22 (2,85) Se–2 1,98 (2,32) Br– 1.95 (1,95) Sn+4 0,71 (0,96) Sb+5 0,62 (0,89) Te+6 0,56 (0,82) I+7 0,50 (0,77) Sn–4 2,94 (3,70) Sb–3 2,45 (2,95) Te–2 2,21 (2,50) I– 2,16 (2,16) Pb+4 0,84 (1,06) Bi+5 0,74 (0,98) He (0,93) Ne (1,12) Ar (1,54) Kr (1,69) Xe (1,90) Raios termoquímicos - Yatsimirskii Raios aparentes de iões poliatómicos 200 + - Na (g) + e + Cl(g) 180 Uret 160 ∆ H = -EA(Cl) = -83,3 140 Energia /kcal mol -1 120 = EI1(Na) = 118,4 ∆H ≡ + - Na (g) + Cl (g) 100 80 60 40 20 1 1 Na(g) + /2Cl2(g) 1 Na(s) + /2Cl2(g) 0 ∆ H = -Uret(NaCl) = -188,1 Na(g) + Cl(g) /2∆ diss H(Cl2) = 28,9 U ret ∆ subH(Na) = 25,9 (estado inicial) (Kapustinskii) -20 -40 1,214 ×105 νZ1Z 2 ⎛ 34,5 ⎞ ⎜⎜1 − ⎟⎟ = rc + ra ⎝ rc + ra ⎠ o ∆ fH (NaCl) = -98,2 -60 -80 -100 NaCl(c) (estado final) rc ou ra Raios iónicos obtidos a partir de mapas de densidade electrónica LiF Distância do mínimo de densidade electrónica em relação ao núcleo do flúor / Å 2 1,2 1,6 0,80 0,40 0 2,0 Densidade electrónica / e Å-3 1,5 1,0 0,5 (min.) r (Li+) = 0,92 Å r (F-) = 1,09 Å 0 0 0,40 0,80 1,2 1,6 2 Li F Distância do mínimo de densidade electrónica em relação ao núcleo de lítio / Å Raios iónicos obtidos a partir de mapas de densidade electrónica Raios obtidos a partir de mapas de densidade electrónica Raios de Pauling Composto Catião Anião Catião Anião LiF Li+ (0,92) F−(1,09) Li+ (0,60) F−(1,36) NaCl Na+ (1,18) Cl−(1,64) Na+ (0,95) Cl−(1,81) KCl K+ (1,45) Cl−(1,70) K+ (1,33) Cl−(1,81) CaF2 Ca2+ (1,26) F−(1,10) Ca2+ (0,99) F−(1,36) MgO Mg2+ (1,02) O2−(1,09) Mg2+ (0,65) O2−(1,40) catiões >’s aniões <‘s catiões <’s aniões >‘s Transferência de densidade electrónica anião→catião: (algum) carácter covalente na ligação. Os iões não são esferas rígidas com carga inteira. Regras de Fajans – polarização provocada pelo catião no anião Z+ φ = r Potencial iónico do catião Polarizabilidade do anião Configuração electrónica do catião (Zef) Catião φ Catião φ Catião φ Li+ 1,67 Be2+ 6,46 B3+ 15,0 Na+ 1,05 Mg2+ 3,08 Al3+ 6,00 K+ 0,75 Ca2+ 2,02 Ga3+ 4,84 Relação entre estrutura e raios iónicos Para uma dada estequiometria (AB, por exemplo) a estrutura depende das dimensões relativas dos iões. Estequiometria AB NC = 4 (est. Blenda) NC = 6 (est. NaCl) NC = 6 (est. NaCl) A partir de que rc deixam de caber 6 aniões em volta do catião? NC = 8 (est. CsCl) anião catião No limite, os aniões tocam-se a ⎧⎪d = a 2 = 2( rc + ra ) ⎨ ⎪⎩a = 2ra + d a rc + ra a 2 = = ra a 2 ⇒ rc = ra 2 − 1 = 0,414 razões rc/ra inferiores a 0.414 → catiões menores → não suportam 6 aniões à volta Melhor aproveitamento do espaço com NC = 4 (est. da Blenda) Relação entre estrutura e raios iónicos NC = 8 (est. CsCl) A partir de que rc deixam de caber 8 aniões em volta do catião? Estequiometria AB NC = 4 (est. Blenda) NC = 6 (est. NaCl) NC = 8 (est. CsCl) d a a + d No limite, os aniões tocam-se a 2 a 2 ⎧d = a 3 ⎪⎪ ⎨d = 2( rc + ra ) ⎪ ⎪⎩a = 2 ra rc + ra a 3 = = ra a rc 3⇒ = ra rc/ra < 0.732 → NC = 6 3 − 1 = 0, 732 Relação entre estrutura e raios iónicos Estequiometria AB A B A B B A cloreto de sódio NC = 6 (octaédrica) blenda, wurtzite NC = 4 (tetraédrica) 0,414 = catião cloreto de césio NC = 8 (cúbica) 0,732 = anião rc/ra Propriedades físicas Pontos de fusão NaF (r0 = 2.31 Å), PF = 992 ºC CaO (r0 = 2.40 Å), PF = 2570 ºC F Cl Br I PF’s seguem a Uret: ↑ Z ↑PF ↑ r0 ↓PF Propriedades físicas Dureza 10 Dureza (Mohs) BeO 8 MgO 6 CaO 4 SrO 2 BaO 0 1.5 2 2.5 3 d(M-O)/Å Composto Dureza Dist. internuclear / Å NaF MgO 3,2 6,5 2,31 2,10 NaBr MgSe 2,5 3,5 2,75 2,75 Segue a Uret, como o PF Avaliação de Propriedades Físicas PF, PE, viscosidade, dureza, etc. Sólidos Covalentes Metais PF Sólidos Iónicos Fe, Co, Zn, etc. diamante, grafite (C), SiO2, Si, Ge, ZnS, etc. ligações covalentes direccionais (3D) NaCl, CaCl2, etc. grau de preenchimento da banda d Energia reticular, U (atracção entre iões opostos) Substâncias moleculares H2O, O2, etc. Forças intermoleculares: Lig. H > Forças vdW Forças de vdW: Nº de e-’s (α) excepto para moléculas pequenas (< 15 e-’s) muito polares (µ). Fragilidade Estrutura de equilíbrio deformação + + + + + Atracção entre cargas opostas Estrutura “deformada” + + + + + Repulsão entre cargas iguais Os cristais não se deformam – partem-se! Solubilidade Solventes polares → igual dissolve igual Ligações de H solvente–soluto? Melhor! + + + + + + + + + + + + M+(g) + X–(g) ∆H = Uret(MX) ∆hidH(M+) + ∆hidH(X–) + 1 Z1 Z2 e f = 4πε r 2 MX(c) 2 ∆dissolH(MX) M+(aq) + X–(aq) εágua = 78.4 ε0 ε↑ |∆hidH| ↑ Uret → solubilidade em solventes polares Z ↑ |∆hidH| ↑ Uret ↑ ↑ solubilidade diminui com carga A+B− mais solúveis que A2+B2− rc + ra ↑ |∆hidH| ↓ Uret ↓ ↓ solubilidade aumenta com o tamanho dos iões Condutividade eléctrica Isolantes no estado sólido (iões fixos). Condutores no estado fundido ou em solução (iões móveis).
Download