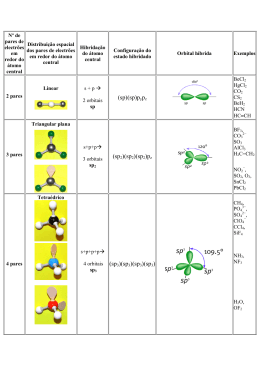
Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Prof. Dr. Ary da Silva Maia PRINCÍPIOS DE QUÍMICA INORGÂNICA TEORIA DA LIGAÇÃO DE VALÊNCIA - TLV Teoria da Ligação de Valência (TLV) • Interação entre orbitais de valência das espécies consideradas • Inicialmente era usada para explicar a existência de moléculas simples • Linus Pauling usou para complexos • Interação metal – ligante através de interação ácido - base de Lewis. • Esse modelo mostra porque os ligantes se dirigem para posições fixas no espaço Estados de spin alto e baixo • Para um complexo d6 ,pode-se esperar tanto um complexo paramagnético como diamagnético – De acordo com a regra de Hund: alto-spin – Se as energias dos orbitais forem divididas: baixo-spin Esquemas de Hibridização No de Coord. Arranjo do Átomo Doador Orbitais Hibridizados Tipo de Hibrid. Exemplo 2 Linear s, px sp [Ag(NH3)2]+ 3 Trigonal Planar s, px, py sp2 [HgI3]- 4 Tetraédrica s, px, py, pz sp3 [FeBr4]2- 4 Quadrada Planar s, px, py, dx2-y2 sp2d [Ni(CN)4]2- 5 Bipiramidal Trigonal s, px, py, pz, dz2 sp3d [CuCl5]3- 5 Piramidal Quadrada s, px, py, pz, dx2-y2 sp3d [Ni(CN)5]3- 6 Octaédrico s, px, py, pz, dz2, dx2-y2 sp3d2 [Co(NH3)6]3+ 6 Trigonal Prismático s, dxy, dyz, dxz, dz2, dx2-y2 sd5 [Mo(S2C2Ph2)3] OR s, px, py, pz, dxz, dyz sp3d2 Aplicando a TLV • Seja o íon Cr(III) – Um complexo octaédrico d3 3d 4s 4p Vacant orbitals available to accept ligand electrons – De acordo com o Esquema de Hibridização anterior, os orbitais necesários são: • s, px, py, pz, dz2, dx2-y2 Aplicando a TLV • Seja o íon Cr(III) – Com seis pares de elétrons dos ligantes e a hibridização dos orbitais: 3d sp3d2 Aplicando a TLV • Seja o íon Fe(III) – Um complexo octaédrico d5 • baixo-spin 3d 4s 4p 4d Vacant orbitals available to accept ligand electrons 3d sp3d2 Aplicando a TLV • Seja o íon Fe(III) – Um complexo octaédrico d5 • alto-spin 3d 4s 4p 4d Vacant orbitals available to accept ligand electrons 3d sp3d2 4d Aplicando a TLV • Seja o íon Ni(II) – complexo d8 tetraédrico, octaédrico, ou quadrado planar • tetraédrico sp3 3d • octaédrico sp3d2 3d 4d • Quadrado planar 3d sp2d 4p Molécula do [CoF6]3Co3+ Molécula do [Co(NH3)6]3+ Co3+ Molécula do [PtCl4]2- Pt2+ Molécula do [NiCl4]2- Ni2+ Teoria da Ligação de Valência • Princípio da Eletroneutralidade e Retroligações: – Seja o complexo [Fe(CN)6]3-, considerando-se a formação de ligações do tipo ácido-base de Lewis, a carga formal do metal seria -9 (6*2e- + 3). – Um metal pode ter uma carga formal tão negativa ? – Linus Pauling propôs 2 explicações possíveis: 1. Nos ligantes os átomos doadores apresentam alta eletronegatividade (O, N, halogênios, etc), assim o par eletrônico fica mais próximo deles do que do metal, não havendo transmissão da carga tão negativa para o metal. Quanto mais próxima de zero for a carga formal do átomo central, mais estável é o complexo. Exemplo: Teoria da Ligação de Valência • Principio da Eletroneutralidade e Retroligações 1. (continuação): [Be(H2O)4]2+ [Be(H2O)6]2+ [Al(H2O)6]3+ [Al(NH3)6]3+ [Be(H2O)4]2+ [Be(H2O)6]2+ [Al(H2O)6]3+ [Al(NH3)6]3+ Espécie Carga Espécie Carga Espécie Carga Espécie Carga Be - 0,08 Be - 1,12 Al - 0,12 Al - 1,08 4O - 0,24 6O - 0,36 6O - 0,36 6N - 1,20 8H 2,32 12 H 3,48 12 H 3,48 18 H 2,88 Total 2.00 2. Total 2,00 Total 3,00 Total Em compostos de coordenação com ligantes aceptores (como CO, CN-, NO, PR3 e muitos outros), pode haver estabilidade mesmo com o metal em baixo estado de oxidação e com doadores pouco eletronegativos. 3,00 Teoria da Ligação de Valência • Principio da Eletroneutralidade: 2. (continuação): Isto pode ser visualizado na figura 3, enfocando o complexo [Fe(CN6)3-], onde se mostra como a carga negativa do elemento central pode ser deslocada para o ligante. Neste exemplo, o cianeto se coordena ao ferro(III), formando uma ligação σ, numa típica interação ácido-base de Lewis. Ao mesmo tempo, o ferro(III) estabelece uma ligação π com o cianeto mediante a combinação do seu orbital dxy (preenchido) com um dos orbitais π* (pi antiligante, vazio) do cianeto, originando uma ligação do tipo π (pi), estabilizando o composto. Teoria da Ligação de Valência • Principio da Eletroneutralidade: 2. (continuação): Teoria da Ligação de Valência • Pró: – Racionaliza a estereoquímica e as propriedades magnéticas • Contra: – Distinção entre spin alto e baixo é enganosa – Não pode prever porque certos ligantes são associados com complexos de spi alto ou baixo
Download