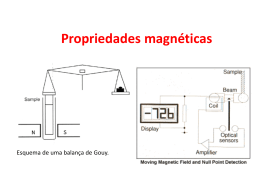
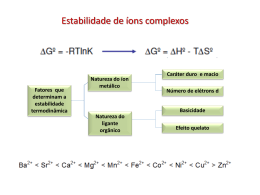
Química dos Compostos de Coordenação Gabriel Varela Monteiro Lino – 15731 Giuliano Lembo Caterina – 15732 Engenharia De Produção Mecânica, 2008 Universidade Federal de Itajubá Complexos Metálicos • Definição: união de um íon metálico central a um grupo de moléculas ou íons vizinhos • Os compostos que contém complexos são conhecidos como compostos de coordenação • As moléculas ou íons que circundam o íon metálico em um complexo são conhecidos como ligantes Exemplo de Complexo Metálico Teoria de Werner • Werner propôs que os íons metálicos possuem valência primária e secundária • O metal central e os ligantes unidos a ele constituem a esfera de coordenação do complexo, que deve estar entre colchetes na apresentação da fórmula química • A Teoria de Werner explica o fato de haver duas formas distintas de arranjar os ligantes em um composto chamadas cis e trans, resultando em diferentes cores para os complexos. Ligação Metal – Ligante • Exemplo de interação entre uma base de Lewis e um ácido de Lewis • Altera profundamente as propriedades físicas e químicas observadas para o íon metálico e os ligantes Cargas, número de coordenação e geometrias • A carga de um complexo é a soma das cargas do metal central e de seus ligantes circundantes • O número de coordenação de um íon metálico é geralmente influenciado pelos tamanhos relativos do íon metálico e dos ligantes circundantes • Complexos tetracoordenados têm duas geometrias comuns: quadrática plana e tetraédrica – Tetraédrica é a mais comum das duas, estando particulamente presentes entre os metais que não são de transição – Quadrática Plana é característica de íons de metais de transição com oito elétrons d no nível de vâlencia • Complexos hexacoordenados possuem geometria octaédrica Exemplos de geometrias Tetraédrica Quadrática Plana Octaédrica Ligantes Monodentados e Polidentados • Ligantes monodentados possuem um único átomo doador e ocupam apenas um sítio em uma esfera de coordenação.Ex:NH3 • Ligantes polidentados têm dois ou mais átomos doadores, consequentemente ocupando dois ou mais sítios de coordenação.São também conhecidos como quelantes. – Bidentado: etilenodiamina – Polidentado: EDTA Efeito Quelato • Definição • Exemplo: “Agentes Sequestradores” • EDTA X ìons metálicos que catalisam reações de decomposição • Remoção de íons prejudiciais à saúde(Hg²+, Pb ²+, Cd ²+) • Captura de íons metálicos essenciais à vida de líquens e musgos Porfirina • Um dos agentes quelantes mais importantes da natureza são os derivados da molécula de porfirina • Os complexos derivados da porfirina são chamados porfirinas. Dos mais importantes estão o heme(contém Fe ²+) e a clorofila que contém Mg ²+) – O grupo heme está presente na mioglobina, encontrada nas células do músculo esquelético e também na hemoglobina, proteína que transporta oxigênio no sangue humano – A clorofila é um processo chave na conversão da energia solar em formas que podem ser usadas por organismos vivos,processo chamado fotossíntese Batalha pelo ferro nos sistemas vivos • Apesar de ser essencial à vida humana o ferro apresenta dificuldade de assimilação no organismo devido à sua baixa solubilidade em água • Porém na presença de um ligante chamado sideroforo ,que é sintetizado por microorganismos, o ferro torna-se solúvel em água • Esse ligante ao invés de se tornar a solução para a anemia ferropriva criou um novo problema Nomenclatura de Química de Coordenação 1) 2) 3) 4) 5) 6) Nos sais dá- se o nome do ânion antes do nome do cátion seguido da palavra “de”. Em um íon ou molécula complexa, os ligantes recebem os nomes antes do metal e são relacionados em ordem alfabética, independentemente de carga. Os nomes dos ligantes aniônicos terminam com a letra “o”, enquanto os neutros ordinários possuem o nome das moléculas Os prefixos gregos são usados para indicar o número de cada tipo de ligante quando mais de um estiver presente Se um complexo for ânion, seu nome termina em _ato O número de oxidação do metal é dado em parentêses em algarismos romanos Isomerismo • Isomeros – O que são? • Classificados em dois tipos: Isômeros estruturais (ligações diferentes) Estereoisômeros (mesmas ligações, diferentes arranjos espaciais) Isomerismo Estrutural • Isomerismo de ligação: o ligante pode se coordenar ao metal de duas maneiras diferentes. Ex: NO2 ¯ • Isomerismo de esfera de coordenação: diferem dos ligantes diretamente ligados ao metal, em oposição a estar fora da esfera de coordenação na rede sólida. Ex: [CrCl3(H2O)6] ; existindo neste caso 3 formas comuns: [Cr(H2O)6]Cl3 ;[Cr(H2O)5Cl]Cl2·H2O; [Cr(H2O)4Cl2]Cl·2H2O Estereoisomerismo • É a forma mais importante de isomerismo. • Estereoisomeros possuem as mesmas ligações químicas mas diferem nos arranjos espaciais. • Classificados em dois tipos: Geométrico e Óptico Isomerismo Geometrico • Definição ? • Obs.: Como todos os vértices de um tetraedro são adjacentes entre si,o isomerismo cis-trans não é observado em complexos tetraédricos. Isomerismo Ótico - São capazes de desviar a luz polarizada. - Caso o isômero óptico provoque o giro da luz polarizada para a direita, o enantiômero é denominado dextrógiro (D,+). Caso o enantiômero provoque o giro da luz polarizada para a esquerda, o composto é denominado levógiro (L,); A mistura dos dois chama mistura racêmica. • Isomero ótico destrorrotatório Cor • Para que um composto tenha cor, ele deve absorver luz visível. • Luz visível ? • A energia de uma radiação magnética é inversamente proporcional ao seu comprimento de onda: • E = h. ƒ = h. (c/λ) Magnetismo • É importante se estudar cores e propriedades magnéticas dos complexos de metais de transição para o desenvolvimento de modelos modernos para a ligação metal-ligante. • Muitos complexos de metais de transição exibem paramagnetismo simples. Neles , os íons metálicos individuais possuem certo número de elétrons desemparelhados. Teoria do Campo Cristalino ·Ligação ente ligantes e um íon metálico, onde supõe-se que o único efeito dos ligantes seja criar um campo eletrostático em torno dos orbitais “d” do íon metálico. · Energia de desdobramento de campo cristalino (∆q): É a diferença de energia entre os grupos de orbitais. · A série espectroquímica relaciona os ligantes em ordem de suas habilidades de desdobrar as energias dos orbitais “d” em complexos octaédricos Cl¯ < F¯ < H2O < NH3 < en < NO2¯ (ligado por N) < CN¯ • A energia necessária para adicionar um quarto elétron a um orbital t2 de mais baixa energia é chamada de energia de emparelhamento de spin. • Os elétrons “d” a seguir preferencialmente se emparelham nos orbitais de mais baixa energia, produzindo um complexo de spin baixo. • Quando os elétrons ocupam orbitais d de energia mais alta de preferência a emparelharem-se no conjunto de orbitais de mais baixa energia, têm-se um complexo de spin alto. Referências Bibliográficas • Química: A Ciência Central. 9ª edição. Brown, Theodore L.; LeMay, H. Eugene Jr.; Bursten, Bruce E.; Burdge, Julia R
Download