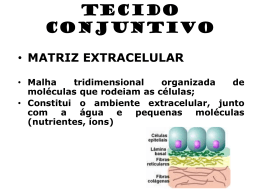
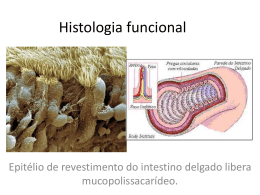
Matriz Extracelular Alves M.; Conceição C., Gomes M., Silva m. Serviço de Biologia Celular da Faculdade de Medicina da Universidade do Porto Lamina basal Exemplo de matriz em forma de placa fina e rígida, localizada por baixo de epitélios, nas células musculares, adipócitos, células de Schwann, glomérulo renal. Constituída por colagénio tipo IV, perlecano e proteínas de adesão como entactina ou laminina. Tem como funções: - separação das células que nela assentam do tecido conjuntivo envolvente; - determinação da polaridade celular; - diferenciação celular; - participação na migração celular e na regeneração tecidular; -“filtração” de moléculas de grande dimensão.1 Figura 4: Lâmina basal das cordas vocais (in www.scielo.br/img/revistas/ rhc/v59n2/a03fig01.gif) Figura 1: Matriz Extracelular vista ao Microscópio Electrónico (In http://bio.winona.edu/bates/Bio241/images/figure-04-28-1-photo.jpg) Glicocálice A matriz extracelular pode definir-se como um aglomerado tridimensional complexo de macromoléculas biológicas que interagem entre si e se ligam a receptores celulares, localizado no espaço intercelular1. É constituída por 4 grandes famílias de moléculas:2 Zona periférica de algumas células rica em glicídeos, especialmente exuberante no pólo apical de certas células epiteliais. Tem como funções a protecção da superfície celular e acção como marcadores para interacções celulares.1 • Colagénios • Proteoglicanos Figura 5: Glicocálice (in escuela.med.puc.cl/.../ fotosBig/Fotos/Fig18.jpg) • Glicoproteínas • Proteínas elásticas Estes componentes permitem que ocorram interacções entre células, mediadas por receptores. É graças a esta rede de conecções que se realizam os processos celulares, como aderência, morfogénese e apoptose, e se criam as características tecidulares (solidez, transparência).2 A diferente proporção de componentes determina diferentes tipos de matriz produzida pela globalidade dos tecidos, com função diferente. Podem distinguir-se dois compartimentos da matriz: um compartimento intersticial, mais vocacionado para conferir suporte físico e força mecânica (sobretudo em tecidos conjuntivos densos) ou para manter um ambiente hidratado em tecidos conjuntivos laxos; e um compartimento pericelular, com funções de adesão, migração, proliferação/ apoptose celular, influenciando a expressão genética e o comportamento celular. Zona Pelúcida A zona pelúcida é a camada de glicoproteína que envolve o oócito. Acredita-se que esta estrutura não celular é produzida pelo oócito e pelas células que o envolvem durante o desenvolvimento folicular. Ela consiste de duas camadas: uma camada externa espessa e uma camada interna fina que é mais difícil de penetrar. É importante durante a interacção do oócito/espermatozóide por causa dos receptores de espermatozóides na superfície do oócito e serve para proteger os oócitos e pré-embriões de antigénios durante o período de pré-implantação.1 Figura 6: (in www2.uerj.br/~micron/ atlas/repfem/imagef7.jpg) Glicoproteínas Figura 2: Tecido conjuntivo laxo: células residentes, como fibroblastos, ou migratórias, como macrófagos, separadas por fibras elásticas e colagénio. (In Figura 3: Tecido conjuntivo denso: poucas células, principalmente fibroblastos. Matriz extracelular muito abundante sendo o principal componente o colagénio. Pouca substância fundamental, como proteoglicanos. (in http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/Histologia Web/paginas/fotosBig/c95CK200_2.html) http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/Hist ologiaWeb/paginas/fotosBig/c96K403.html) Proteínas Fibrilares Proteínas conjugadas contendo um ou mais resíduos de hidratos de carbono ligados covalentemente.4 Alguns exemplos de glicoproteínas são: • Laminina – proteínas multiadesivas da lâmina basal que ligam colagénio tipo IV a receptores celulares específicos. É a proteína mais eficiente. Existe evidencia de que a laminina está relacionada com o crescimento e progressão de tumores.5 Mutações nos genes que codificam a laminina LAM A3, LAM B3 e LAM C2, podem causar a forma Herlitz da Epidermolise Bullosa: grupo de perturbações de fragilidade da pele, geneticamente determinadas que se caracterizam por formação de bolhas na pele e mucosa seguida de trauma mecânico. • Fibronectinas – proteínas multiadesivas que ligam colagénio e outras proteínas da matriz às integrinas que estão na membrana, ligando as células à matriz.3,6 Estruturas complexas que contém Elastina, microfibrilas de 10-12 nm, oxídase de lisil e proteoglicanos. Possuem dois componentes principais: uma fracção amorfa que não tem qualquer estrutura regular e que constitui cerca de 90% da fibra madura (é exclusiva em elastina) e um componente microfibrilar, que consiste em microfibrilas de 10-12 nm. • Fibrilhina – componente principal das microfibrilas, importante na deposição de tropoelastina e formação de fibras elásticas. A 3 As células produtoras de Elastina segregam Tropoelastina, que se transforma numa “rede” através da acção da oxidase de lisil, formando Elastina madura. 3 As propriedades da Elastina são essenciais para a função de tecidos como pulmões, a aorta e a pele. 3 A Síndrome de Williams esta relacionada com a delecção do gene que codifica a Elastina, Figura 7: Fibras elásticas vistas ao microscópio afectando o sistema nervoso central e o tecido conjuntivo. Uma diminuição anormal de Elastina leva ao envelhecimento, provoca enfisema pulmonar eléctrónico de varrimento. e cutis laxa, enquanto uma aumento da deposição de Elastina provoca doenças (in Molecular Biology of the Cell; 4th ed.Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; dermatológicas. Walter, Peter New York: Garland Publishing; c2002) função das microfibrilas ainda não está bem esclarecida, pois parecem ter várias funções globais. Actuam como base para a deposição de tropoelastina e formação da fibra elástica, podem contribuir para as propriedades mecânicas do tecido elástico maduro, permite ligação estrutural em tecido não elástico e liga células endoteliaias e epiteliais através de domínios de ligação. A fibrilhina é sintetizada como profibrilhina, que é segregada pela célula e desagregada na matriz extracelular, numa reacção que depende do cálcio. Posteriormente forma-se um grande agregado insolúvel. Mutações no gene para a fibrilhina-1 (FBN1) são a causa do síndrome de Marfan, um distúrbio dominante autossómico do tecido conjuntivo, incluído nas microfibrilopatias e que se manifesta nos tecidos ocular, esquelético e cardiovascular.1,2,6 Algumas anormalidades que decorrem do síndrome de Marfan são dolicostenomelia, aracnodactilia, escoliose, deformidades da parede torácica, estatura alta, laxidez ligamentar, mobilidade articular anormal e protusão acetabular. A maioria das manifestações cardiovasculares no síndrome de Marfan afectam as válvulas auriculoventriculares e a aorta. Nos pacientes com este síndrome verifica-se uma diminuição na síntese, secreção e reduzida deposição de fibrilhina na matriz extracelular. 3 Colagénio Proteoglicanos São constituídos por proteínas específicas ligadas covalentemente a glicosaminoglicanos – GAGs – (cadeias polissacarídicas formadas pela repetição de dissacarideos nos quais um resíduo é um açúcar aminado e o outro é um acido urónico, geralmente). Função: -conferem resistência aos tecidos; regulam o tráfego de moléculas e proporcionam uma difusão mais rápida (funções que advêm das suas características de moléculas hidratadas); -participam em cascatas de sinalização -regulam actividade de proteases e inibidores de proteases, O grupo dos proteoglicanos é muito heterogéneo, sendo que estas moléculas diferem na localização tecidular, na natureza da proteína e do GAG e na função que desempenham. Exemplos de proteoglicanos: perlecano, agrecano, sindecano, neurocano. Proteína mais abundante nos animais, com estrutura em hélice tripla e repetições da sequencia de aminoácidos: Glicina (importante para o empacotamento da proteína), x - normalmente Prolina, y - normalmente Hidroxiprolina (importantes para estabilizar a forma helicoidal e o grupo hidroxilo para formar ligações de hidrogénio entre prolina e hidroxiprolina). O colagénio é sintetizado fora da célula, por remoção da porção não-helicoidal do pré-colagénio sintetizado dentro da célula. Existem vários tipos de colagénio: Tipo de estrutura Figura 9: Agrecano (in medweb.unimuenster.de/.../buddeck/imagwe016.gif) Estrutura em hélice tripla por toda a molécula; Organiza-se em fibrilas (ligações covalentes entre as moléculas). I,II,III,V,XI Cartilagem Colagénio associado a Fibrilas Fibrilas ligadas entre si e ligadas a outros componentes da matriz; Interrompidas por partes não-helicoidais que aparecem como pontuações; Maior flexibilidade IX, XII, XIV, XVI Cartilagem Tendão, Ligamentos Colagénio formador de redes Forma estrutura em lâmina; IV, VII, (fibrilas de ancoragem) Lamina basal Conecta lâmina basal ao tecido conjuntivo subjacente Síndrome de Marfan Glicoproteínas e Proteoglicanos - Componentes da Matriz e Remodelação Cerebral10 Os componentes da matriz extracelular influenciam vários processos de remodelação da matriz do cérebro adulto relacionados com plasticidade sináptica, doenças inflamatóias, gliomas e angiogénese, daí a importância do seu estudo molecular para conhecimento do possível estado patológico do cérebro. Tenascina-c, glicoproteína matricial Neurocano, versicano, brevicano, proteoglicanos cujo GAG é Sulfato de Condroitina;apresentam dois domínios terminais globulares separados por uma longa região glicosilada 1) Perda de neurónios nas células piramidais do Hipocampo 2) Esclerose Múltipla 3) Alzheimer 4) Gliomas Pode decorrer de agressão farmacológica, de hiperexcitabilidade (casos de epilepsia) Resposta inflamatória pela qual Linfocitos T tornam terminais axónicos mielinizados em tecido glial cicatrizado; Aumento de Neurocano nas lesões activas. Resposta inflamatória inata contra a acumulação de depósitos amilóides da matriz extracelular; A remodelação da matriz extracelular é um meio da expansão de gliomas malignos; Estão associados a um aumento de TGF-β*, de Neurocano e Tenascina Presença nos tecidos Colagénio fibrilar Algumas doenças relacionadas com Colagénio: Figura 8: Perlecano (in ww.neuro.wustl.edu/.../muscle/perlecanmtjh.jpg) Tipo Figura 10: Colagénio (in Ushiki T.; Collagen fibers, reticular fibers, elastic fibers. A comprehensive understanding from a morphological viewpoint; Arch. Hist. Cytol.; 2002; vol 65:109-126) Síndrome de Ehlers-Danlos • Grupo heterogéneo de doenças genéticas do tecido conjuntivo não cartilagíneo (estão classificadas seis diferentes tipos); • Caracterizado por pele hiper-extensível, articulações anormalmente móveis e vasos frágeis; • Anomalias moleculares no colagénio e enzimas responsáveis pela sua maturação. A forma clássica da síndrome é devida a mutações do colagénioV. • Anomalias no colagénio I podem também ser responsáveis por esta síndrome. • Doença hereditária autossómica dominante caso a alteração genética se refira aos colagénios, ou recessiva caso se refira á tenascina. Osteogénese Imperfeita Estão descritos 4 tipos de Osteogénese Imperfeita (O.I.), no entanto a fragilidade óssea é um componente importante de várias outras síndromes descritas. A forma mais frequente é a OI tipo I caracterizada por baixa estatura, fracturas, escleróticas azuladas e esperança média de vida normal. Estão descritas mais de 200 mutações nos genes que codificam o Colagénio tipo I – COL 1 A1, COL 1 A2 e cerca de 80 mutações no gene COL 3 A1, que provocam Osteogénese Imperfeita.9 Epidermólise Bullosa Distrófica Ácido Hialurónico Localiza-se em filamentos centrais associados a proteínas e proteoglicanos, no cérebro adulto. Aumento de ac.hialuronico associado a aumento de hialunoridase fragmentos mais pequenos Moléculas sujeitas a digestão endocítica Aumento da angiogénese Aumento incidência epilepsia, meningite, encefalite Mutações no gene COL 7 A1, que codifica o Colagénio 7, provoca diminuição do número de fibrilas de ancoragem, o que induz os sintomas desta complicação: fragilidade da pele, bolhas, escaras, alterações das unhas.8 1 - Azevedo, C., Biologia Celular e Molecular, 3ª edição, Lidel, Porto, 1999 2 - Fichard A.; Chanul-Delalande H.; Ruggiero F; Le syndrome d’Ehlers-Danlos: l’arquitecture matricielle en question; Medecine/Sciences; 2003;19:443-52 3 - Robinson P.N.; Godfrey M.; The molecular genetics of Marfan syndrome and related microfibrilopathies; J Med Genet; 2000; 37:9-25 4 - http://cancerweb.ncl.ac.uk/cgi-bin/omd?query=glycoproteins 5 - Miyazaki K.; Laminin-5 (laminin-332): Unique biological activity and role in tumor growth and invasion; Cancer Sci.; 2006; 97(2):91-8 6 - http://www.exelinfo.com/espaniol/edicion_02/nota15.html# 7 – Grahame R.; Joint hipermobility and genetic collagen disorders: are they related?; Arch Dis Child; 1999; 80:188-191 8 - Solovan, C., The biomolecular and ultrastructural basis of epidermolisis bullosa, Acta Dermatovenerologia, APA vol 14, nº 4, 127-35 9 - Graham R., Joint hypermobility and genetic collagen disordes: are they relaated?, Arch. Dis Child. , 1999, 188-91 10 - Rauch, U., “Extracelular matrix components associated with remodeling processes in brain”, Cellular and Molecular Life Sciences, 2004, vol.61:2031-45
Download