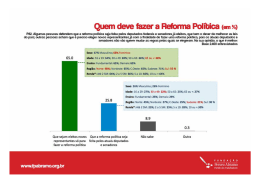
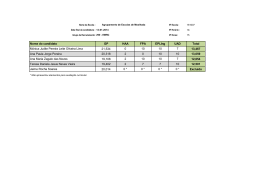
Química das Soluções Aquosas
Ácidos Polipróticos
• Num ácido (molécula ou ião) pode haver mais do que um
grupo capaz de se dissociar para dar iões H+.
• Como exemplo simples de solução de ácido poliprótico
vamos considerar um ácido diprótico que será representado
genericamente por H2A. Vamos admitir que a solução foi
preparada dissolvendo H2A em água e em quantidades tais
que H2A teria a concentração Ca se não reagisse.
• Por dissociação, poderão obter-se as bases HA– e A2– e as
constantes de acidez serão representadas por Ka1 e Ka2.
• Vamos discutir de que modo se podem fazer cálculos de
concentrações em equilíbrio nestas soluções.
Ácido Polipróticos
(Bases Polifuncionais) e Anfólitos
23de Março de 2006
2
1
Solução de um Ácido Poliprótico
• Fazendo um rearranjo na equação de balanço de materiais
Ca= [H2A] + [HA–] + [A2–]
= {[H2A]/[A2–] + [HA–]/[A2–] + 1}× [A2–]
e substituindo estes quocientes usando as equações de
equilíbrio, obtém-se
Ca= [A2–] ×{[H+]2/(Ka1 × Ka2)+ [H+] /Ka2 + 1}
[A2–] = Ca/{[H+]2/(Ka1 × Ka2)+ [H+]/Ka2 + 1}
• Procedendo de modo análogo com equação de balanço de
cargas: [H+] = [OH–] + [HA–]+2×[A2–]
[H+] = [OH–] +{[H+] /Ka2 + 2}× [A2–]
e, a seguir, substitui-se [A2–] pela expressão anterior.
• Equações de Equilíbrio:
– Autodissociação da água
H2O ⇄ H+ + OH–
Kw= [H+]×[OH–]
– Equilíbrios de dissociação do ácido diprótico
Ka1= [H+]×[HA–]/[H2A]
H2A ⇄ H+ + HA–
–
+
2–
HA ⇄ H + A
Ka2= [H+]×[A2 –]/[HA–]
• Equações de balanços:
Balanço de materiais:
Balanço de cargas:
Solução de um Ácido Poliprótico:
(1de2)
Cálculo de [H+]
Ca= [H2A] + [HA–] + [A2–]
[H+] = [OH–] + [HA–]+2×[A2–]
3
Solução de um Ácido Poliprótico:
(2de2)
Cálculo de [H+]
Cálculos Aproximados
• Para ficar com uma equação em [H+] vai também subtituirse [OH–] = Kw /[H+] e obtém-se:
[H + ]
+2
K
Ka2
[ H + ] = w+ + Ca ×
[ H + ]2
[H + ]
[H ]
+
+1
K a1 × K a 2 K a 2
Desembaraçando de denominadores vai dar uma equação
do 4º grau para a qual não existe fórmula resolvente.
• Se a solução tivesse sido preparada a partir dum sal (NaHA
ou Na2A) podia fazer-se um tratamento semelhante não
esquecendo de introduzir nas equações [Na+] e Cs.
5
Ácido Polipróticos e Anfólitos
4
• No caso de soluções de ácido diprótico, tem que se
resolver uma equação do 4º grau em [H+] e quanto mais
grupos ácidos houver na molécula, maior será o grau da
equação.
• Na prática, é muitas vezes possível fazer aproximações a
fim de simplificar os cálculos.
• Se a diferença de valores de Ka for suficientemente grande
(pKa2 - pKa1 > ~4), haverá situações (e gamas de pH) em
que os equilíbrios podem ser considerados independentes o
que quer dizer que podemos estudar a dissociação de um
dos grupos ácidos como se o ácido fosse monoprótico sem
interferência do outro grupo ácido.
6
1
Química das Soluções Aquosas
pH da Solução dum Anfólito
(1 de 4)
pH da Solução dum Anfólito
(2 de 4)
• Anfólito (ou anfótero) é uma substância que se
pode comportar como ácido ou como base. Há
muitos exemplos de anfólitos e vai considerar-se o
caso dum ião representado genericamente por HA–
H2A ⇄
HA– ⇄
A2–
H+
H+
• Admite-se que a solução é preparada a partir do
sal NaHA (Cs é a concentração do sal).
Neste caso, não será possível fazer os cálculos
considerando apenas um dos equilíbrios pois HA–
está envolvido nos dois equilíbrios.
• Consideram-se equações de balanço de materiais
[Na+] = Cs e
Cs = [H2A] + [HA–] + [A2–]
e de balanço de cargas
[Na+] + [H+] = [OH–] + [HA–] + 2 [A2–]
e vamos substituir na equação de balanço de
cargas [Na+] por {[H2A] + [HA–] + [A2–]}
[H2A]+[HA–]+[A2–]+[H+] = [OH–]+[HA–]+ 2 [A2–]
[H2A]+[H+] = [OH–]+[A2–]
7
8
pH da Solução dum Anfólito
(3 de 4)
pH da Solução dum Anfólito
(4 de 4 )
• Usando as equações de equilíbrio para substituir os valores
[H2A] e [A2–] em função de [HA–] e [OH–] = Kw /[H+] vem
[H+] ×[HA–]/Ka1 +[H+] = Kw /[H+] +Ka2 ×[HA–] /[H+]
desembaraçando de denominadores e agrupando, fica:
• Como aproximação, considera-se [HA–]≈Cs
ficando
[H + ] =
K a1 × {K w + K a 2 × [ HA ]}
K a1 + [ HA− ]
−
• Se tivéssemos continuado com o método de substituição
para resolver o problema, obtinha-se uma equação do 4º
grau de difícil de resolução pelo que é preferível recorrer a
métodos aproximados.
[H + ] ≈
K a 1 × {K w + K a 2 × C s }
K a1 + C s
• E se for Ka1<<Cs e Kw<< Ka2×Cs, fica
[ H + ] ≈ K a1 × K a 2
ou seja pH ≈ (pKa1+pKa2)/2
9
Aproximações e Cálculos Iterativos
• Ao calcular concentrações de espécies em equilíbrio em
soluções que contêm ácidos polipróticos é muitas vezes
necessário recorrer a aproximações e, no caso da solução
de anfólito, admitiu-se [HA–] ≈Cs.
• Mas quando se faz uma aproximação deve-se confirmar
que a aproximação é legítima. Neste caso, podia usar-se a
equação de balanço de materiais Cs = [H2A]+[HA–]+[A2–]
na forma Cs = [HA–] {[H2A]/[HA–]+1+[A2–] /[HA–]} e
obtém-se [HA–]=Cs/{[H+]/Ka1 +1+ Ka2/ [H+]}. O valor
estimado [H+] permite agora calcular o valor de [HA–].
• Compara-se este valor de [HA–] com Cs e caso sejam
diferentes introduz-se o valor calculado para [HA–] na
expressão deduzida anteriormente (em vez de Cs).
11
Ácido Polipróticos e Anfólitos
10
Outras Soluções como por Exemplo
Solução de Acetato de Amónio
• Solução de acetato de amónio (NH4+)(CH3CO2-)
– Notar que neste sal se tem um ácido (ião amónio) e uma
base (ião acetato) em quantidades equimolares.
• É uma situação comparável à solução de um
anfólito e que pode ser tratada de um modo
paralelo ao que se fez para a solução do anfólito
NaHA mas tendo em conta que se tem neste caso
[NH4+]+[NH3] = Cs = [CH3CO2H]+[CH3CO2-]
– Designando as constantes de dissociação do ácido
acético por Kac e a do ião amónio por Kam obtinha-se:
pH ≈ (pKac+pKam)/2
12
2
Download